Асептическое воспаление сустава лечение
В ортопедии встречаются состояния, которые сложно выявить на начальном этапе их развития. К их числу относится инфекционный артрит. Процесс представляет собой быстропрогрессирующее поражение суставов, в 80% случаев вызывающее их деструкцию. При первом ухудшении самочувствия важно обратиться к ортопеду и ликвидировать инфекционный артрит – симптомы и лечение относятся к спектру деятельности именно этого специалиста. Высокий риск развития осложнений и возможная инвалидность – аргументы, которые должны послужить основанием для диагностики и терапии болезни.
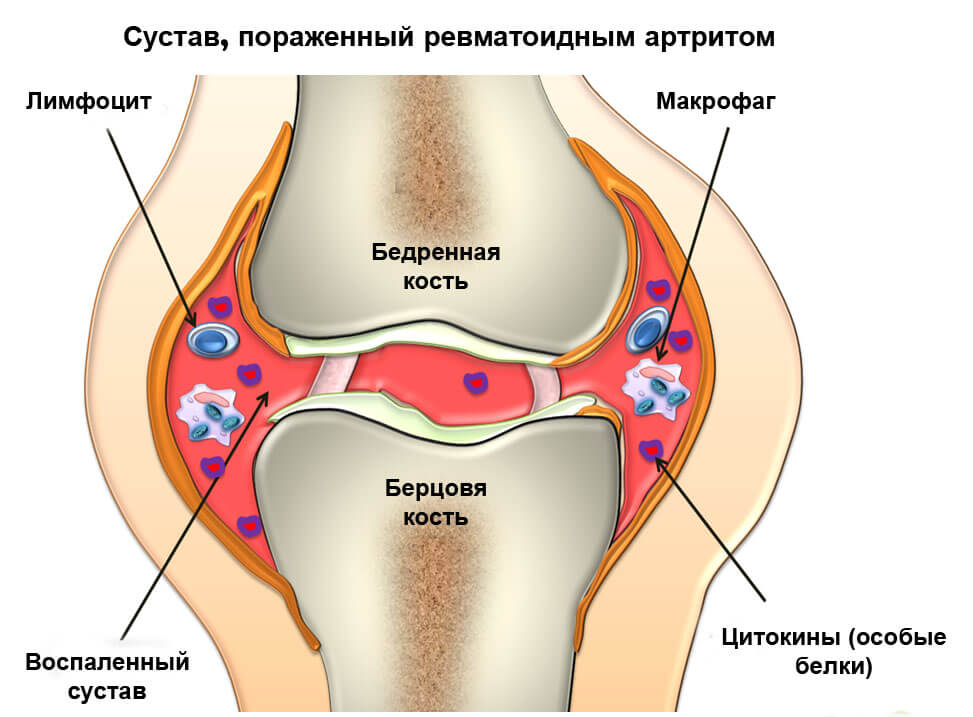
Патогенез инфекционного артрита
Важно знать! Врачи в шоке: “Эффективное и доступное средство от АРТРИТА существует…” Читать далее…
Проникновение болезнетворных микроорганизмов внутрь синовиальной оболочки приводит к активации воспалительного ответа клеток. Естественная реакция в этом случае – выделение организмом веществ, формирующих воспаление. Происходит эта реакция внутри суставной полости.
Под воздействием продуктов жизнедеятельности болезнетворных микроорганизмов стимулируется ответ иммунитета человека. Различные медиаторы высвобождаются. Патология развивается вследствие скопления противовоспалительных соединений – цитокинов. К ним присоединяется продукт самопереваривания (аутолиза) фагоцитов — протеиназа. В итоге происходит торможение синтеза хряща с его последующей деградацией и нарушением структуры не только хрящевой, но и костной ткани. Перечисленные процессы приводят к образованию костного анкилоза.

Так выглядит разрушенная хрящевая поверхность.
Патогенная микрофлора проникает внутрь сустава следующими путями:
- посредством гематогенного распределения из первичного очага в период временной или стойкой бактериемии (этот путь попадания признан преимущественным);
- лимфогенным (возбудители перемещаются в ткани сустава из близлежащего очага инфекции);
- вследствие прямого попадания. Чаще инфицирование таким путем происходит после неудачного проведения медицинских манипуляций (артроцентеза, артроскопии) и повреждений проникающего вида, обусловленных воздействием шипов растений или других контаминированных предметов.
Заболевание классифицируется по виду возбудителя. Поэтому инфекционное воспаление суставов бывает бактериальным (септическим) и вирусным. Если произошла непосредственная инвазия синовиальной оболочки гноеродной микрофлорой, развивается септический артрит.
Клиническая картина
Рассматриваемой патологии свойственно острое начало. Симптомы инфекционного артрита предполагают следующие проявления:
- Выраженный болевой синдром. Интенсивный дискомфорт побуждает пациента обратиться за медицинской помощью. С появления боли в суставах начинается клиническое течение артрита инфекционного происхождения. В 90-95% случаев на фоне инфекции происходит поражение только одного сустава (чаще это физиологически крупные суставы – коленный, тазобедренный).
- Повышение температуры тела. Локальная гипертермия наблюдается на начальных стадиях развития патологии, общая – при 2, 3 и 4 степени поражения суставной ткани.
- Лихорадка, сопровождающаяся трясущим ознобом. Наблюдается у 60-80% больных. При активном противовоспалительном лечении основного заболевания температура остается нормальной,особенно у людей пожилого возраста. Чем старше пациент – тем меньше вероятность гипертермии (температура может соответствовать норме или подниматься до уровня субфебрилитета). Явление не считается объективным и рассматривается в общем комплексе на этапе осмотра и опроса, когда врач выясняет все симптомы инфекционного артрита.
Дополнительно участок кожи над суставом, пораженным инфекцией, заметно отекает. Выпячивание на теле хорошо визуализируется, гиперемировано, что является признаком активного воспалительного процесса внутри тканей.
Симптоматика вирусного артрита
Вирусный артрит – один из видов воспаления суставов. Заболевание возникает чаще всего на фоне вирусного гепатита. При остром развитии инфекции прогрессирование истинного артрита происходит редко, обусловливает так называемые внепеченочные проявления. Среди них:
- болевой синдром. Болезненность отмечается в крупных суставах, костях, мышцах преимущественно ночью;
- кожные высыпания. Папулы, пальпируемые пурпуры также относятся к симптомам вирусного артрита;
- выраженное увеличение лимфатических узлов.
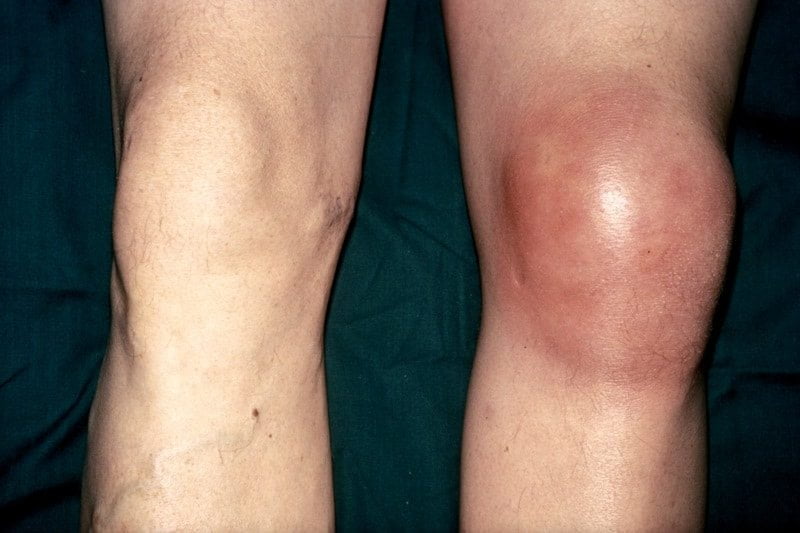
Внешние признаки инфекционного поражения коленного сустава.
Продолжительность артрита — от 3 до 6 недель. При своевременном выявлении патологии суставной синдром удается купировать быстро. Что характерно, на раннем этапе не всегда отображаются клинические проявления гепатита, не выявляются существенные изменения лабораторных показателей. Особенно это касается анализов, отражающих функциональную способность печени.
Основные диагностические мероприятия
Чтобы подтвердить наличие воспалительного процесса, пациенту нужно пройти несколько важных исследований. К ним относятся:
- лабораторная диагностика. Биохимическое и клиническое исследование крови позволяет выявить воспалительный процесс на начальной, латентной стадии его развития. Лабораторно определяется лейкоцитоз (характеризуется сдвигом лейкоцитарной формулы влево), одновременно с ним отмечается существенное повышение скорости оседания эритроцитов (СОЭ). Однако исследование образца крови, взятого из периферической вены пациента, в половине случаев отражает число лейкоцитов, соответствующее норме. Чаще это происходит тогда, когда больные системно получают лечение от основного заболевания;
- рентгенологическое исследование пораженного сустава относится к первостепенным диагностическим процедурам. Надежный и быстрый метод направлен на исключение сопутствующего развития остеомиелита. Исследование позволяет спланировать вид терапии и объем вмешательства. Рентгенологическая диагностика показывает, что инфекционный артрит вызвал развитие остеопороза, эрозии краевых поверхностей суставов. В 25% случаев дополнительно выявляется сужение суставной щели. Перечисленные патологические изменения удается визуализировать на снимке уже на 14-16 день прогрессирующего воспалительно-деструктивного процесса суставов;
- при необходимости диагностики патологии суставов, которые по анатомическим особенностям организма пролегают глубоко, применяют методы радиоизотопного сканирования. Для манипуляции используют вещества, относящиеся к группе легких металлов (технеций, галлий или индий). Чаще рассматриваемый метод реализуют в отношении исследования тазобедренного и крестцово-подвздошного сустава. Они труднодоступны для осуществления диагностического прощупывания и объективного осмотра;
- посев крови на гемокультуру обеспечивает положительный результат только в 40% клинических случаев;
- пункция и аспирация синовиальной жидкости с последующим проведением исследования в микробиологической лаборатории. Так называемый развернутый анализ синовии, предварительно взятой из воспаленного сустава непосредственно перед анализом, относится к базисной диагностике. Врачу важно дифференцировать инфекционный артрит с подагрическим воспалением, чтобы назначить лечение. Когда число лейкоцитов синовиальной жидкости составляет >25 • 109/л, >50 • 109/л и >100 • 109/л, вероятность наличия инфекционного артрита увеличивается в 2,9; 7,7 и 28 раз соответственно.
Посев синовиальной жидкости осуществляют тотчас после ее взятия (непосредственно в палате, около постели пациента).
Дополнительно окрашивают мазки по Граму. Метод позволяет определить патогенную флору артрита инфекционного происхождения – аэробную и анаэробную. С этой целью образец синовиальной жидкости сначала обрабатывают в центрифуге. Целесообразность методики с точки зрения её эффективности приравнивается к 75% при инфицировании грамположительными возбудителями и 50% — при заражении грамотрицательными.
Лечение инфекционного артрита
Учитывая бурное течение инфекционного воспаления суставов и высокий риск осложнений, подход к устранению патологии должен быть комплексным. Стандартная терапия рассматриваемой болезни включает антимикробное, симптоматическое воздействие, дренаж инфицированной синовии.
Видео клинического случая лечения инфекционного артрита, докладчик — доктор Глаз:
Консервативное
Медикаментозное лечение инфекционного артрита включает назначение нескольких групп эффективных препаратов. Проводится:
- Антибактериальная терапия. Антибиотиками выбора признаны представители группы цефалоспоринов III поколения. Их назначают минимальным курсом в 8-12 дней. Далее проводят пероральную терапию Ципрофлоксацином или Офлоксацином (600 мг в сутки). Широко применяемые антибиотики: Гентамицин 2,5 мг/кг 3 р. в сутки; Цефотаксим 50 мг/кг каждые 6 ч, Цефуроксим 150 мг/кг/сутки в 3 введения. Если спустя 2 суток нет положительной динамики, необходимо сменить антибиотик. В 97% случаев этого достаточно для улучшения самочувствия пациента и продолжения терапевтического процесса. Стабильно повышенный показатель СОЭ – основание для пролонгации срока лечения. Учитывая, что средняя длительность терапии инфекционного артрита составляет 3-4 недели (в 95%), ликвидация воспаления у больных с завышенной скоростью оседания эритроцитов превышает 6 недель (только спустя этот срок удается ликвидировать всю симптоматику артрита). Если подтверждено, что воспаление суставов обусловлено хламидийной инфекцией, рассматриваемую схему лечения дополняют назначением Азитромицина (1 г внутрь однократно) или Доксициклина (200 мг/сутки перорально, в 2 приема, курсом в 7 дней).
- Противовоспалительная терапия. Ею целесообразно дополнить назначение не только анальгетиков, но и антимикробных средств. К нестероидным противовоспалительным препаратам (НПВП) относится Диклофенак, Кетопрофен, Нимесулид, Мелоксикам.
- Витаминотерапия. Витамины необходимы для укрепления иммунных свойств организма.
- Малые дозы глюкокортикоидов также применяются в лечении больных инфекционным артритом.
- Жаропонижающая терапия. Из соображения сохранности печени назначают Парацетамол малыми дозами в сочетании с введением аскорбиновой кислоты и инфузионной терапией.
Использование классических противовоспалительных препаратов создает серьезные проблемы по причине потенциальной гепатотоксичности. У пациентов с вирусным артритом наблюдают благотворное влияние нестероидных противовоспалительных средств, гидроксихлорохина, сульфасалазина.
Хирургическое
Дренирование пораженного сустава осуществляют так называемой «закрытой» аспирацией, манипулируя иглой. В отягощенных клинических случаях требуется выполнение дренажа дважды в сутки. Оценить эффективность действия и терапии в целом позволит подсчет числа лейкоцитов, окрашивание по Граму, посев синовиальной жидкости. Дополнительная сложность манипуляции – проводить контроль перечисленными лабораторными методами приходится после каждого выполнения дренажа, даже если в течение дня их было более двух.
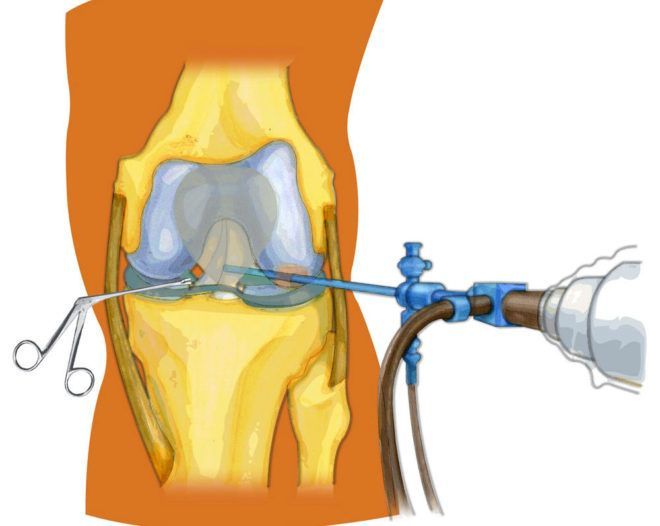
Техника дренирования.
Прогноз
При условии отсутствия у пациента серьезных сопутствующих патологий и осуществления грамотной антибактериальной терапии прогноз относительно выздоровления благоприятный. Наличие множественных нарушений состояния и функциональной способности органов в 25-50% клинических случаев приводит к необратимой потере двигательной активности сустава. Летальность при рассматриваемом заболевании зависит одновременно от нескольких факторов:
- возраста пациента;
- наличия у него сопутствующих патологий;
- степени выраженности иммуносупрессии;
- своевременности начатого лечения.
Согласно сведениям статистики, частота летальных исходов среди больных инфекционным артритом с 1990 по 2017 год существенно не изменилась. Показатель составляет 5-15% клинических случаев.
Похожие статьи
Как забыть о болях в суставах и артрите?
- Боли в суставах ограничивают Ваши движения и полноценную жизнь…
- Вас беспокоит дискомфорт, хруст и систематические боли…
- Возможно, Вы перепробовали кучу лекарств, кремов и мазей…
- Но судя по тому, что Вы читаете эти строки – не сильно они Вам помогли…
Но ортопед Валентин Дикуль утверждает, что действительно эффективное средство от АРТРИТА существует! Читать далее >>>
загрузка…
Источник
Для цитирования: Белов Б.С. Бактериальные (септические) артриты. РМЖ. 2004;20:1137.
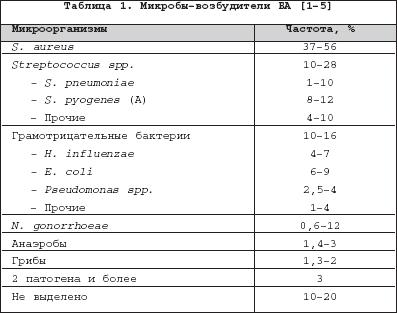
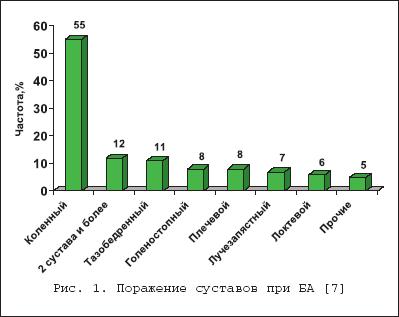
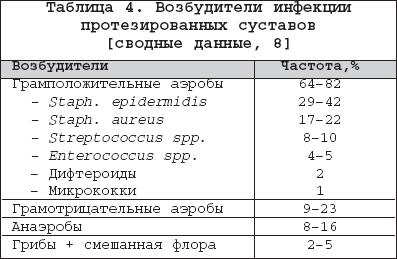
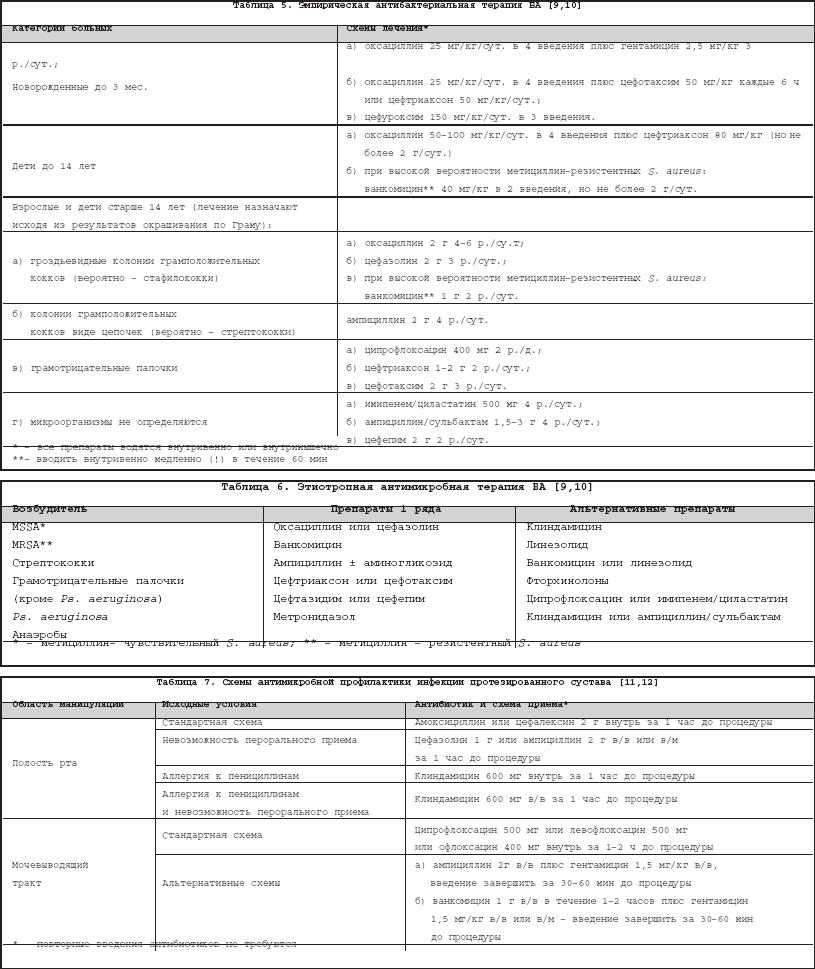
Бактериальный (септический) артрит (БА) представляет собой быстропрогрессирующую патологию, обусловленную непосредственной инвазией сустава гноеродными микроорганизмами 1 . Заболевание встречается повсеместно. Поражаются преимущественно дети и лица старше 60 лет. Ежегодная частота БА составляет 2–10 случаев на 100 000 населения , а среди больных ревматоидным артритом (РА) и реципиентов клапанных протезов эти значения достигают 30–70 на 100 000. Несмотря на обширный арсенал разработанных и внедренных в клиническую практику антимикробных средств и интенсивное развитие хирургической технологии, необратимая утрата функции сустава развивается у 25–50% больных. Частота летальных исходов при БА существенно не изменилась за последние 25 лет и составляет 5–15% [1]. Этиология Теоретически все известные бактерии могут вызвать БА (табл. 1). Самым распространенным этиологическим агентом БА является S. aureus , на долю которого приходится до 80% случаев инфекций суставов у больных РА и сахарным диабетом. Данный патоген также является основным при инфекционном коксите и полиартикулярных вариантах БА. На втором месте по частоте выделения у больных БА находятся стрептококки (в первую очередь, ? –гемолитический стрептококк группы А), которые, как правило, ассоциируются с фоновыми аутоиммунными заболеваниями, хронической инфекцией кожи и предшествующей травмой. Встречаемость S. pneumoniae в качестве возбудителя БА в последние годы существенно снизилась. Стрептококки других групп (B,G, C и F – в порядке убывания) выделяются при БА у больных с иммунной недостаточностью, злокачественными новообразованиями, а также инфекционной патологией пищеварительного и урогенитального тракта. Грамотрицательные палочки – причина БА у пожилых больных, наркоманов, вводящих наркотики внутривенно, а также у больных с иммунодефицитом. Анаэробы в качестве возбудителей БА чаще фигурируют у реципиентов суставных протезов, лиц с глубокими инфекциями мягких тканей и больных сахарным диабетом. Наиболее значимые этиологические агенты БА среди детей – S. aureus и Str . pyogenes . Роль H. influenzae , ранее встречавшейся достаточно часто при БА у детей, в последние годы значительноуменьшилась в связи с широким внедрением специфической вакцины. В то же время ряд исследователей отмечают рост встречаемости при БА грамотрицательной палочки K. kingae , являющейся нормальным обитателем ротовой полости у детей до 2 лет [6]. В таблице 2 суммированы данные о наиболее часто встречающихся возбудителях БА в зависимости от категорий больных. Патогенез В норме суставные ткани стерильны, что обеспечивается успешным функционированием фагоцитов синовиальной мембраны и синовиальной жидкости (СЖ). Для развития БА необходимо наличие ряда «факторов риска», зависящих как от состояния макроорганизма (в первую очередь – противоинфекционного иммунитета и суставного статуса), так и микроба–патогена (вирулентность, экспозиция, объем инокулята и т.д.). Основные факторы, предрасполагающие к развитию БА, представлены в таблице 3. Одним из наиболее значимых аспектов возникновения БА является ослабление естественных защитных сил макроорганизма, обусловленное сопутствующими заболеваниями, иммуносупрессией, возрастом пациентов. Немаловажное значение придается фоновой суставной патологии, проводимой терапии, а также возможным осложнениям последней. В частности, при РА вероятность возникновения БА нарастает в связи с назначением глюкокортикостероидов (в т.ч. внутрисуставно), цитотоксических иммунодепрессантов, а также моноклональных антител к фактору некроза опухоли– ? (инфликсимаб). Проникновение возбудителя в сустав может происходить несколькими путями. 1. Гематогенная диссеминация при транзиторной или стойкой бактериемии, как следствие отдаленных первичных очагов инфекции (пневмония, пиелонефрит, пиодермия и т.д.). 2. Лимфогенное распространение из близлежащих к суставу очагов инфекции. 3. Ятрогенный путь при проведении артроцентеза или артроскопии. 4. Проникающие травмы , вызванные шипами растений, иными загрязненными предметами. Инвазия бактерии в сустав сопровождается активным воспалительным клеточным ответом и выходом клеток, участвующих в воспалении, в полость сустава. В дальнейшем под влиянием продуктов жизнедеятельности бактерий происходит стимуляция иммунного ответа и высвобождение разнообразных медиаторов воспаления. Накопление провоспалительных цитокинов и продуктов аутолиза фагоцитов – протеаз влечет за собой торможение синтеза хряща и его деградацию с последующей деструкцией хрящевой и костной ткани и формированием костного анкилоза. Клиническая картина Как правило, БА характеризуется острым началом с интенсивной болью, припухлостью, гиперемией кожи и гипертермией пораженного сустава. В большинстве случаев (60–80%) имеет место лихорадка. Однако температура тела может быть субфебрильной и даже нормальной, что чаще встречается при поражении тазобедренных и крестцово–подвздошных суставов, на фоне активной противовоспалительной терапии по поводу основного заболевания, а также у больных пожилого возраста. В 80–90% случаев поражается единственный сустав (чаще – коленный или тазобедренный) (рис. 1). Развитие инфекционного процесса в суставах кистей в основном имеет травматический генез (проникающие колотые раны или укусы). Олиго– или полиартикулярный тип поражения чаще наблюдается при развитии БА у больных РА, системными поражениями соединительной ткани, а также у наркоманов, вводящих наркотики внутривенно. Помимо этого, у «внутривенных» наркоманов БА характеризуется более медленным началом, длительным течением и частым поражением синдесмозов туловища (крестцово–подвздошные и грудино–ключичные сочленения, лонное сращение). У маленьких детей единственным проявлением бактериального коксита может быть резкая боль при движении с фиксацией тазобедренного сустава в положении сгибания и наружной ротации. В отличие от гонококкового артрита для БА несвойственно поражение околосуставных мягких тканей. Диагностика При анализепериферической крови у больных БА выявляют лейкоцитоз со сдвигом лейкоцитарной формулы влево и значительное повышение СОЭ. Основу диагностики БА составляет развернутый анализ СЖ , полученной с помощью пункционной аспирации из пораженного сустава (при этом в максимально возможной степени необходимо удалить выпот). Для определенного диагноза БА требуется идентификация бактерий в СЖ. Посев ее производится на среды для аэробных и анаэробных микробов и должен быть выполнен сразу же после взятия (у постели больного). С целью получения предварительной информации о возбудителе и назначения эмпирической антибактериальной терапии необходимо окрашивание мазков по Граму, при этом эффективность исследования увеличивается посредством предварительного центрифугирования СЖ. Диагностическая эффективность данной методики составляет 75% и 50% при инфицировании грамположительными кокками и грамотрицательными палочками, соответственно. Визуально СЖ при БА имеет гнойный характер, серовато–желтого или кровянистого цвета, интенсивно мутная, густая, с большим аморфным осадком. При подсчете лейкоцитов уровень цитоза часто превышает таковой при других воспалительных заболеваниях (РА, подагрический артрит, реактивные артриты) и составляет >50 000/мм 3 , нередко более 100 000/мм 3 с преобладанием нейтрофилов (>85%). В СЖ также отмечается низкое содержание глюкозы, составляющее менее половины от ее сывороточной концентрации, и высокий уровень молочной кислоты. Посевы крови на гемокультуру дают положительные результаты в 50% случаев. Рентгенография сустава входит в число первоочередных диагностических мероприятий, поскольку она позволяет исключить сопутствующий остеомиелит и определиться с дальнейшей тактикой обследования и лечения больного. Однако следует отметить, что отчетливые изменения на рентгенограммах при БА (остеопороз, сужение суставной щели, краевые эрозии) появляются примерно на 2–й неделе от начала заболевания. Применение методик радиоизотопного сканирования с технецием, галлием или индием особенно важно в тех случаях, когда исследуемый сустав располагается глубоко в тканяхили труднодоступен для пальпации (тазобедренные, крестцово–подвздошные). Эти методы также помогают выявить изменения, присущие БА, на ранних стадиях процесса, т.е. в течение первых двух суток, когда рентгенологические изменения еще отсутствуют. На компьютерных томограммах деструктивные изменения костной ткани выявляются значительно раньше, чем на обзорных рентгенограммах. Данный метод наиболее информативен при поражении крестцово–подвздошных и грудино–ключичных сочленений. Магнитно–резонансное исследование позволяет выявить на ранних стадиях заболевания отек мягких тканей и выпот в полость сустава, а также остеомиелит. Дифференциальный диагноз Дифференциальную диагностику БА надо проводить со следующими заболеваниями, проявляющимися острым моноартритом: – острый подагрический артрит; – псевдоподагра; – ревматоидный артрит; – вирусные артриты; – серонегативные спондилоартриты; – лайм–боррелиоз. Необходимо отметить, что инфекция сустава является одной из немногих неотложных ситуаций в ревматологии, требующей быстрой диагностики и интенсивного лечения, что позволяет избежать необратимых структурных изменений. Поэтому существует правило – расценивать каждый острый моноартрит как инфекционный, пока не доказано обратное . Инфекции протезированного сустава Частота инфицирования суставных протезов составляет 0,5–2%. Среди возбудителей преобладают стафилококки (в первую очередь – коагулазонегативные), стрептококки, грамотрицательные аэробы и анаэробы (табл. 4). Ранние формы инфекций суставного протеза (до 3 мес. после имплантации) вызываются преимущественно эпидермальными стафилококками и развиваются по причине послеоперационной контаминации или вследствие контактного распространения из инфицированной кожи, подкожных тканей, мышц или послеоперационной гематомы. Поздние формы возникают при инфицировании другими микробами, представленными в таблице 4, и обусловлены гематогенным путем диссеминации. К основным факторам риска поражения протезированных суставов относят: иммунодефицитные состояния, РА, повторные операции на суставе, длительное по времени оперативное вмешательство, протезирование поверхностно расположенных суставов (локтевой, плечевой, голеностопный). Начало заболевания может быть острым или подострым в зависимости от вирулентности возбудителя. Появляется боль (95%), лихорадка (43%), припухлость сустава (38%), отток гнойного отделяемого по дренажу (32%). Данная симптоматика в сочетании с рентгенографическими признаками разрушения костной ткани вблизи протеза всегда свидетельствует об инфицировании. Разграничение хирургической инфекции кожи от гнойного поражения суставного протеза нередко вызывает большие трудности. Окончательный диагноз ставится по данным анализов крови, исследования аспирата из полости искусственого сустава и/или костного биоптата, взятого вблизи области соединения цемента с протезом. Лечение Лечение БА – комплексное, включающее антимикробную и симптоматическую терапию, дренаж инфицированной СЖ и лечебную физкультуру. Антимикробная терапия проводится в течение первых 1–2 суток эмпирически с учетом возраста больного, клинической картины заболевания и результатов исследования мазков СЖ по Граму, в дальнейшем – с учетом выделенного возбудителя и его чувствительности к антибиотикам (табл. 5, 6). Антибиотики следует вводить преимущественно парентерально, внутрисуставное их применение нецелесообразно. Отсутствие позитивной динамики через 2 суток диктует необходимость смены антибиотика. Сохраняющаяся ускоренная СОЭ служит показанием к продлению сроков лечения, которое в среднем составляет 3–4 нед. (иногда до 6 нед.), но не менее 2 нед. после ликвидации всех признаков заболевания. Дополнительно к антимикробной терапии назначают анальгетики и нестероидные противовоспалительные препараты (диклофенак, кетопрофен и др.). Дренаж инфицированного сустава производят (иногда по несколько раз в день) методом закрытой аспирации через иглу. С целью оценки эффективности лечения каждый раз выполняют подсчет лейкоцитов, окрашивание по Граму и посевы СЖ. Открытое хирургическое дренирование инфицированного сустава осуществляют при наличии следующих показаний [7]: – инфицирование тазобедренного и, возможно, плечевого сустава; – остеомиелит позвонков, сопровождающийся сдавлением спинного мозга; – анатомические особенности, затрудняющие дренирование сустава (например, грудино–ключичное сочленение); – невозможность удаления гноя при закрытом дренировании через иглу из–за повышенной вязкости содержимого или спаечного процесса в полости сустава; – неэффективность закрытой аспирации (персистенция возбудителя или отсутствие снижения лейкоцитоза в синовиальной жидкости); – протезированные суставы; – сопутствующий остеомиелит, требующий проведения хирургического дренирования; – артрит, развившийся вследствие попадания инородноготела в суставную полость; – позднее начало терапии (более 7 дней). В течение первых двух суток сустав иммобилизируют. Начиная с 3–го дня болезни, осуществляют пассивные движения в суставе. К нагрузкам и/или активным движениям в суставе переходят после исчезновения артралгии. Лечение инфицированного протезированного сустава осуществляют следующим образом: 1. Одномоментная артропластика с иссечением инфицированных тканей, установкой нового протеза и последующим 6–недельным курсом антибиотикотерапии (ванкомицин + амикацин; ванкомицин + цефепим/цефтазидим; оксациллин + рифампицин). 2. Иссечение протезных компонентов , загрязненных участков кожи и мягких тканей с последующей парентеральной антимикробной терапией в течение 6 нед. После этого осуществляется реимплантация сустава с продолжением антибиотикотерапии в течение 5 дней. Профилактика Вероятность инфицирования протезированного сустава значительно возрастает во время бактериемии, возникающей при стоматологических и урологических манипуляциях. В связи с этим экспертами Американской ортопедо–хирургической академии, Американской стоматологической ассоциации и Американской урологической ассоциации разработаны схемы антибиотикопрофилактики для лиц с высоким риском развития инфекции суставного протеза [11,12]. Профилактике подлежат все реципиенты суставных протезов в течение первых двух лет после операции, больные с иммуносупрессией, обусловленной фоновым заболеванием (РА, системная красная волчанка) или лекарственной/лучевой терапией, а также пациенты с отягощающей сопутствующей патологией (перенесенная инфекция суставного протеза, гемофилия, ВИЧ–инфекция, инсулин–зависимый диабет I типа, злокачественные новообразования) при выполнении у них ряда стоматологических вмешательств, включающих экстракцию зуба, манипуляции на периодонте, установку имплантантов и т.д. Вышеуказанные категории больных также должны получать профилактику при разнообразных манипуляциях, связанных с возможным нарушением целостности слизистой мочевыводящего тракта (литотрипсия, эндоскопия, трансректальная биопсия простаты и т.д.) Схемы антимикробной профилактики представлены в таблице 7.
Литература
1. Goldenberg DL. Septic arthritis. Lancet. 1998;351(9097):197–202.
2. Weston VC, Jones AC, Bradbury N, Fawthrop F, Doherty M. Clinical
features and outcome of septic arthritis in a single UK Health
District 1982–1991. Ann Rheum Dis. 1999; 58(4):214–219.
3. Dubost JJ, Soubrier M, De Champs C, Ristori JM, Bussiere JL,Sauvezie B. No changes in the distribution of organisms responsible
for septic arthritis over a 20 year period. Ann Rheum Dis. 2002;
61(3):267–269.
4. Kaandorp CJ, Dinant HJ, van de Laar MA, Moens HJ, Prins AP,
Dijkmans BA. Incidence and sources of native and prosthetic joint
infection: a community based prospective survey. Ann Rheum Dis. 1997;
56(8): 470–475.
5. Shirtliff ME, Mader JT. Acute septic arthritis. Clin Microbiol
Rev. 2002; 15(4): 527–544.
6. Lahmann J.D., Lahmann S.J. Etiology of septic arthritis in children:
an update for the 1990s. Pediatr. Emerg. Care. 1999; 15: 40–42.
7. Gilliard W.R. Бактериальные (септические) артриты. В кн. Вест С.Д.
Секреты ревматологии. /Пер. с англ. М., СПб.– «Издательство Би-
ном»–»Невский диалект», 1999. 331–341.
8. Urban J.A., Garvin K.L. Prosthetic joint infections. Curr. Treat.
Opt. Infect. Dis. 2003; 5: 309–321.
9. Rao N. Septic arthritis. Curr. Treat. Opt. Infect. Dis. 2002; 4:
279–287.
10. Trampuz A., Steckelberg J.M. Septic arthritis. Curr. Treat. Opt.
Infect. Dis. 2003; 5: 337–344.
11. Antibiotic prophylaxis for dental patients with total joint
replacements. JADA. 2003; 134:895–898.
12. Antibiotic prophylaxis for urological patients with total joint
replacements. J. Urology 2003; 169 (5): 1796–1797.
Контент доступен под лицензией Creative Commons «Attribution» («Атрибуция») 4.0 Всемирная.
Поделитесь статьей в социальных сетях
Источник