Действие анестезии при воспалении
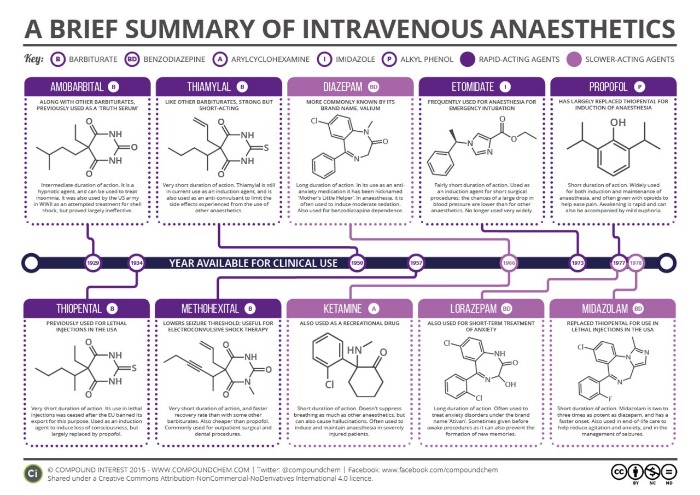

Анестетики разделяют на:
- Местные
- Общие:
а) ингаляционные – летучие жидкости и газы
б) неингаляционные (внутривенные)
Таблица 1
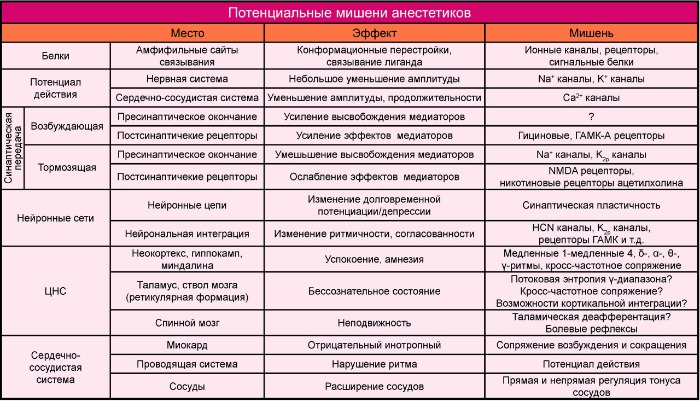
1. Местные анестетики
Местные анестетики обратимо снижают возбудимость чувствительных нервных окончаний и блокируют проведение афферентных импульсов в нервных стволах в зоне непосредственного применения, используются для устранения боли.
Первый препарат этой группы – кокаин, был выделен в 1860 г. Альбертом Ньюманом из листьев южноамериканского кустарника Erythroxylon coca. Ньюман, как многие химики прошлого, попробовал новое вещество на вкус и отметил онемение языка. Профессор Военно-медицинской академии Санкт-Петербурга Василий Константинович Анреп в 1879г. подтвердил способность кокаина вызывать анестезию. В экспериментах на лягушках он обнаружил, что кокаин влияет «парализующим образом» на окончания чувствительных нервов. В. К. Анреп исследовал действие кокаина на себе: инъекция кокаина в дозе 1 – 5 мг под кожу сопровождалась полной анестезией – укол булавкой, прижигание тлеющей спичкой не вызывали боли. Аналогичный эффект наблюдался при закапывании раствора кокаина в глаз и нанесении его на слизистую оболочку языка.
Местные анестетики классифицируют на сложные эфиры (анестезин, дикаин, новокаин) и замещенные амиды (лидокаин, тримекаин, бупивакаин). Местные анестетики – сложные эфиры подвергаются гидролизу псевдохолинэстеразой крови и действуют в течение 30 – 60 мин. Их эффект пролонгируют антихолинэстеразные средства (прозерин). Продукт гидролиза – n-амино-бензойная кислота ослабляет бактериостатическое влияние сульфаниламидов. Замещенные амиды кислот инактивируются монооксигеназной системой печени в течение 2 – 3 ч. Бупивакин вызывает местную анестезию продолжительностью 3 – 6 ч, после ее прекращения длительно сохраняется анальгетический эффект.
С точки зрения практического применения анестетики подразделяют на следующие группы:
- Средства, применяемые для поверхностной (терминальной) анестезии: Кокаин, Дикаин, Анестезин, Пиромекаин
- Средства, применяемые преимущественно для инфильтрационной и проводниковой анестезии: Новокаин, Бупивакаин
- Средства, применяемые для всех видов анестезии: Лидокаин, Тримекаин
Механизм действия
Местные анестетики представляют собой третичные азотистые основания. Они состоят из гидрофильной и липофильной частей, соединенных эфирной или амидной связями. Механизм действия определяет липофильная часть, имеющая ароматическую структуру. Для нанесения на слизистые оболочки и кожу и парентерального введения применяют водные растворы хлористоводородных солей местных анестетиков. В слабощелочной среде тканей (рН=7,4) соли гидролизуются с освобождением оснований. Основания местных анестетиков растворяются в липидах мембран нервных окончаний и стволов, проникают к внутренней поверхности мембраны, где превращаются в ионизированную катионную форму.
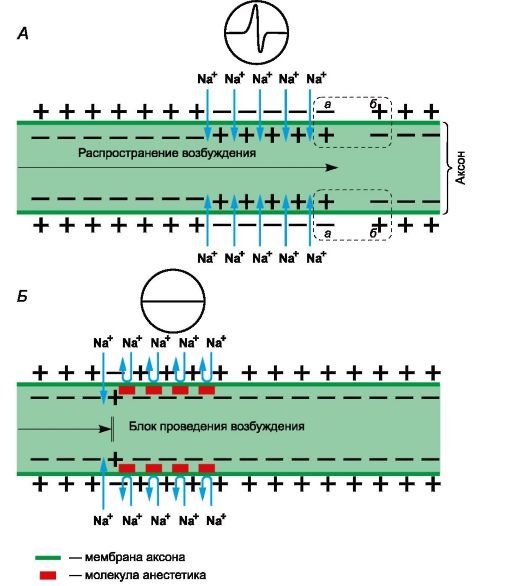 Рисунок 1 | Механизм действия местных анестетиков
Рисунок 1 | Механизм действия местных анестетиков
Рецепторы для местных анестетиков локализованы в S6-сегменте IV домена внутриклеточной части натриевых каналов. Связываясь с рецепторами, катионы местных анестетиков пролонгируют инактивированное состояние натриевых каналов, что задерживает развитие следующего потенциала действия. Местные анестетики не взаимодействуют с закрытыми каналами в период потенциала покоя. Таким образом, в зоне нанесения местных анестетиков не развиваются потенциалы действия, что сопровождается блоком проведения нервных импульсов. Избирательное влияние местных анестетиков на чувствительные афферентные нервы обусловлено генерацией в них длительных (более 5 мс) потенциалов действия с высокой частотой.
В первую очередь местные анестетики блокируют безмиелиновые С и миелиновые Аδ и Аβ волокна (афферентные пути, проводящие болевые и температурные раздражения; вегетативные нервы). На волокна, окруженные миелиновой оболочкой, местные анестетики действуют в области перехватов Ранвье. Толстые миелиновые волокна (афферентные пути, проводящие тактильные раздражения; двигательные нервы) слабее реагируют на местные анестетики. Кроме того, устойчивость двигательных нервов к анестезии обусловлена низкочастотными короткими (менее 5 мс) потенциалами действия. В очаге воспаления в условиях ацидоза нарушаются диссоциация хлористоводородных солей местных анестетиков и образование их свободных липидорастворимых оснований, поэтому обезболивающее влияние утрачивается. Например, местная анестезия может оказаться неэффективной при удалении зуба в случае тяжелого периодонтита.
2. Общие анестетики
2.1. Ингаляционные анестетики
2.1.1 Летучие жидкости
Теории механизма действия общих анестетиков
Эффекты ингаляционных анестетиков не могут быть объяснены одним молекулярным механизмом. Скорее всего многокомпонентное действие каждого анестетика реализуется через множество мишеней. Тем не менее, эти эффекты сходятся на ограниченном числе изменений, лежащих в основе физиологических эффектов. На данный момент существуют липидная и белковая теории анестезии, но ни одна из них пока не описывает последовательность событий, происходящих от взаимодействия молекулы анестетика и ее мишеней до физиологических эффектов.
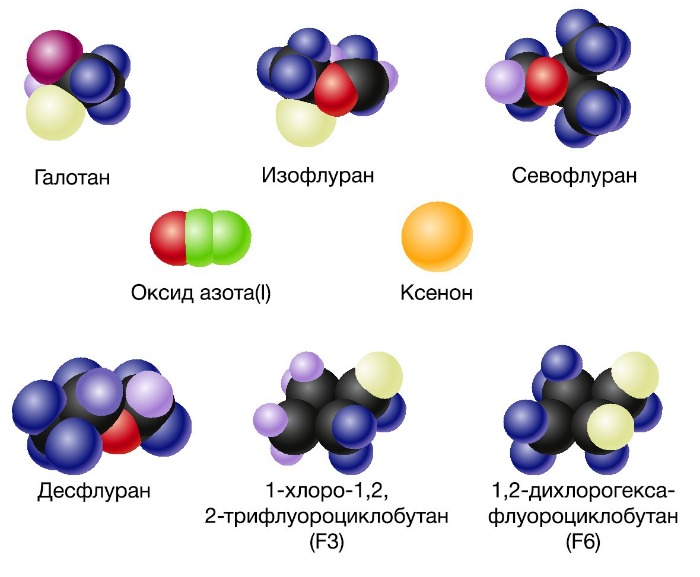 Рисунок 2 | Ингаляционные анестетики
Рисунок 2 | Ингаляционные анестетики
Активность ингаляционных анестетиков оценивают по минимальной альвеолярной концентрации (МАК). Доза, создающая 1 МАК, предотвращает у половины пациентов движения в ответ на хирургическое вмешательство. Сила общих анестетиков коррелирует с их растворимостью в жирах, что говорит о важности взаимодействия с гидрофильными мишенями. В частности, обнаружение связи между силой анестетика и его липофильностью (правило Мейер-Овертона) дало начало липидной теории механизма действия анестетиков. Липидная теория анестезии утверждает, что анестетики растворяются в двойном липидном слое биологических мембран и вызывают анестезию, достигая критической концентрации в мембране. Наиболее усложненные версии липидной теории требуют, чтобы молекулы анестетиков вызывали пертурбацию (изменение свойств) мембраны.
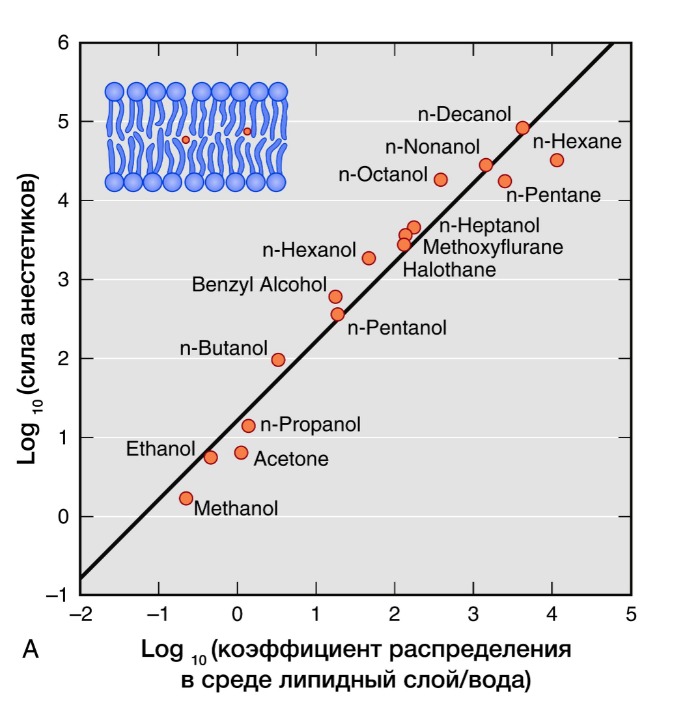 Рисунок 3 | Правило Мейер-Овертона
Рисунок 3 | Правило Мейер-Овертона
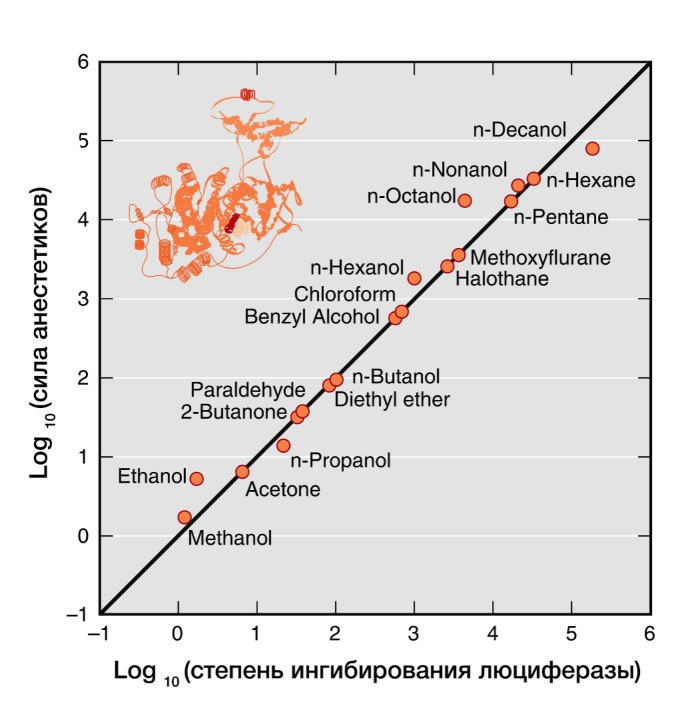 Рисунок 4 | В 20 веке было показано, что сила общих анестетиков коррелируют с их способностью ингибировать активность растворимого фермента люциферазы, который физиологически не является мишенью анестетиков, но служит в качестве безлипидной модели белковой молекулы для связывания анестетика.
Рисунок 4 | В 20 веке было показано, что сила общих анестетиков коррелируют с их способностью ингибировать активность растворимого фермента люциферазы, который физиологически не является мишенью анестетиков, но служит в качестве безлипидной модели белковой молекулы для связывания анестетика.
Современные факты позволяют утверждать, что белки в большей степени, чем липиды, являются молекулярными мишенями для действия анестетиков. Взаимодействие анестетиков с гидрофобными участками белков также объясняет правило Мейер-Овертона. Прямое взаимодействие молекул анестетиков с белками позволяет объяснить исключения из этого правила, так как любые участки связи с белком определяются как размером и формой молекулы, так и растворимостью. Многочисленные физические методы (рентгенодифракция, ЯМР-спектроскопия) подтверждают, что общие анестетики действуют путем непосредственного связывания с амфифильными полостями белковых молекул, а размер связанного участка объясняет эффект «обрубания» свойства (более длинные спирты теряют свойства анестетика).
Механизм действия
Таким образом, общие анестетики изменяют физико-химические свойства липидов мембран нейронов и нарушают взаимодействие липидов с белками ионных каналов. При этом уменьшается транспорт в нейроны ионов натрия, сохраняется выход менее гидратированных ионов калия, в 1,5 раза возрастает проницаемость хлорных каналов, управляемых ГАМК-А рецепторами. Итогом этих эффектов становится гиперполяризация с усилением процессов торможения. Общие анестетики подавляют вход в нейроны ионов кальция, блокируя Н-холинорецепторы и NMDA-рецепторы глутаминовой кислоты; снижают подвижность Са2+ в мембране, поэтому препятствуют кальций-зависимому выделению возбуждающих нейромедиаторов. Наиболее чувствительны к действию общих анестетиков полисинаптические системы ЦНС – кора больших полушарий (1013 – 1014 синапсов), таламус, ретикулярная формация, спинной мозг. К наркозу устойчивы дыхательный и сосудодвигательный центры продолговатого мозга.
Летучие ингаляционные анестетики:
- постсинаптически усиливают тормозящую передачу путем потенциирования лиганд-управляемых ионных каналов, активируемых ГАМК и глицином;
- экстрасинаптиески путем усиления ГАМК-рецепторов и ионных токов утечки;
- пресинаптически за счет повышения базального высвобождения ГАМК.
Ингаляционные анестетики подавляют возбуждающую синаптическую передачу путем снижения высвобождения глутамата и постсинаптически путем ингибирования ионотропных глутаматных рецепторов. Парализующий эффект местных анестетиков включает действие на спинной мозг, в то время как седация/наркоз и амнезия включают супраспинальные механизмы памяти, сна и сознания.
2.1.2. Газовый наркоз
В анестезиологии широко применяют ингаляционный газовый анестетик азота закись (N2O). В конце 1980-х гг. в зарубежную анестезиологическую практику вошел инертный газ ксенон.
Азота закись представляет собой бесцветный газ характерного запаха, хранится в металлических баллонах под давлением 50 атм в жидком состоянии, не горит, но поддерживает горение. Ее смеси с анестетиками группы летучих жидкостей в определенных концентрациях взрывоопасны. В субнаркотических концентрациях (20 – 30 %) азота закись вызывает эйфорию (веселящий газ) и сильную анальгезию. В концентрации 20 % обеспечивает обезболивание в такой же степени, как 15 мг морфина. Закись азота на ГАМК-А рецепторы не влияет. Используется только в комбинациях, так как МАК составляет 104 %.
Инертный газ ксенон считают лучшей альтернативой азота закиси, так как он обладает более выраженным наркозным действием, индифферентностью и экологической безопасностью. Способность ксенона вызвать наркоз была открыта в связи с практикой глубоководных погружений и развитием гипербарической физиологии. Ксенон бесцветен, не горит и не обладает запахом, при соприкосновении со слизистой оболочкой рта создает на языке ощущение горьковатого металлического вкуса. Отличается низкой вязкостью и высокой растворимостью в липидах, выводится легкими в неизмененном виде. Разработана технология ксенонсберегающей анестезии с включением минимального потока и системы рециклинга для повторного многократного использования газа. Такая технология успешно решает важную в практическом отношении проблему дефицита и дороговизны ксенона. В механизме наркозного эффекта ксенона имеют значение блокада циторецепторов возбуждающих нейромедиаторов – Н-холинорецепторов, NMDA-рецепторов глутаминовой кислоты, а также активация рецепторов тормозящего нейромедиатора глицина. При взаимодействии с циторецепторами ксенон выступает как протонсвязывающий кластер и образует комплексы с катионами НСО+, NH2+, HNCH+. Ксенон проявляет свойства антиоксиданта и иммуностимулятора, снижает выделение гидрокортизона и адреналина из надпочечников.
2.2. Неингаляционные (внутривенные) наркозные средства подразделяют на три группы:
Препараты короткого действия (3 – 5 мин)
- пропанидин (эпонтол, сомбревин)
- пропофол (диприван, рекофол)
Препараты средней продолжительности действия (20 – 30 мин)
- кетамин (калипсол, кеталар, кетанест)
- мидазолам (дормикум, флормидал)
- гексенал (гексобарбитал-натрий)
- тиопентал-натрий (пентотал)
Препараты длительного действия (0,5 – 2 ч)
- натрия оксибутират
 Рисунок 5 | Общие анестетики для внутривенного введения
Рисунок 5 | Общие анестетики для внутривенного введения
Механизм действия
Наиболее широко используемым внутривенный анестетиком является пропофол. Его механизм действия связан с увеличение хлорной проводимости ГАМК рецепторов.
Метогекситал по скорости наступления и выхода из наркоза близок к пропофолу.
Барбитураты использовались для анестезии до введения в практику пропофола. Тиопентал вызывает быстрое наступление и быстрый выход из наркоза при разовом введении, но он быстро накапливается при повторном или пролонгированном введении и таким образом замедляет выход из анестезии. Барбитураты являются лигандами барбитуратных рецепторов. В малых дозах они аллостерически усиливают действие ГАМК на ГАМК А-рецепторы . При этом удлиняется открытое состояние хлорных каналов, возрастает вход в нейроны анионов хлора, развиваются гиперполяризация и торможение. В больших дозах барбитураты прямо повышают хлорную проницаемость мембран нейронов. Кроме того, они тормозят высвобождение возбуждающих медиаторов ЦНС – ацетилхолина и глутаминовой кислоты, блокируют АМРА-рецепторы (квисквалатные рецепторы ) глутаминовой кислоты. Барбитураты обладают церебропротективными свойствами и могут быть использованы с такой целью.
Бензодиазепины используются в основном как анксиолитики и для седации с сохранением сознания.Все бензодиазепиновые рецепторы аллостерически усиливают кооперацию ГАМК с ГАМК А-рецепторами, что сопровождается повышением хлорной проводимости нейронов, развитием гиперполяризации и торможения. Реакция с бензодиазепиновыми рецепторами происходит только в присутствии ГАМК. Ремимазолам – самый молодой бензодиазепин, имеет очень короткое время действия из-за быстрой нейтрализации эстеразами плазмы.
Кетамин химически является производным фенциклидина. Синаптические механизмы действия кетамина многообразны. Он является неконкурентным антагонистом возбуждающих медиаторов головного мозга глутаминовой и аспарагиновой кислот в отношении NMDA-рецепторов. Эти рецепторы активируют натриевые, калиевые и кальциевые каналы мембран нейронов. При блокаде рецепторов нарушается деполяризация. Кроме того, кетамин стимулирует освобождение энкефалинов и β-эндорфина; тормозит нейрональный захват серотонина и норадреналина. Последний эффект проявляется тахикардией, ростом АД и внутричерепного давления. Кетамин расширяет бронхи. При выходе из кетаминового наркоза возможны бред, галлюцинации, двигательное возбуждение (эти нежелательные явления предупреждают введением дроперидола или транквилизаторов).Важным терапевтическим эффектом кетамина является нейропротективный. Как известно, в первые минуты гипоксии мозга происходит выброс возбуждающих медиаторов – глутаминовой и аспарагиновой кислот. Последующая активация NMDA-рецепторов, увеличивая во внутриклеточной среде концентрацию ионов натрия и кальция и осмотическое давление, вызывает набухание и гибель нейронов. Кетамин как антагонист NMDA-рецепторов устраняет перегрузку нейронов ионами и связанный с этим неврологический дефицит.
Самым новым внутривенным анестетиком является дексмедетомидин. Это высокоселективный агонист а2-адренорецепторов с седативными, симпатолитическими, снотворными и анальгетическими эффектами. Его основное действие – в качестве агониста на а2 рецепторы в голубом пятне.
Источники:
- Теории механизма действия – https://en.wikipedia.org/wiki/Theories_of_general_anaesthetic_action и https://www.esus.ru/php/content.php?id=744
- Венгеровский А.И., Лекции по фармакологии для врачей и провизоров 2007
- Харкевич, Фармакология изд. 10
- Miller’s anesthesia / [edited by] Ronald D. Miller ; associate editors, Neal H. Cohen, Lars I. Eriksson, Lee A. Fleisher, Jeanine P. Wiener-Kronish, William L. Young. – Eighth edition. 2015
Нашли опечатку? Выделите фрагмент и нажмите Ctrl+Enter.
Источник
Осложнения местной анестезии – это ежелательные реакции, возникающие в результате введения местных анестезирующих препаратов. В зависимости от вида осложнения у пациента могут отмечаться такие симптомы, как удушье, нарушение гемодинамики и внутрисердечной проводимости, изменения со стороны ЦНС, кожная сыпь. Диагноз устанавливается на основании анамнеза и клинических проявлений, в отдельных случаях назначается ЭКГ, КТ, рентгенография, УЗИ. Специфическое лечение включает введение антигистаминных средств и кортикостероидных гормонов, инфузионную терапию, прекращение использования анестетика. В тяжелых случаях требуется реанимационное пособие.
Общие сведения
Опасные реакции на введение местноанестезирующих средств достаточно распространены. Частота их встречаемости составляет 1 случай на 150-200 использований препаратов этой группы. У 90% больных определяются признаки кожной аллергии (крапивница). Около 6% пациентов отвечают на инъекцию медикамента отеком лица, шеи, дыхательных путей. Анафилактический шок выявляется в 3% случаев. На долю общетоксических реакций, сопровождающихся поражением центральной нервной системы и проводящего аппарата сердца, приходится не более 1%. Зависимость от пола и возраста отсутствует, осложнения одинаково часто обнаруживаются у всех категорий населения. До 70% нежелательных реакций возникает у жителей развитых стран, в странах «третьего мира» аллергия диагностируется значительно реже.

Осложнения местной анестезии
Причины
Основной причиной аллергических реакций является гиперчувствительность к компонентам раствора. Препарат, попавший в организм, трансформируется в неполноценный антиген – гаптен. Далее гаптен образует комплекс с белком и воспринимается организмом как чужеродный агент. Провоцирующим фактором становятся особенности обмена веществ конкретного больного. Биотрансформация препарата может несколько отличаться от нормальной, что приводит к образованию комплексов, вызывающих аллергию. Интенсивность симптоматики зависит от степени сенсибилизации организма. Помимо реакций гиперчувствительности осложнения при введении местных анестетиков возникают по следующим причинам:
- Врачебная ошибка. Включает неправильный выбор обезболивающего или его дозировки, отказ от использования сосудосуживающих веществ в составе лекарственного раствора, нарушение техники манипуляции. Все это преимущественно приводит к токсическому воздействию препаратов на сердце и головной мозг, инфекционным процессам. При неправильном проведении процедуры могут иметь место повреждения нервных стволов, сосудов, других структур.
- Неадекватная реакция. Чрезмерная двигательная активность пациента в ответ на действия специалиста порой становится причиной отлома инъекционной иглы. Подобное чаще происходит с тонкими иглами диаметром 0,6 мм (23G). Кроме того, при резких движениях больного возможна излишняя травматизация мягких тканей, поражение сосудов и нервов (если инфильтрация производится вблизи сосудисто-нервных пучков).
- Длительная анестезия. При необходимости обеспечения продолжительной спинальной анестезии раствор подают в эпидуральное пространство через тонкий катетер. Анестетик депонируется вокруг нервов, его концентрация становится токсической. Развивается стойкий неврологический дефицит – синдром конского хвоста. Одномоментное введение большой дозы препарата провоцирует тотальную спинальную анестезию с двигательной блокадой и угнетением продолговатого мозга.
Патогенез
Патогенез негативных последствий местной анестезии различается по типам нежелательных явлений. При аллергиях отмечается чрезмерная активизация иммунных механизмов, которая приводит к развитию неадекватных по силе защитных процессов. Эти процессы провоцируют региональную пролиферацию жидкости из сосудистого русла, расстройства гемодинамики (анафилактический шок), гиперемию кожи на отдельных участках. Токсические реакции характеризуются нарушением поляризации и деполяризации клеток, изменением работы клеточных натриевых каналов. Токсическое действие на ЦНС заключается в нарушении проводимости нервных импульсов за счет прекращения их передачи в ганглиях нервной системы. Инфекционные осложнения возникают как результат попадания в рану и размножения патогенной флоры, с которой организм не может справиться самостоятельно.
Классификация
Осложнения местной анестезии могут систематизироваться по причинам, однако такой способ деления более важен при профилактике патологических состояний, а не в случаях, когда необходимо купировать уже развившуюся реакцию. Для устранения последствий манипуляции необходимо четкое понимание процессов, происходящих в организме больного, поэтому наиболее используемой является классификация по типу нежелательных явлений и их распространенности:
- Поражение ЦНС. Диагностируется как при всасывании большого количества анестетика из места его введения, так и при ошибочном внутрисосудистом вливании. Характеризуется тяжелыми нейротоксическими явлениями, может быть спинальным и церебральным. При спинальной разновидности патологии отмечается тотальное угнетение рефлекторных дуг, работы продолговатого мозга. Церебральная интоксикация приводит к нарушению сознания, коммуникативных функций, координации.
- Поражение проводящей системы. Особенно часто наблюдается при использовании высоких доз мекаина, лидокаина. Эти препараты подавляют электрическую активность сердца, в токсических дозах замедляют AV-проводимость, усугубляют атриовентрикулярную блокаду при ее наличии. Все перечисленное может стать причиной брадикардии и нарушений сердечного ритма вплоть до остановки сердца.
- Аллергии. Протекают в виде крапивницы, ангионевротического отека, анафилактического шока. Последний считается наиболее тяжелой формой гиперчувствительности к препарату. Иногда аллергия на м/а развивается в виде неспецифических явлений: головокружения, общего ухудшения самочувствия, незначительного угнетения дыхания, вариативной кожной сыпи.
- Травматизация. Возникает при нарушении техники процедуры или резких движениях пациента. При повреждении нервного ствола определяется выраженный болевой синдром, нарушение функции конечности. При попадании в кровеносный сосуд формируется гематома. Возможно появление контрактур, участков ишемии кожи, явлений парестезии.
- Инфекционные осложнения. Могут протекать в виде регионального воспаления, абсцесса, флегмоны мягких тканей. Наиболее тяжелой разновидностью является систематизированный септический процесс (сепсис), относящийся к жизнеугрожающим состояниям и требующий экстренной госпитализации. При остальных бактериальных процессах обычно показано амбулаторное лечение, которое может быть консервативным или оперативным.
Симптомы
Аллергическая реакция в форме крапивницы сопровождается образованием множества красных пятен, несколько возвышающихся над неизмененными участками кожи. Отмечается выраженный зуд. При ангионевротическом отеке наблюдается одностороннее или двухстороннее увеличение размера ушей, губ, мягких тканей лица. Наиболее опасен АНО дыхательных путей, который проявляется в форме удушья, инспираторной одышки, свистящего дыхания, лающего кашля, акроцианоза губ, мочек ушей, ногтей. При отсутствии своевременной помощи развивается выраженная системная гипоксия, больной погибает от недостатка кислорода. К числу симптомов анафилактического шока относят бледность или мраморность кожи, резкое снижение АД, тахикардию, расширение зрачков, нарушение сознания, чувство удушья.
При поражении ЦНС наблюдаются головокружения, судороги, звон в ушах, металлический привкус во рту. Может выявляться нистагм, нарушения речи, головокружения, тремор, онемение полости рта, языка. Реакция со стороны ССС включает брадикардию, аритмию, расширение периферических сосудов, снижение АД, коллапс. Возможна фибрилляция и асистолия. Типичным симптомом травматизации сосудов является быстрое увеличение гематомы в пораженной области. При пальпации обнаруживается умеренная болезненность, отек. Попадание иглы в нервный ствол провоцирует резкий приступ боли, иррадиирующей по ходу поврежденной структуры. Впоследствии у некоторых больных отмечается тугоподвижность конечности, боли в спине, локальное нарушение чувствительности.
Для инфекционных процессов характерна местная и общая симптоматика. Местными симптомами являются отек тканей, локальная гиперемия, повышение температуры тела в области воспаления. При накоплении гноя определяется флюктуация, визуально в очаге может просматриваться беловатая зона (скопление гнойных масс). К системным проявлениям относят общую гипертермию, ухудшение самочувствия, боли в мышцах и костях, изменение психоэмоционального фона. При тяжелых процессах наблюдается угнетение сознания, бред, судороги. Развивается инфекционно-токсический шок, приводящий к централизации кровообращения, нарушению гемодинамики, гибели пациента.
Диагностика
Обычно осложнения развиваются вскоре после введения препарата, поэтому их диагностику осуществляет лечащий врач, чаще всего хирург или анестезиолог-реаниматолог. Отсроченные последствия (инфекция) могут быть выявлены поликлиническим хирургом или врачом общей практики при обращении пациента в поликлинику. В большинстве случаев тип и характер патологии определяется с учетом анамнеза и внешних признаков. Иногда для подтверждения диагноза требуется проведение лабораторных и инструментальных исследований. К числу диагностических методик относятся:
- Сбор анамнеза, осмотр. Врач выясняет, какие вмешательства выполнялись в недавнем прошлом, какой анестетик использовался. Если постановкой диагноза занимается специалист, проводивший манипуляцию, этот пункт исключают. При осмотре выявляют характерные клинические признаки того или иного патологического состояния.
- Лабораторные анализы. При инфекционных процессах в крови больного обнаруживают лейкоцитоз, увеличение СОЭ. При токсическом влиянии анестетика может отмечаться сдвиг pH в кислую сторону, поскольку водородный показатель анестетиков колеблется от 3,5 до 6 единиц. Тяжелые нарушения работы сердца приводят к росту активности КФК, КФК МВ, появлению специфических маркеров. При аллергии в крови увеличивается содержание иммуноглобулинов.
- Инструментальное обследование. При аллергии не назначается. Признаки поражения ЦНС требуют исключения органических заболеваний путем проведения компьютерной томографии. На ЭКГ определяют AV-блокаду, брадикардию. При гнойных процессах может потребоваться сонография, рентгенография, КТ для уточнения границ воспалительного очага.
Лечение осложнений местной анестезии
При крапивнице пациенту назначают системные антигистаминные препараты. Как правило, этого оказывается достаточно для устранения проявлений болезни. Отек дыхательных путей требует внутривенного вливания кортикостероидов, оксигенотерапии. В тяжелых ситуациях прибегают к экстренной коникотомии или трахеостомии для обеспечения проходимости дыхательных путей. При анафилактическом шоке показана инфузионная терапия с использованием коллоидных растворов, введением кардиотоников для поддержания работы сердца и артериального давления. Применяются гормональные, антигистаминные средства, адреналин.
При нарушениях деятельности ЦНС рекомендуются противосудорожные препараты. При необходимости больного вводят в наркоз с использованием инъекционных средств. Осуществляют дыхательную поддержку вплоть до ИВЛ. Для ускорения экскреции анестетика производят объемные инфузии солевых растворов с последующим введением петлевых диуретиков. Реакции со стороны сердца купируют с помощью атропина, прессорных аминов. При фибрилляции проводят химическую или электрическую дефибрилляцию. При остановке сердца показана сердечно-легочная реанимация.
При инфекционных осложнениях назначают антибактериальные средства. Выполняют санацию патологического очага с его вскрытием, удалением гнойных масс, установкой дренажей. Для устранения болевого синдрома применяют ненаркотические анальгетики. Под окклюзионную повязку накладывают противомикробные и ранозаживляющие мази. Гематомы, образующиеся при повреждении сосуда, обычно не требуют вмешательства, при сдавлении соседних анатомических структур осуществляют удаление скопившейся крови. При травмах нервных стволов используют препараты для улучшения нервно-мышечной проводимости, физиотерапию.
Прогноз и профилактика
Прогноз при большинстве реакций благоприятный, при своевременно оказанной помощи негативные явления удается полностью устранить. Гибель или инвалидизация возможна при развитии анафилактического шока, отека Квинке, брадиаритмии вне стен лечебного учреждения. Тяжелые осложнения инфекционных процессов наблюдаются крайне редко. Профилактика заключается в правильном подборе вида и дозы анестетика, владении техникой манипуляции, информировании пациента о целях и ходе процедуры. Необходимо строго соблюдать правила асептики и антисептики. Больному следует заранее сообщить врачу о наличии аллергии на лекарственные препараты, максимально сдержанно вести себя во время вмешательства, избегать резких движений.
Источник
