Гель нимесулид или дифеклонад при воспалении суставов

Retrograde.pro – Ортодоксальный форум о бодибилдинге
Группа Вконтакте
Главное отличие в том, что Диклофенак неселективный ингибитор, а Нимесулид является селективным конкурентным ингибитором циклооксигеназы-2 (ЦОГ-2) — фермента, участвующего в синтезе простагландинов, медиаторов отёка, воспаления и боли.
Что же такое циклооксигеназа, сколько у неё видов и чем они отличаются?
немножко петерпите – будет немного умных терминов. дальше – проще
Циклооксигеназы, ЦОГ (англ. Cyclooxygenase, COX) — группа ферментов, участвующие в синтезе простаноидов, таких как простагландины, простациклины и тромбоксаны. Фармакологическое ингибирование циклооксигеназ ослабляет симптомы воспаления и боли, примерами таких ингибиторов являются аспирин, ибупрофен, диклофенак, нимесулид и другие.
ЦОГ-1 является конститутивной, то есть работает практически постоянно и выполняет физиологически важные функции. ЦОГ-1 ингибируется неселективными НПВС и это порождает многие побочные эффекты: бронхоспазм, ульцерогенез (раздражение слизистой желудка), боль в ушах, задержка воды в организме. Т.е. подавление её выработки приводит к характерным для неселективных ингибиторов (а главный из них – Диклофенак) побочным явлениям крайне широкого спектра.
ЦОГ-2 является индуцибельной, то есть начинает функционировать при определённых ситуациях, например, при воспалении. ЦОГ-2 экспрессируется макрофагами, синовиоцитами, фибробластами, гладкой сосудистой мускулатурой, хондроцитами и эндотелиальными клетками после индуцирования их цитокинами или факторами роста. Вероятно, простагландины, образующиеся под действием ЦОГ-2, могут напрямую или опосредованно усиливать продукцию самого фермента по механизму положительной обратной связи. Короче говоря, ЦОГ-2 начинает активно вырабатываться при травмах и других воздействиях, вызывающих воспаление и его спутника БОЛЬ. Чем быстрее подавляется выработка ЦОГ-2, тем быстрее снимается воспаление, боль и начинается процесс заживления травмированных тканей. Нимесулид (Найз) ингибирует избирательно именно ЦОГ-2, не затрагивая образование ЦОГ-1. Таким образом, Нимесулид (Найз) не вызвает такого большого количества побочных эффектов и ухудшения самочувствия в целом.
Преимущества Диклофенака: больше форм выпуска, в том числе инъекционный раствор, и ректальные свечи от геморроя, действует быстрее, дешевле, дольше применяется и соответственно шире распространен. Шире применение, благодаря множеству форм выпуска. Инъекционный раствор можно ввести локально, в значительной дозировкой, в сравнении с гелями и мазями для наружного применения. Также уколы значительно меньше нагружают печень (отсутствует первое прохождение из пищеварительной системы в кровь) и желудочно-кишечный тракт.
Преимущества Нимесулида (Найз): первое, главное и достаточное объективное преимущество – это селективный ингибитор ЦОГ-2, препарат следующего поколения. Т.е. общее самочувствие при его приеме вполне нормальное, в то время как эффективная дозировка диклофенака гарантировано вызовет легкую тошноту, метеоризм и сложности с пищеварением (в том числе диарею). Т.е. Найз – “мягче”, говоря качковским языком.
В тоже время оба препарата схожи в наиболее серьезных побочных явлениях: негативное влияние на кровь (снижение агрегации тромбоцитов – хуже затягиваются поверхностные раны и останавливаются кровотечения), токсическое воздействие на печень и почки. Короче говоря, список противопоказаний достаточно велик. Но это и не конфеты – препараты принимаются симптоматически и недолго.
Оба препарата достойно себя проявляют, имеют свои достоинства и недостатки. Все прочие НПВС проигрывают в сравнении с ними так или иначе. За полвека никто так и не смог сместить с трона нестероидных противовоспалительных препаратов Диклофенак, а также Нимесулид (появился в 1985 году), обладающий уникальными свойства селективного (избирательного) ингибитора ЦОГ-2.
компиляция и литературная адаптация – mmeat
Источник
Действующее вещество
Состав и форма выпуска препарата
Гель для наружного применения светло-желтый или желтый прозрачный, со специфическим запахом.
Вспомогательные вещества: метилпирролидон – 25 г, изопропанол – 10 г, пропиленгликоль – 10 г, карбомер – 1.2 г, макрогол 400 – 31.55 г, масло лаванды – 0.25 г, трометамол – 0.09 г, вода – до 100 г.
Примечание. При необходимости для достижения оптимального pH геля допускается изменение содержания трометамола в пределах от 0.02 г до 0.15 г на 100 г.
10 г – тубы алюминиевые (1) – пачки картонные.
20 г – тубы алюминиевые (1) – пачки картонные.
30 г – тубы алюминиевые (1) – пачки картонные.
Фармакологическое действие
НПВС из класса сульфонанилидов, селективный конкурентный обратимый ингибитор ЦОГ-2 . При наружном применении оказывает местное обезболивающее и противовоспалительное действие.
Снижает концентрацию короткоживущего простагландина Н2, субстрата для кинин-стимулированного синтеза простагландина Е2, в очаге воспаления и в восходящих путях проведения болевых импульсов в спинном мозге. Снижение концентрации простагландина Е2 (медиатора воспаления и боли) уменьшает активацию простаноидных рецепторов ЕР типа, что проявляется анальгетическим и противовоспалительным эффектами.
При наружном применении вызывает ослабление или исчезновение болей в месте нанесения лекарственного средства, в т.ч. болей в суставах в покое и при движении, уменьшает утреннюю скованность и припухлость суставов. Способствует увеличению объема движений.
Фармакокинетика
При наружном применении концентрация активного вещества в системном кровотоке крайне низка. Cmax после однократного нанесения отмечается к концу первых суток, ее величина более, чем в 300 раз ниже таковой для пероральных лекарственных форм нимесулида. Следов основного метаболита нимесулида – 4-гидроксинимесулида в крови не обнаруживается.
Показания
Местное симптоматическое лечение воспалительных и дегенеративных заболеваний опорно-двигательного аппарата: суставной синдром при обострении подагры; ревматоидный артрит; псориатический артрит; анкилозирующий спондилоартрит; остеоартроз; остеохондроз с корешковым синдромом; радикулит; воспалительное поражение связок, сухожилий, бурсит; ишиас, люмбаго; мышечные боли ревматического и неревматического происхождения; посттравматическое воспаление мягких тканей и опорно-двигательного аппарата (повреждения и разрывы связок, ушибы).
Противопоказания
Повышенная чувствительность к нимесулиду, эрозивно-язвенные поражения ЖКТ в фазе обострения, кровотечения из ЖКТ, дерматозы, повреждения эпидермиса и инфекции кожных покровов в области применения, почечная недостаточность тяжелой степени (КК <30 мл/мин), выраженная печеночная недостаточность, указание в анамнезе на явления бронхоспазма в связи с применением ацетилсалициловой кислоты или иного НПВС, беременность, период лактации (грудного вскармливания), детский возраст до 7 лет.
С осторожностью
Печеночная недостаточность; почечная недостаточность; выраженная сердечная недостаточность; артериальная гипертензия; сахарный диабет 2 типа; пожилой возраст, детский возраст.
Дозировка
Применяют наружно, наносят на область поражения 3-4 раза/сут.
Не следует применять более 10 дней без консультации врача.
Побочные действия
Местные реакции: зуд, крапивница, шелушение, транзиторное изменение цвета кожи (не требующее отмены лечения).
Системные реакции: при нанесении на обширные участки кожи или при длительном применении возможны изжога, тошнота, рвота, диарея, гастралгия, изъязвление слизистой ЖКТ, повышение активности печеночных трансаминаз; головная боль, головокружение; задержка жидкости, гематурия; аллергические реакции (анафилактический шок, кожная сыпь); тромбоцитопения, лейкопения, анемия, агранулоцитоз, удлинение времени кровотечения.
Лекарственное взаимодействие
Не исключено фармакокинетическое взаимодействие с препаратами, конкурирующими за связывание с белками плазмы крови.
Следует с осторожностью нимесулид одновременно с дигоксином, фенитоином, препаратами лития, диуретиками, циклоспорином, метотрексатом, другими НПВС, антигипертензивными и гипогликемическими средствами.
Особые указания
Рекомендуется наносить только на неповрежденные участки кожи, избегая попадания на открытые раны.
Не следует использовать под воздухонепроницаемыми повязками.
Беременность и лактация
Противопоказан при беременности, в период грудного вскармливания
Применение в детском возрасте
Противопоказан в детском возрасте до 7 лет.
С осторожностью следует назначать препарат в детском возрасте старше 7 лет.
При нарушениях функции почек
Противопоказан при почечной недостаточности тяжелой степени (КК< 30 мл/мин).
С осторожностью: почечная недостаточность.
При нарушениях функции печени
Противопоказан при тяжелой печеночной недостаточности.
С осторожностью: печеночная недостаточность.
Применение в пожилом возрасте
С осторожностью следует назначать препарат пациентам пожилого возраста.
Описание препарата НИМЕСУЛИД основано на официально утвержденной инструкции по применению и утверждено компанией–производителем.
Предоставленная информация о ценах на препараты не является предложением о продаже или покупке товара. Информация предназначена исключительно для сравнения цен в стационарных аптеках, осуществляющих деятельность в соответствии со статьей 55 ФЗ «Об обращении лекарственных средств».
Обнаружили ошибку? Выделите ее и нажмите Ctrl+Enter.
Источник
Заболевания суставов различной локализации являются одной из самых
частых причин обращения к врачу наряду с артериальной
гипертензией. Заболевания суставов являются социально значимыми
болезнями.
Во-первых, эти заболевания поражают значительную часть населения.
Наиболее распространенным заболеванием суставов является деформирующий
остеоартроз (ОА), особенно у лиц старше 65 лет, когда его
распространенность достигает 97% населения. Среди хронических
воспалительных заболеваний суставов наиболее частым является
ревматоидный артрит (РА) — заболевание, практически облигатно
приводящее к инвалидизации больных уже через 3–5 лет от дебюта
болезни.
Во-вторых, эти заболевания характеризуют развитие стойкого болевого
синдрома, который может быть связан с различными причинами.
Наиболее частая причина боли при патологии суставов — развитие
синовиита. Однако при ОА развитие боли может быть связано
и с другими патогенетическими звеньями болезни. В норме
болевые окончания имеют все структуры сустава, за исключением хряща. Но
при ОА происходит частичная васкуляризация и иннервация хряща.
Истончение и повреждение хряща снижает его амортизационные
свойства, увеличивается нагрузка на субхондральную кость
с развитием ее отека и боли. Кроме того, фибрилляция хряща
также индуцирует боль и воспаления.
Данные, полученные при изучении влияния боли на прогноз при ОА, свидетельствуют:
Около 20% больных не получают
адекватного лечения хронического болевого синдрома, так что уровень
боли у них по 10-сантиметровой визуальной аналоговой шкале (ВАШ)
составляет 5 см и более [1].Хроническая боль при ОА приводит к уменьшению продолжительности жизни женщин в среднем на 10–12 лет.
Продолжительность жизни пожилых больных с ОА в большей
степени зависит от интенсивности боли, чем от наличия сопутствующих
потенциально жизнеугрожающих заболеваний [2].Риск прогрессирования ОА
в равной степени связан с болевым синдромом, как
и с рентгенологическими изменениями.
Нестероидные противовоспалительные препараты (НПВП) обладают
анальгетическим, противовоспалительным и жаропонижающим эффектами.
Поэтому они являются незаменимыми в лечении артрологических
заболеваний. Быстрое развитие обезболивающего эффекта и определяет
облигатность их применения в лечении суставной патологии.
Позитивный лечебный эффект НПВП связан с ингибицией ЦОГ-2. Этот
фермент, участвующий в каскаде распада поврежденных при воспалении
и других поражениях клеточных мембран, отвечает за выделение
провоспалительных простагландинов и других медиаторов воспаления
не только в суставах, но и в других органах
и тканях, в первую очередь в стенках сосудов. Исходя из
вышесказанного, становится ясно, что использование селективных
ингибиторов ЦОГ-2 имеет важное клиническое и социальное значение.
В клинической практике селективные ингибиторы ЦОГ-2 заняли прочное
место, хотя до сих пор не весь потенциал их возможностей используется
практическими врачами. Нередко возникают «мифы» об их потенциальной
токсичности, в первую очередь в отношении сердечно-сосудистой
системы. В западной литературе была опубликована информация
о гепатотоксичности нимесулидов, основанная на единичных
и плохо документированных клинических случаях. Эти аспекты
хотелось особо обсудить в данном сообщении, взяв в качестве
примера препарат «Найз».
Препарат «Найз» относится к селективным ингибиторам ЦОГ-2, что
доказано в исследованиях in vivo [7] и in vitro на
молекулярных моделях [6]. Кроме того, препарат обладает еще несколькими
важными механизмами действия (рис.). Наибольший опыт применения
препарата «Найз» в ревматологической практике в Российской
Федерации накоплен в лечении больных с ОА. Больные ОА, как
правило, имеют высокий риск развития желудочно-кишечных осложнений
в связи с возрастом, частым наличием сопутствующей
сосудистой, кардиальной, ренальной патологии и необходимостью
использовать сопутствующую терапию. Найз обычно используется этой
категорией больных в суточной дозе 200 мг/сутки. Это
обеспечивает достижение клинического эффекта у 87% [8] — 93%
[9] больных при хорошей переносимости Найза в отношении
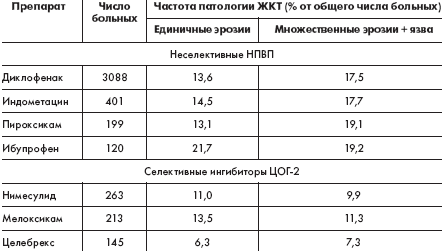
желудочно-кишечного тракта, как по отечественным данным (табл. 1), так
и по данным зарубежных контролируемых исследований,
постмаркетингового изучения переносимости нимесулида в 17 странах
у 118 831 385 больных [10–13].

В нашем исследовании участвовало 40 больных с ОА
(32 больных) и с РА (8 больных), в возрасте от 49
до 79 лет (58,8 ± 18,3 года), страдающих
артериальной гипертензией более чем 5 лет, получающих стабильную
дозу антигипертензивных препаратов в течение не менее
6 месяцев, без явных проявлений сердечной недостаточности.
Большинство больных получали ингибиторы АПФ (эналаприл
10–30 мг/сутки) — 28 больных, β-адреноблокаторы
(пропранолол 20–40 мг/сутки) — 12 больных. Всем больным
после 3-дневного периода перерыва в приеме НПВП (ибупрофен,
мелоксикам, кетопрофен, диклофенак) назначался рандомизировано либо
диклофенак в дозе 100–150 мг/сутки, либо Найз в дозе
200–400 мг/сутки на 20 дней. АД регистрировалось 6 раз
в сутки: после пробуждения, перед первым приемом
антигипертензивных или нитратных препаратов, через 2 часа после их
приема и далее еще 3 раза с равными промежутками
в течение всего периода «отмывки», первую и последнюю неделю
приема НПВП, в остальное время исследования АД регистрировалось
4 раза в сутки каждые 3 часа с момента пробуждения.
Пациенты в течение периода исследования вели дневник
с указанием АД, приема антигипертензивных препаратов
и нежелательных реакций. Статистическая обработка проводилась
методом сопряженных пар.
Практически у всех больных обеих групп к концу периода
«отмывки» отмечалось увеличение среднесуточного АД (табл. 2). Тем
не менее, в течение 1-й недели лечения (табл. 2), различия
в среднем систолическом давлении были достоверно больше при приеме
диклофенака, а на фоне Найза практически не отличались от
исходного (p < 0,001). В меньшей степени на фоне
диклофенака в течение 1-й недели лечения увеличилось
среднесуточное диастолическое АД (ДАД) — на 3,31 ± 5,42;
увеличение этого параметра к концу 1-й недели лечения Найзом не
зарегистрировано. У 16 из 20 больных, получавших диклофенак,
отмечено негативное влияние препарата на течение артериальной
гипертензии — повышение систолического и/или диастолического
давления, сопровождавшееся неприятными субъективными ощущениями —
головная боль, кардиалгии (16), развитие гипертонического криза
(2 больных — отмена диклофенака через 6–14 дней приема),
увеличение потребности в приеме антигипертензивных препаратов
(6 больных). Среди больных, получавших Найз, не отмечено случаев
увеличения потребности в антигипертензивной терапии
и значимого изменения уровня АД, так что все 20 больных
закончили 3-недельный период лечения. Диклофенак был отменен
8 больным в связи с изменением течения артериальной
гипертензии: развитие гипертонического криза (2 пациента)
и нарастание уровня АД как систолического, так
и диастолического (2 больных), что потребовало увеличения
дозы эналаприла у обеих больных; у 2 больных
в связи с гастралгиями, у 1 больного из-за диареи;
у 1 больной из-за головной боли. Увеличение среднесуточного
систолического давления у больных, закончивших лечение
диклофенаком, было статистически достоверным и составило
15,74 ± 11,0; к концу лечения Найзом —
1,71 ± 5,22 (р > 0,05). Известно, что изменение
систолического АД (САД) является более важным фактором риска
кардиоваскулярной патологии, чем изменение ДАД [19]. Уменьшение уровня
САД на 12 мм рт. ст. снижает риск развития инфаркта миокарда на
27%, усугубления застойной сердечной недостаточности на 55%
и инсульта на 56% [19, 20].

Аналогичные результаты продемонстрированы в исследовании
В. И. Мазурова и соавт. [21], сравнивших гемодинамические
показатели у больных ОА (n = 40), имеющих
(23 пациента) или не имеющих (17 пациентов) сопутствующую
артериальную гипертензию (АГ), при назначении Найза или диклофенака на
1 месяц. Пациенты всех подгрупп были сопоставимы по локализации
ОА, рентгенологической стадии. Пациенты, имевшие ОА в сочетании
с АГ, были примерно на 10 лет старше больных
с нормальным уровнем АД. Доза Найза составляла 200 мг/сутки
и диклофенака — 100 мг/сутки. Для лечения АГ всем
больным второй подгруппы был назначен Ренитек (эналаприл) по
5–10 мг 2 раза в сутки. Всем больным до назначения НПВП
и через 1 месяц помимо клинического осмотра и оценки
боли (по шкале ВАШ) проводились ЭКГ, суточное мониторирование АД,
импедансометрическая кардиография (ИМК), определение уровня
десквамированных эндотелиоцитов в периферической крови по методике
Hladovec J. и соавт. (1978), определение состояния
эндотелий-зависимой и эндотелий-независимой (проба
с нитроглицерином) вазодилятации (ЭЗВД, ЭНВД соответственно)
плечевой артерии с помощью ультразвука высокого разрешения.
Через один месяц лечения статистически значимых различий
в уменьшении боли по ВАШ на фоне приема Найза или диклофенака не
отмечено (p > 0,05). Данные средних параметров суточного
мониторирования АД представлены в табл. 3 и 4.
При назначении Найза больным ОА без АГ (группа 1А) среднее суточное САД
и среднее дневное САД и ДАД повышались в пределах
нормальных значений без субъективных ощущений. В группе 1Б,
получавшей диклофенак, отмечено более значимое увеличение
систолического и ДАД, как среднесуточного, так
и среднедневного (p < 0,05), что сопровождалось
ухудшением самочувствия больных, а в одном случае
потребовалось назначение гипотензивной терапии.
В группе больных с ОА и АГ, получавших Найз (2А),
статистически значимого увеличения уровня АД не было зарегистрировано,
а при лечении диклофенаком (группа 2Б) достоверно увеличились
уровень среднесуточного САД (p < 0,01), среднедневного САД
(p < 0,05), при этом индекс площади САД за сутки
увеличился более чем в 2 раза (p < 0,05),
а ДАД — почти в 3 раза (p < 0,05), что
свидетельствует о стабильности повышения АД в течение суток.
Эти изменения АД сопровождались ухудшением самочувствия больных,
появлением одышки, отеков нижних конечностей, потребовалась коррекция
гипотензивной терапии (увеличение дозы Ренитека или применение
комбинированной терапии).
При изучении параметров системной гемодинамики в подгруппах
больных, получавших Найз, их существенных изменений выявлено не было.
В подгруппе пациентов с исходно нормальным уровнем АД,
получавших диклофенак, отмечалось достоверное (p < 0,05)
увеличение общего периферического сопротивления (ОПСС), снижение
параметров, отражающих общую производительность сердца: сердечный
индекс (СИ) и ударный индекс (УИ), а также существенное
увеличение объемов внеклеточной жидкости. Еще более значимая
отрицательная динамика показателей системной гемодинамики выявлена
у больных с АГ, получавших диклофенак. При сравнительном
исследовании влияния Найза и диклофенака на функцию эндотелия
у больных ОА с АГ было установлено, что прием Найза не влиял
на показатели ЭЗВД и ЭНВД, тогда как при лечении диклофенаком были
получены статистически значимые (p < 0,05) изменения ЭЗВД,
ЭНВД и количества десквамированных эндотелиоцитов. Эти данные
свидетельствуют, что неселективный ингибитор ЦОГ диклофенак достоверно
ухудшал функцию эндотелия, хотя механизмы такого влияния остаются
неясными и требуют дальнейшего изучения.
Эти данные еще раз подтверждают, что применение селективных ингибиторов
ЦОГ-2, к которым относится препарат «Найз», положительно влияют на
состояние эндотелия сосудов. У больных с риском развития
тромбозов эти препараты должны назначаться совместно с низкими
дозами Аспирина. Такое сочетание может привести к увеличению
частоты осложнений со стороны ЖКТ, поэтому эти больные должны тщательно
наблюдаться с эндоскопическим исследованием состояния ЖКТ
и мониторингом параметров гемодинамики, проведением
профилактических мероприятий (табл. 5).

Препарат «Найз» является эффективным противовоспалительным препаратом.
Как и для всех НПВП, его эффективность является дозозависимой. При
лечении больных ОА, как правило, бывает достаточным назначение его
в дозе 200 мг/сутки, что обеспечивает и анальгетический,
и противовоспалительный эффект. Как уже упоминалось выше, ЦОГ-2
ингибиторы в отличие от классических НПВП не оказывают
отрицательного влияния на суставной хрящ. Кроме того, нимесулид
в спектре своего механизма действия имеет ингибицию IL-1b [22],
ингибицию апоптоза хондроцитов [23], подавление активности
металлопротеаз [24], что подтверждает отсутствие у него
отрицательного влияния на суставной хрящ. При хронических
воспалительных заболеваниях суставов, таких как РА или псориатический
артрит (ПсА), выраженность синовита может во много раз превышать
таковую при ОА, что требует индивидуального подбора суточной дозы Найза
от 200 до 400 мг/сутки. Увеличение его эффективности при
увеличении суточной дозы при РА была показана отечественными авторами,
а при ПсА зарубежными авторами [25].
Таким образом, препарат «Найз» зарекомендовал себя активным НПВП, при
индивидуальном подборе его дозы количество больных «ответчиков»
достигает 93% в сочетании с хорошей переносимостью.
По вопросам литературы обращайтесь в редакцию.
Н. В. Чичасова, доктор медицинских наук, профессор
Г. Р. Имаметдинова
Е. Л. Насонов, доктор медицинских наук, профессор, академик РАМН
ММА им. И. М. Сеченова, Москва
Источник
