Хемотаксис лейкоцитов при воспалении
Эмиграция лейкоцитов (лейкодиапедез) – выход лейкоцитов из просвета сосудов ч/з сосудистую стенку в окружающую ткань. Этот процесс совершается и в норме, но при В. приобретает гораздо большие масштабы. Смысл эмиграции состоит в том, чтобы в очаге В. скопилось достаточное число клеток, играющих роль в развитии В. (фагоцитоз и т.д.).
Эмиграция лейкоцитов в очаг В. начинается с их краевого (пристеночного) стояния, которое может продолжаться несколько десятков минут. Затем гранулоциты и агранулоциты проходят через сосудистую стенку и продвагиются к объекту фагоцитирования. Лейкоциты выходят за пределы сосуда на стыке между эндотелиальными клетками. Это объясняется округлением эндотелиоцитов и увеличением интервалов между ними. После выхода лейкоцитов контакты восстанавливаются. Направленное движение лейоцитов объясняется накоплением в очаге В. экзо- и эндогенных хемоаттрактантов – веществ индуцирующих хемотаксис, повышением температуры (термотаксис), а также развитием условий для гальвано- и гидромаксиса.
Функцию эндогенных хемоаттрактантов выполняют фракции системы комплемента, в особенности компонент С5а. Свойствами хемоаттрактантов обладают кинины и активированный фактор – Хагемана. Экзогенными хемоаттрактантами являются пептиды бактериального происхождения, в особенности те, которые содержат N-фармиловые группы.В эмиграции лейкоцитов в очаг В. наблюдается определенная очередность: сначала эмигрируют нейтрофильные гранулоциты, моноциты, лимфоциты. Более позднее проникновение моноцитов объясняется их меньшей хемотаксической чувствительностью. После завершения воспалительного процесса в очаге наблюдается постепенное исчезновение клеток крови, начиная с тех лейкоцитов, которые появились раньше (нейтрофильные гранулоциты). Позже элиминируются лимфоциты и моноциты.
В очаге В. осуществляется активное движение лейкоцитов к химическим раздражителям – хемоаттрактантам в соответствии с градиентами их концентрации. Ориентированное движение клеток и организмов под влияеми химических раздражителей – хемоаттрактантов получило название – хемотаксис. В хемотаксисе лейкоцитов большое значение имеет система комплемента и прежде всего компоненты С3 и С5. Лейкотаксически активные компоненты системы комплемента С3 и С5 образуются в очаге В. под влиянием различных ферментов: трипсина, тромбина, плазмы, уровень которых в условиях альтерации возрастает.
После взаимодействия хемоаттрактантов со своими рецепторами на поверхности нейтрофилов и активированных моноцитов, хаотическое движение фагоцитов прекращается. Фагоциты начинают ориентировано перемещаться по направлению к объекту эндоцитоза в соответствии с градиентами концентрации хемоаттрактантов, то есть становятся ориентированными. Процесс эмиграции может не только стимулироваться, но и подавляться. Рост содержания в очаге В. кортизола тормозит ориентированный хемотаксис нейтрофилов. Гиперкортизолемия, тормозящая миграцию ориентированных полиморфонуклеаров, направлена на предотвращение трансформации В. из защитной в патологическую реакцию.
Реакция сосудов микроциркуляторного русла при воспалении. Динамика изменения кровотока, стадии и механизмы.
Динамика сосудистых реакций и изменения кровообращения при развитии В. стереотипа: вначале возникает кратковременный рефлекторный спазм ортериол и прекапилляров с замедлением кровотока, затем, сменяя друг друга, развивается артериальная и венозная гиперемия, престаз и стаз – остановка кровотока.
Артериальная гиперемия является результатом образования в очаге В. большого количества вазоактивных веществ – медиаторов В., которые подавляя автоматию гладкомышечных элементов стенки артериол и прекапилляров, вызывают их расслабление. Это приводит к увеличение притока артериальной крови, ускоряет ее движение, открывает ранее не функционировавшие капилляры, повышает в них давление. Кроме того, приводящие сосуды расширяются в результате “паралича” вазоконстрикторов и доминирования парасимпатических влияний на стенку сосудов, ацидоза, гиперкалийионии, снижения эластичности окружающей сосуды соединительной ткани.
Венозная гиперемия возникает вследствие действия ряда факторов, которые можно разделить на три группы: 1) факторы крови, 2) факторы сосудистой стенки, 3) факторы окружающих тканей. К факторам, связанным с кровью, относится краевое расположение лейкоцитов, набухание эритроцитов, выход жидкой части крови в воспаленную ткань и сгущение крови, образование микротромбов вследствие активации фактора Хагемана и уменьшении содержания гепарина.
Влияние факторов сосудистой стенки на венозную гиперемию проявляется набуханием эндотелия, в результате чего просвет мелких сосудов еще больше суживается. Измененные венулы теряют эластичность и становятся более податливыми сдавливающему действию инфильтрата. И, наконец, проявление тканевого факторов состоит в том, сто отечная ткань, сдавливая вены и лимфатические сосуды, способствует развитию венозной гиперемии.
С развитием престатического состояния наблюдается маятникообразное движение крови – во время систолы она движется от артерий к венам, во время дистолы – в противоположном направлении. Наконец, движение крови может полностью прекратиться и развивается стаз, следствием которого могут быть необратимые изменения клеток крови и тканей.
Компонент воспаления «сосудистые реакции и изменения крово- и лимфообращения» является результатом альтерации ткани. Понятие «сосудистые реакции» подразумевает изменения тонуса стенок сосудов, их просвета, крово- и лимфообращения в них, проницаемости сосудистых стенок для клеток и жидкой части крови
При воспалении на разных стадиях сосудистых реакций происходят следующие важные и последовательные процессы.
• Повышение тонуса стенок артериол и прекапилляров, сопровождающееся уменьшением их просвета и развитием ишемии.
• Снижение тонуса стенок артериол, сочетающееся с увеличением их просвета, развитием артериальной гиперемии, усилением лимфообразования и лимфооттока.
• Уменьшение просвета венул и лимфатических сосудов, нарушение оттока крови и лимфы по ним с развитием венозной гиперемии и застоя лимфы.
• Дискоординированное изменение тонуса стенок артериол, венул, пре- и посткапилляров, лимфатических сосудов, сочетающееся с увеличением адгезии, агрегации и агглютинации форменных элементов крови, её сгущением и развитием стаза.
Закономерный характер течения воспаления в значительной мере определяется именно стереотипной сменой тонуса стенок и просвета микрососудов, а также крово- и лимфотока в них. Сосудистые реакции подразделяют на последовательно развивающиеся в данном участке воспаления стадии ишемии, венозной гиперемии, артериальной гиперемии и стаза.
Источник
- Иммунология и аллергология
- Иммунология
- Иммунология
При развитии воспаления под влияние провоспалительных факторов быстро попадают клетки эндотелия мелких сосудов — капилляров и
посткапиллярных венул. В качестве факторов при этом выступают прежде всего цитокины, секретируемые макрофагами и другими вовлекаемыми в воспаление клетками, — IL-1P и TNFa (рис. 2.23). Эндотелиальные клетки конститутивно экспрессируют рецепторы для этих цитокинов. Под влиянием цитокинов происходит активация эндотелиальных клеток с трансформацией из плоских в высокие клетки и экспрессией ряда мембранных молекул, включая Р- и Е-селектины, рецепторы L-селектинов (адрессины) и интегринов (ICAM-1, VCAM-1), а также секрецией провоспалительных цитокинов и хемокинов.
На лейкоцитах крови конститутивно экспрессированы L-селектины, рецепторы для Р- и Е-селектинов (PSGL-1 и другие адрессины), а также интегрины LFA-1, Мас-1, p150,95 и aDP2, находящиеся в неактивной (свернутой) форме. Взаимодействие молекул адгезии лейкоцитов и активированных клеток эндотелия служит основой процесса эмиграции лейкоцитов из кровяного русла. Процесс осуществляется в 4 стадии (рис. 2.24).

• Стадия 1 (стадия качения). В описанной выше исходной ситуации имеются условия для взаимодействия L-селектинов лейкоцитов пристеночного слоя с адрессинами на эндотелиальных клетках, а также E- и P-селектинов эндотелиальных клеток с адрессинами лейкоцитов. Поскольку это взаимодействие слабое (из-за невысокого сродства и легкого смывания селектинов

с поверхности клеток), лейкоциты взаимодействуют с клетками сосудистой стенки непрочно и клетки перекатываются вдоль стенки капилляра или венулы по направлению тока крови. Эта фаза занимает 1—5 с.
- Стадия 2 (стадия активации). Хемокины, продуцируемые эндотелиальными клетками (IL-8 и др.), воздействуют на рецепторы лейкоцитов и вызывают их активацию с участием ГТФ-связывающих белков семейства Rho. Одновременно с этим происходит слабое взаимодействие неактивных молекул LFA-1 и других лейкоцитарных интегринов с их рецепторами, экспрессированными под влиянием цитокинов на поверхности эндотелиальных клеток. При этом генерируется сигнал типа «снаружи внутрь» (см. раздел 2.3.1.2) и происходит «активация интегринов» — развертывание молекулы и «открытие» ее головной части, что многократно повышает сродство интегринов к их рецепторам. Эта стадия занимает до 20 с.
- Стадия 3 (стадия прочной адгезии). В результате описанных выше изменений взаимодействие лейкоцитарных интегринов с рецепторами эндотелиальных клеток становится прочным, и клетки останавливаются. Во взаимодействии со стороны лейкоцитов участвуют преимущественно молекулы LFA-1, а со стороны эндотелия — ICAM-1. Эта стадия длится несколько минут.
- Стадия 4 (стадия экстравазации). После остановки лейкоцит становится доступным для хемотаксических сигналов, поставляемых хемокинами и другими хемотаксическими факторами (пептиды fMLP, С3а, С5а, лейкотри- ен D4 и др.). В продвижении между эндотелиальными клетками решающая роль принадлежит гомотипическим (подобное с подобным) взаимодействиям 2 типов, осуществляемых молекулами PeCAM (CD31) и CD99. PeCAM участвует в проникновении лимфоцита в межэндотелиальное пространство и выходе из него, а CD99 — в преодолении зоны контакта между эндотелиальными клетками. Экстравазация лейкоцита занимает до 10 мин.
Дальнейшее продвижение лейкоцитов осуществляется за счет адгезивных взаимодействий с межклеточным матриксом и хемотаксического вектора, задаваемого гуморальными факторами, исходящими из очага воспаления. В адгезивных взаимодействиях участвуют ргинтегрины лейкоцита (молекулы серии VLA) и белки матрикса — фибронектин, ламинин, коллаген. Наиболее важные хемотаксические агенты — факторы, вызывающие экстравазацию: бактериальные пептиды fMLP, а также группа эндогенных хемотаксичес- ких факторов, синтезируемых de novo в очаге воспаления (преимущественно макрофагами) или образующихся при расщеплении других факторов (компонентов комплемента). К эндогенным хемотаксическим факторам относят фрагменты компонентов комплемента С3а, С5а, липидные метаболиты (лейкоториен D4 и фактор агрегации тромбоцитов), а также хемокины. Как уже отмечалось, хемокины различаются по способности привлекать разные типы лейкоцитов. Особенно четко такие различия проявляются в отношении нейтрофилов и моноцитов. Хемотаксической активностью в отношении нейтрофилов обладают а-хемокины (IL-8, факторы группы GRO и т.д.), а в отношении моноцитов — в-хемокины (факторы групп MCP и MIP).
Обязательное условие направленного движения клеток — градиент хемо- таксических факторов. Показано, что перепад концентрации фактора должен составлять не менее 1% на дистанцию, равную диаметру клетки.
Однако наиболее важна для осуществления хемотаксиса активная направленная подвижность клеток. В основе движения лейкоцитов лежит реакция контрактильных белков цитоскелета, прежде всего актина. Мобилизация компонентов цитоскелета происходит при активации через родопсиноподобные рецепторы хемотаксических факторов (см. выше). Вследствие поляризации и происходящей при этом реорганизации цитоскелета клетка из округлой становится треугольной. В сторону объекта хемотаксиса выдвигается ламеллоподий — участок цитоплазмы, бедный органеллами, но содержащий сеть микрофиламентов, в частности нитчатый (filamentous) F-актин. Ориентацию клетки в процессе хемотаксиса определяет полимеризация микротрубочек, а процесс движения — сокращение микрофиламентов.
Некоторая часть мембранных гликопротеинов перемещается в сторону полюса поляризации, на котором значительно усиливается экспрессия в2-интегринов. Аппарат Гольджи переориентируется в направлении движения клетки. Происходит конформационная перестройка (ремоделирование) фосфолипидов мембраны. При этом клетка секретирует эластазу, коллаге- назу и катепсины, что способствует преодолению базальных мембран вокруг сосудов и под эпителиальными пластами, а также других «преград».
Как известно, раньше других клеток в очаг воспаления мигрируют нейтрофилы, существенно позже туда попадают моноциты. Однако скорость хемотаксического перемещения нейтрофилов и моноцитов сопоставима (около 15 мкм/мин, т.е. почти 1 мм/ч). Различия во времени их проникновения в очаг воспаления связаны в значительной степени с разной исходной локализацией: нейтрофилы преобладают в пристеночном слое сосудистого русла и быстрее начинают движение к очагу воспаления.
Источник: Ярилин.А.А , «Иммунология » 2010
А так же в разделе «Эмиграция и хемотаксис лейкоцитов »
- Основные группы хемоаттрактантов
- Хемокины и их рецепторы
- Хемокины в очаге воспаления. Интерлейкин-8 и другие провоспалительные хемокины
- Фагоцитоз
- Адгезия фагоцитов к объектам фагоцитоза. Феномен опсонизации
- Рецепторы для распознавания опсонинов (Fc- и С3-рецепторы)
- Активация, обусловленная связыванием рецепторов фагоцитов. Формирование фагоцитарной чаши
- Формирование и созревание фагосомы
- Бактерицидная функция фагоцитов
- Кислородзависимые факторы бактерицидности
- Оксид азота и его производные
- Факторы бактерицидности, не зависящие от кислорода и оксида азота
Источник
Хемотаксис – процесс активного движения лейкоцитов к химическим раздражителям. Различают хемотаксис положительный (движение к объекту фагоцитоза) и отрицательный (движение фагоцита от объекта фагоцитоза) [2].
Процессу эмиграции лейкоцитов предшествует нарушение осевого тока движения крови внутри сосуда. В условиях замедления кровотока эритроциты, объединяясь в «монетные столбики», занимают центральную часть сосуда, а лейкоциты, имеющие более низкую удельную массу, выходят из осевого тока сначала на границу плазматического слоя, а затем начинают прилипать к эндотелиальным клеткам сосуда.
Взаимодействие молекул адгезии лейкоцитов и активированных клеток эндотелия служит основой процесса эмиграции лейкоцитов из кровяного русла. Процесс осуществляется в 4 стадии.
Стадия 1 (стадия качения) – лейкоциты взаимодействуют с клетками сосудистой стенки непрочно, и клетки перекатываются вдоль стенки капилляра или венулы по направлению тока крови. Эта фаза занимает 1–5 с.
Стадия 2 (стадия активации). Хемокины, продуцируемые эндотелиальными клетками, воздействуют на рецепторы лейкоцитов и вызывают их активацию с участием ГТФ-связывающих белков. Одновременно с этим происходит слабое взаимодействие лейкоцитарных интегринов с их рецепторами, экспрессированными под влиянием цитокинов на поверхности эндотелиальных клеток. Эта стадия занимает до 20 с.
Стадия 3 (стадия прочной адгезии) – взаимодействие лейкоцитарных интегринов с рецепторами эндотелиальных клеток становится прочным, и клетки останавливаются.
Стадия 4 (стадия экстравазации). После остановки лейкоцит становится доступным для хемотаксических сигналов, поставляемых хемокинами и другими хемотаксическими факторами. В продвижении между эндотелиальными клетками решающая роль принадлежит гомотипическим (подобное с подобным) взаимодействиям 2 типов, осуществляемых молекулами РеСАМ (СБ31) и СБ99. Экстравазация лейкоцита занимает до 10 мин [5].
Дальнейшее продвижение лейкоцитов осуществляется за счет адгезивных взаимодействий с межклеточным матриксом и хемотаксического вектора, задаваемого гуморальными факторами, исходящими из очага воспаления. Обязательное условие направленного движения клеток – градиент хемотаксических факторов. Показано, что перепад концентрации фактора должен составлять не менее 1 % на дистанцию, равную диаметру клетки.
В большинстве случаев острого воспаления внутрисосудистые перемещения лейкоцитов и их эмиграция занимают несколько часов. Как правило, первыми в очаг воспаления выходят нейтрофилы, они обнаруживаются в воспаленной ткани уже через 6–24 часа. Несколько позднее эмигрируют моноциты и лимфоциты (24–48 часов). Однако скорость хемотаксического перемещения нейтрофилов и моноцитов сопоставима (около 15 мкм/мин, т.е. почти 1 мм/ч). Такая асинхронность эмиграции клеток обусловлена неодновременным появлением молекул адгезии и хемотаксических факторов, специфичных для разных лейкоцитов, а также с разной исходной локализацией: нейтрофилы преобладают в пристеночном слое сосудистого русла и быстрее начинают движение к очагу воспаления.
Нужно отметить, что временные интервалы эмиграции лейкоцитов и последовательность их выхода весьма относительны и определяются типом сосуда, видом и стадией воспаления [4].
Исходя из вышеизложенного механизма хемотаксиса можно сделать вывод, что для его осуществления необходимо включение всех механизмов воспалительной реакции, в том числе нейрогуморальной регуляции, то есть необходима согласованная работа нервной и гуморальной систем. Учитывая, что у ЦНС наиболее короткий период приживаемости – до 5–6 мин с максимумом до 30 мин, воспалительные процессы, в том числе хемотаксис лейкоцитов, после смерти маловероятны.
Нами было исследовано несколько статей, посвященных изучению повреждений, нанесенных посмертно. В частности, в статье Исакова с соавторами «К судебно-медицинской оценке кровоизлияний» [3] проводилось изучение кровоизлияний, нанесённых после смерти. По результатам исследования были сделаны выводы о том, что причинами посмертного возникновения кровоизлияний являются разрушенные кровеносные сосуды с последующим выходом крови (под воздействием силы тяжести) в окружающие ткани с их пропитыванием и образованием свертков. Однако, исходя из данных указанной статьи, посмертно причиненные повреждения в виде кровоизлияний по своим макроморфологическим и гистологическим признакам могут быть весьма сходными с прижизненными и привести к экспертным ошибкам. В данном случае следует учитывать, что кровь, выходящая из кровеносных сосудов, содержит, помимо эритроцитов, клетки белой крови, из-за чего при недостаточно внимательном исследовании возможна ошибочная интерпретация этих клеток как клеток воспалительного ряда.
Данная проблема была также освещена в статье Берга О.Ю. с соавторами «К вопросу о прижизненности и давности причинения повреждений при механической травме» [1], где изучалась динамика морфологических изменений тканей в зоне постмортальных повреждений, нанесенных дозированно тупым твердым предметом спустя 4–6 часов после биологической смерти: через несколько минут после причинения повреждений в этой области образовывались четко выраженные синюшного цвета кровоподтеки, на разрезах в подкожной клетчатке и поверхностных мышцах, в проекции ударного воздействия были выявлены темно-красные очаговые кровоизлияния. Далее проводилось изучение гистологических срезов мягких тканей на границе с неповрежденными тканями с определенными интервалами времени. По результатам исследований были сделаны выводы о том, что морфологические изменения в зоне посмертно нанесенных повреждений по своим морфологическим показателям были схожи с прижизненно причиненными.
Данные статьи навели нас на мысль о возможности существования такого явления, как посмертный хемотаксис лейкоцитов.
Учитывая, что срок жизни зрелых лейкоцитов в кровяном русле составляет около 8–12 часов, не имеет смысла исследование данного процесса в более поздние сроки, поскольку после этого промежутка времени хемотаксис заведомо происходить не будет. Кроме того, в этот временной промежуток может формироваться морфологическая картина, характерная для переживаемости тканей, что сопровождается тем, что в зоне повреждения в постмортальном периоде возникают морфологические изменения, схожие с изменениями, возникающими в зоне прижизненно причинённых повреждений.
Для изучения данного процесса нами были исследованы микропрепараты, изготовленные из мягких тканей лиц, погибших в результате транспортных происшествий с участием автомобилей, поездов, падения с высоты, травмы, нанесенной тупыми и острыми предметами, огнестрельных ранений, а также в результате ожогов, при которых смерть наступила на месте происшествия мгновенно. Вскрытие проводилось через 12–18 часов после смерти, что позволяло в полной мере оценить возможную посмертную реакцию на повреждения.
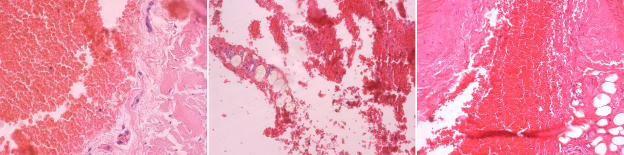
В представленных гистологических препаратах определяются кровоизлияния, представленные эритроцитами с четкими контурами, среди которых не определяются лейкоциты. Перифокально сосуды малокровны, спазмированы. В сосудах и окружающих тканях клетки воспалительного ряда не определяются (рис. 1).

Рис.1. Кровоизлияния, представленные эритроцитами с четкими контурами, среди которых не определяются лейкоциты
Таким образом, по результатам исследования микропрепаратов нам не удалось выявить существование процесса посмертного хемотаксиса лейкоцитов.
Список литературы
- Берг О.Ю. К вопросу о прижизненности и давности причинения повреждений при механической травме / Берг О.Ю., Пикулева М.В., Исаев Ю.С. // Актуальные вопросы судебной и клинической медицины. – Ханты-Мансийск, 2008. – В. 10. – С. 17–18.
Березнякова А.И. Патологическая физиология: учебник. – Х.: Изд- во НФАУ, 2000. – 448 с.
- Исаков В.Д. К судебно-медицинской оценке кровоизлияний / В.Д. Исаков, Г.П. Лаврентюк, В.Е. Сысоев, М.Т. Исмаилов // Судебно-медицинская экспертиза. – 2009. – № 3. – С. 3–5.
- Свободнорадикальные процессы и воспаление (патогенетические, клинические и терапевтические аспекты): учеб. пособие / Сологуб Т.В., Романцова М.Г., Кремень Н.В и др. – Академия естествознания, 2008.
- Ярилин А.А. Иммунология / А.А. Ярилин. – М.: ГЭОТАР-Медиа, 2010. – 752 с.
Источник
