Эффекты гистамина в очаге воспаления
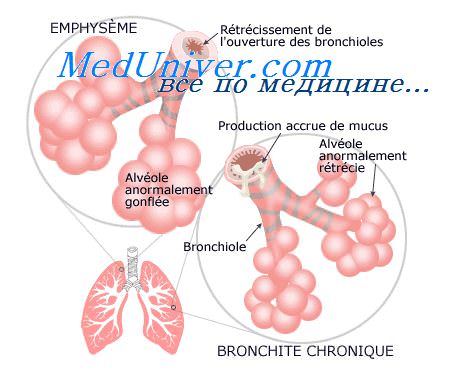
Механизм действия гистамина и его эффекты
а) Функции гистамина. Гистамин служит в качестве нейромедиатора/модулятора в ЦНС, вызывающего среди прочих эффектов состояние бодрствования. В слизистой оболочке желудка он действует как медиатор, который выделяется энтерохромаффиноподобными (ECL) клетками для стимуляции секреции кислоты желудочного сока соседними париетальными клетками.
Гистамин, содержащийся в базофилах крови и тканевых тучных клетках, играет роль медиатора в IgE-опосредованных аллергических реакциях. Гистамин, повышая тонус гладкой мускулатуры бронхов, может спровоцировать приступ бронхиальной астмы. Он стимулирует перистальтику кишечника, о чем свидетельствует появление диареи при пищевой аллергии.
Гистамин увеличивает проницаемость кровеносных сосудов, вызывая образование щелей между эндотелиальными клетками посткапиллярных венул, что позволяет жидкости проходить в окружающие ткани (образование волдырей). Кровеносные сосуды расширяются, т. к. гистамин стимулирует выход NO из эндотелия, а также оказывает прямое релаксирующее действие на сосуды. Стимулируя чувствительные нервные окончания кожи, гистамин может вызывать зуд.
б) Рецепторы. Гистаминовые рецепторы связаны с белками G. Гистаминовые Н1- и Н2-рецепторы служат мишенями для веществ с антагонистическими свойствами. Н3-рецепторы находятся в нервных клетках и могут ингибировать выход разнообразных медиаторов, включая сам гистамин. Позже был обнаружен еще один подтип рецепторов — Н4-рецепторы; они локализуются на определенных клетках воспаления.
в) Метаболизм. Гистаминсодержащие клетки образуют гистамин путем декарбоксилирования аминокислоты гистидина. Выброшенный гистамин разрушается, т. к. для негоотсутствуетсистема обратного захвата, как для норадреналина, дофамина и серотонина.
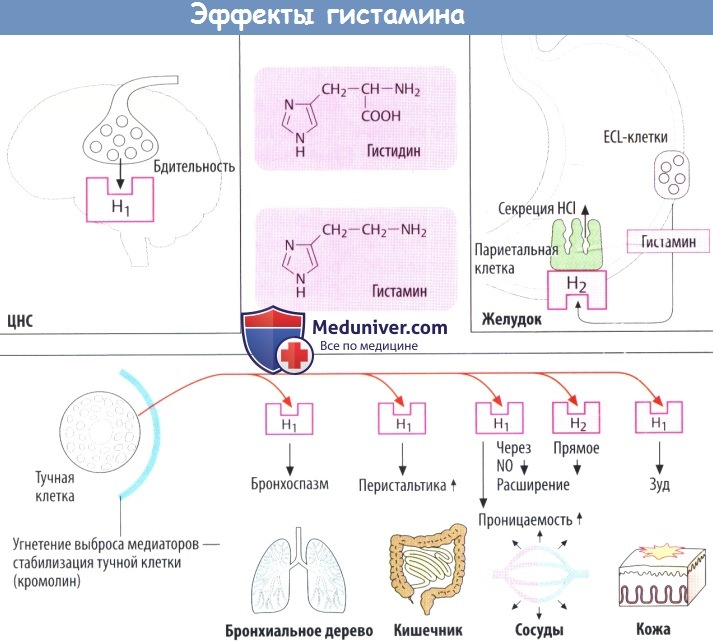
г) Антагонисты. Селективные антагонисты могут блокировать Н1- и Н2-гистаминовые рецепторы.
Н1-антигистаминные средства. Давно открытые вещества этой группы (I поколения) неспецифичны и блокируют другие рецепторы (М-холинорецепторы). Эти средства используют для устранения симптомов аллергии (бамипин, клемастин, диметинден, мебгидролин, фенирамин), в качестве противорвотных (меклизин, дименгидринат) и как седативные снотворные, отпускаемые без рецепта врача.
Прометазин олицетворяет собой переход к психофармакологическим средствам типа нейролептиков из группы фенотиазинов.
Большинство Н1-антигистаминных препаратов вызывает сонливость (ослабляя реакцию при управлении автомобилем) и атропиноподобные реакции (сухость во рту, запор). Более новые вещества (Н1-антигистаминные препараты II поколения) не проникают в ЦНС и поэтому практически не оказывают седативного действия. Предположительно, они переносятся обратно в кровь с помощью Р-гликопротеида находящегося в эндотелии ГЭБ.
Более того, они практически не обладают какой-либо антихолинергической активностью. В эту группу входят цетиризин (рацемат) и его активный энантиомер левоцетиризин, а также лоратадин и его активный метаболит дезлоратадин. Фексофенадин — активный метаболит терфенадина, чрезмерная концентрация в крови которого достигается при слишком медленной биотрансформации (посредством CYP3A4), что может приводить к сердечным аритмиям (удлинение интервала ОТ). Также к этой группе препаратов относятся эбастин и мизоластин.
Н2-блокаторы (циметидин, ранитидин, фамотидин, низатидин) угнетают секрецию кислоты желудочного сока и поэтому подходят для лечения пептических язв. Применение циметидина может сопровождаться межлекарственными взаимодействиями, т. к. он ингибирует печеночную цитохромоксидазу. У последующих поколений (ранитидин) эти побочные эффекты практически отсутствуют.
д) Стабилизаторы тучных клеток. Кромогликат (кромолин) и недокромил уменьшают (по пока еще неизвестному механизму) способность тучных клеток высвобождать гистамин и другие медиаторы в ходе аллергических реакций. Оба препарата применяются местно.
– Также рекомендуем “Механизм действия серотонина и его эффекты”
Оглавление темы “Фармакология лекарств”:
- Парасимпатомиметики – холиномиметики и блокаторы ацетилхолинэстеразы
- Парасимпатолитики – холиноблокаторы и их эффекты
- Механизм действия дофамина и его эффекты
- Механизм действия гистамина и его эффекты
- Механизм действия серотонина и его эффекты
- Механизм действия нейрокинина (вещества Р) и его эффекты
- Механизм действия глутамата, ГАМК и их эффекты
- Лекарства для расширения сосудов
- Механизм действия нитратов и их эффекты
- Механизм действия антагонистов кальция и их эффекты
Источник
Роль биологически-активных веществ в патогенезе воспалительного процесса.Тенденция воспалительного процесса, выраженность компенсаторно-приспособительных реакций в значительной степени определяются концентрацией биологически-активных веществ, выделяемых клетками в очаге воспаления и образующихся в значительном количестве в процессе превращений компонентов плазмы. Ключевую роль при этом играют продукты активированных полиморфно-ядерных лейкоцитов, фактор активации тромбоцитов, лейкотриены (С4, В4, Е4), а также вещества плазменного происхождения (продукты активирования калликреин-кининовой системы, компоненты комплемента)” и выделяемые тучными клетками гистамин и серотонин. Существенную роль в патогенезе воспаления играет гистамин, который выделяется тканями при действии на них патогенных факторов, инициирующих воспалительный процесс. Наибольшее количество гистамина обнаружено в тучных клетках и базофильных лейкоцитах, где он содержится в гранулах. В ходе воспалительной реакции активируются процессы высвобождения гистамина из гранул при параллельном увеличении его синтеза. Воздействуя на H1 и Н2-гистаминовые рецепторы, гистамин способен вызвать различные биологические эффекты. Связывание H1 гистаминовых рецепторов с гистамином сопровождается внутриклеточным увеличением концентрации цГМФ. Интенсивность данного процесса в значительной степени возрастает в присутствии ионов кальция. Следовательно, в ходе воспалительных реакций, сопровождаемых ростом кальция в цитозоле, создаются дополнительные условия для высвобождения избыточного количества гистамина.
Основные эффекты гистамина заключаются в сокращении гладких мышц, расширении микрососудов, влиянии на секреторные процессы железистой ткани. Воздействие гистамина на эндотелиальные клетки сопровождается деструктивными изменениями их цитоскелета, что приводит к увеличению проницаемости сосудистой стенки. Активированные гистамином эндотелиоциты обладают повышенной адгезивной способностью по отношению к полиморфноядерным лейкоцитам, что в значительной степени облегчает их миграцию в интерстициальное пространство при воспалении. Полагают, что гистамин оказывает существенное влияние на процессы регуляции кровотока в микроциркуляторном русле, как в обычных условиях, так и при течении воспалительного процесса. Увеличение концентрации этого вещества в очаге воспаления сопровождается расширением сосудов микроциркуляторного русла, что приводит к повышению объемной скорости локального кровотока в ткани и органе в целом. Блокирование гистаминовых рецепторов влечет за собой снижение активности и темпов развития воспалительного процесса. При значительной выраженности первичной и вторичной альтерации, приводящей к нарушениям функций клеточных мембран и сопровождаемой ростом содержания Са в цитозоле, создаются условия для избыточного высвобождения гистамина. Это приводит к увеличению микроциркуляторных расстройств в очаге воспаления, усилению процессов экстравазации жидкости, нарастанию венозного полнокровия ткани, нарушениям метаболических процессов за счет недостаточного поступления кислорода к клеткам, находящимся в зоне очага воспаления. Перечисленные изменения представляют собой патогенетическую цепь перерастания компенсаторно-приспособительных реакций экссудативной стадии воспаления в преимущественно патологические. Характеризуя биологические эффекты гистамина, необходимо отметить, что значительная часть их при воспалении связана с воздействием на гистаминовые рецепторы клеточных мембран лейкоцитов, лимфоцитов и тучных клеток. Увеличение концентрации гистамина в очаге воспаления сопровождается его связыванием с Н2 гистаминовыми рецепторами тканевых базофилов, в результате чего тормозятся процессы дальнейшей дегрануляции гистаминсодержащих клеток. Ингибирование высвобождения гистамина опосредуется через систему цАМФ тканевых базофилов. Таким образом, рост концентрации гистамина в очаге воспаления с одной стороны приводит к увеличению микроциркуляторных расстройств, а с другой стороны, по принципу обратной связи, блокирует процесс его дальнейшего высвобождения. В ходе одновременного взаимодействия гистамина с H1 и Н2-гистаминовыми рецепторами создаются условия для оптимального регулирования сосудистых реакций в очаге воспаления, снижения степени выраженности патологической направленности воспалительного процесса. Связывание гистамина с Н2-гистаминовыми рецепторами лимфоцитов приводит к активированию синтеза цАМФ в их цитозоле и уменьшению темпов развития цитолитических процессов. Воздействуя на Н2-гистаминовые рецепторы, гистамин приводит к ингибированию основных звеньев анафилактической реакции. – Также рекомендуем “Серотонин, большой эозинофильный белок в очаге воспаления.” Оглавление темы “Ключевые механизмы воспаления легких.”: |
Источник
В случае воспаления метаболизм тканей имеет как количественные, так и качественные особенности.
Количественные особенности обмена веществ при воспалении
Количественные особенности особенно заметны в начале воспаления – это усиление обмена веществ, которое Саде назвал «метаболическим огнем». В этот период сильно усиливаются процессы гидролиза (гликолиз, протеолиз, липолиз) и окислительные процессы (из-за артериальной гиперемии). В воспаленных тканях увеличивается утилизация кислорода.
По мере прогрессирования нарушений периферического кровообращения (венозная гиперемия, застой) интенсивность окислительных процессов снижается, и в воспалительных тканях начинают проявляться качественные изменения обмена веществ.особенности – процессы окисления не проходят полностью, не заканчиваются выделением СО2. Процессы гидролиза преобладают над процессами окисления.
Основные причины этих метаболических нарушений – повреждение митохондрий – цикл Кребса, биологическое окисление и связанные с ним нарушения окислительного фосфорилирования – и лизосомное повреждение (лизосомы выделяют около 40 гидролитических ферментов).
Схема цикла Кребса
Также вызывают метаболические нарушения остатки бактерий и ферменты. Например, многие бактерии продуцируют гиалуронидазу, которая деполимеризует гиалуроновую кислоту, разжижает соединительную ткань и увеличивает проницаемость сосудов. Коллагеназа приводит к разрушению волокон соединительной ткани. Стрептококковая дезоксирибонуклеаза и рибонуклеаза расщепляют нуклеиновые кислоты и активируют протеолитические ферменты.
Из-за венозной гиперемии, застоя и повреждения митохондрий в тканях остается мало кислорода. В отсутствие кислорода активность ферментов цикла Кребса снижается, и во время этого цикла (особенно в центре воспалительных очагов) образуется недостаточно CO2, но промежуточные продукты метаболизма (пировиноградная кислота, α-кетоглутаровая кислота, яблочная кислота, янтарная кислота) накапливаются из пировиноградной кислоты.
Если в присутствии монойодацетата ферменты гликолиза подавлены, воспаление слабое. Белковый обмен усиливают протеолитические процессы. Они активируются при повреждении лизосом и ядер нейтрофилов крови, макрофагов и воспаленных паренхиматозных клеток, а также дезоксирибонуклеазами и рибонуклеазами. Усиленный протеолиз приводит к пролиферации нуклеотидов, полипептидов и аминокислот.
В воспалительных условиях, когда в тканях не хватает кислорода, дезаминирование (нормальный путь окисления аминокислот) снижается, а декарбоксилирование усиливается. В этих условиях, а также в результате дегрануляции тучных клеток в тканях накапливается гистамин.
Для жирового обмена характерно усиление липолиза. В результате увеличивается количество жирных кислот и продуктов их переваривания. Поскольку интенсивность цикла Кребса уменьшается, молекулы ацетил-СоА начинают конденсироваться и взаимодействуют друг с другом с образованием ацетилуксусный-КоА, который, в свою очередь, дает кетон вещество уксусной кислоты (5-оксимасляной кислоты и ацетона).
Из – за высокого потребления O2 (особенно в артериальной гиперемии), но количество выделяемого СО2 намного меньше, тогда частота дыхания также уменьшается.
Описанные процессы диссимиляции (катаболизма) преобладают в остром периоде воспаления. В это время некоторые продукты патологически измененного обмена веществ (медиаторы воспаления) сами влияют на развитие процесса.
В более поздний период воспаления, когда тенденции к восстановлению тканей уже проявляются, на первый план выходят процессы синтеза, а именно анаболические – увеличивается синтез ДНК и РНК. Эти процессы особенно активны в гистиоцитах и фибробластах.
В этих клетках возрастает активность окислительно-восстановительных ферментов, активно происходит биологическое окисление и окислительное фосфорилирование. В результате увеличивается образование макроэргических соединений и обеспечивается повышенная функциональная активность гистиоцитов и фибробластов.
Биологически активные вещества
Биологически активные вещества играют очень важную роль в патогенезе воспаления, поэтому кратко опишем основные из них.
Гистамин образуется декарбоксилазой из гистидина. Много гистидина и гистамина находятся в коже, легких, симпатических нервных волокнах.
- Гистамин расщепляется метилтрансферазой. Этот фермент в изобилии присутствует в органах, на которые действует гистамин (легкие, кожа, желудочно-кишечный тракт).
- Второй путь расщепления гистамина – это окислительное дезаминирование гистамином (диаминоксидазой), которое обнаруживается в основном в кишечнике, печени и почках.
В клетках (лейкоцитах, тромбоцитах, тучных клетках и эндотелиальных клетках) гистамин присутствует в больших количествах в связанной форме. В тучных клетках всегда с гепарином.
Гистамин является биологически очень активным веществом. Понижает тонус прекапиллярных сфинктеров, расширяет сосуды в зоне микроциркуляции, сужает крупные сосуды. В то же время гистамин сокращает сократительные вещества эндотелиальных клеток и увеличивает поры между этими клетками. Таким образом, гистамин увеличивает проницаемость стенки кровеносных сосудов, и белковые жидкости могут выходить в интерстициальное пространство (IST). Больше всего увеличивается проницаемость стенки мелких вен. Гистамин также вызывает сокращение гладких мышц.
Серотонин (5-окситриптамин) образуется из триптофана специфической гидроксилазой. Серотонин расщепляется неспецифической моноаминоксидазой. Образуется индоксиуксусная кислота, которая способствует пролиферации клеток. Серотонин содержится в тучных клетках и тромбоцитах (из которых гистамин высвобождается в процессе свертывания крови).
Как и адреналин, серотонин повышает кровяное давление, но мало влияет на периферическое сопротивление. В отличие от адреналина серотонин вызывает бронхоспазм. В тканях серотонин выделяется алкалоидом резерпином. Серотонин также увеличивает проницаемость сосудов, но он делает отек в 200 раз более активным, чем гистамин.
Гранулы тучных клеток содержат гистамин, гепарин и серотонин. Гистамин и гепарин связаны с ферментом химазой. Кроме того, гепарин является ингибитором этого фермента и защищает гранулы от автолиза. Гистамин относительно слабо связан в этом комплексе и может высвобождаться так называемыми освободителями гистамина, веществами, которые более тесно связаны с гепарином, чем гистамином (натрий, кальций, водород и другие ионы). Следовательно, в условиях гипоксии и ацидоза количество гистамина увеличивается и его действие становится более выраженным.
Дегрануляция тучных клеток может быть вызвана воздействием тепла, ультрафиолетового и ионизирующего излучения, солевых растворов, кислот, катионных белков, синтетических полимеров и мономеров, поверхностно-активных веществ.
Дегрануляция тучных клеток
Дегрануляция всегда происходит за счет взаимодействия антигена и антител. Выброшенные гранулы фагоцитируются макрофагами или растворяются в межслитковой жидкости, а вазоактивные вещества переносятся лимфой или кровотоком в организм. Гистамин и серотонин расширяют кровеносные сосуды и увеличивают проницаемость их стенок, в то время как гепарин увеличивает проницаемость капилляров, препятствуя образованию фибрина.
Гипотензивные полипептиды – хинины
Хининовая система или так называемые гипотензивные полипептиды также называют местными (тканевыми) гормонами, потому что они не вырабатываются эндокринными железами и действуют в основном локально. Хинины обнаружены в крови, лимфе, моче, поджелудочной железе, слюнных железах, головном мозге, тонком кишечнике и т. д. Два хинина: калидин и брадикинин были изучены на людях.
Хинины в плазме крови и тканях образуются из неактивных α2-глобулинов (кининогенов) ферментом каликреином. Каликреины тканей (калидиногеназы) и каликреины плазмы (брадикининогеназы) происходят из прекалликреинов. Их переход в каликреины облегчается реакциями антиген-антитело, температурами выше 45 ° C, кислыми изменениями pH, лизосомальными ферментами, катепсинами, трипсином, фактором свертывания XII (фактор Хагемана), фибринолизином (плазмин).
Хининогены сначала образуют калидин. После расщепления аминопептидазы образуется брадикинин. Брадикинин – сильнейшее сосудорасширяющее средство, увеличивающее проницаемость капилляров в 10-15 раз сильнее, чем гистамин. Брадикинин стимулирует сокращение миокарда и, таким образом, увеличивает частоту сердечных сокращений, сердечный выброс и коронарное кровообращение, а также усиливает почечную клубочковую фильтрацию и выведение ионов натрия и калия.
Хинины расслабляют гладкие мышцы артериол и венозных стенок, тем самым расширяя эти кровеносные сосуды и снижая скорость их кровотока. В то же время они значительно увеличивают проницаемость стенки сосуда и способствуют эмиграции лейкоцитов из кровеносных сосудов.
Как и другие медиаторы, хинины вызывают воспаление, различные типы шока, аллергические реакции, артрит, инфаркт миокарда, инсульт, острый панкреатит и другие заболевания. Действуя на местном уровне,
Хинины вместе с системами тромбина и плазмина (фибринолизина) образуют так называемую систему факторов Хагемана, которая активируется при повреждении тканей. Свертывание крови и фибринолиз являются результатом системы факторов Хагемана.
Тромбоксан А2 и тромбоксан В2
Тромбоксан А2 и тромбоксан В2 – высоко биологически активные вещества. Тромбоксан А2 был выделен из тромбоцитов с очень короткой продолжительностью действия (период полураспада 32 с). Это вещество активно участвует в удалении медиаторов из тромбоцитов и других клеток, а также в агрегации тромбоцитов.
Система комплемента
Система комплемента состоит из 9 различных белков, обозначенных Ci, C2 и т. д. Она активируется комплексом антиген-антитело, а также эндотоксинами, и образуются продукты, которые активно участвуют в патогенезе воспаления. Наиболее активные компоненты системы комплемента – C3a (анафилатоксин I), C5a (анафилатоксин II) и C5,6, C3a – гемотаксический фактор, который увеличивает проницаемость сосудистой стенки и способствует дегрануляции тучных клеток. У Csa такое же и даже более сильное действие.
Также присутствуют в тканях ингибиторы C3a и Csa. Если дефицит этих ингибиторов передается по наследству или приобретается, активность системы комплемента может значительно возрасти, и воспалительный процесс может стать тяжелым. Было показано, что ингибиторы комплемента подавляют эмиграцию лейкоцитов.
Система комплемента также участвует в фагоцитозе и высвобождении лизосомальных ферментов и в конечном итоге вызывает иммунологический лизис клеток – смерть. Система комплемента вместе с ионами магния является частью системы пропердина, вызывающей микробный лизис в крови.
Таким образом, в случае воспаления активируются тесно связанные системы хинина, комплемента, свертывания крови, фибринолиза и другие.
Простагландины
Простагландины (PG) были обнаружены примерно в 1930 году в семенниках и сперме различных животных. Первоначально считалось, что эти биологически активные вещества происходят из простаты, поэтому их назвали простагландинами.
Теперь известно, что они являются высокоактивными фосфолипидами, образованными в клеточных мембранах из арахидоновой кислоты под действием простагландинсинтетазы. Ферменты циклооксигеназа и липоксигеназа зависят от образования PG или лейкотриенов из арахидоновой кислоты. PG присутствует во всех органах.
Простагландины
Различают несколько типов простагландинов (Ei, E2, F, I, D, A, G). У людей было обнаружено 13 простагландинов, наиболее активными из которых являются простагландины E, F и G. Действие PGE и PGF часто противоположно.
Простагландины контролируют диффузию веществ через клеточную мембрану (часть простагландина активирует аденилатциклазу и увеличивает количество цАМФ), а также регулируют активность гладких мышц и процессы секреции.
Простагландины действуют в основном локально, потому что ферментные системы мешают их общей функции. Общая эффективность наблюдается, если деградация PG ингибируется или накоплено слишком много PG. Простагландины обладают моделирующим действием – они стимулируют слабые и подавляют избыточные функции.
При воспалении особенно повышены уровни PGE2, PGE и PGI2. Эти простагландины сильно способствуют расширению сосудов, а также увеличивают проницаемость сосудистой стенки и лизосомальной мембраны, тем самым способствуя воспалению. Эти простагландины также стимулируют синтез ДНК и пролиферацию тканевых лимфоцитов. Лимфоток стимулируется в меньшей степени. С другой стороны, также наблюдалась защитная противоязвенная активность клеток простагландинов (PGE2).
Медиаторы воспаления
Помимо простагландинов, липоксигеназа арахидоновой кислоты также продуцирует лейкотриены, такие как медленно действующее вещество анафилаксии (медиатор аллергического воспаления). В случае аллергического воспаления из тканей выделяется вещество Р (проницаемость), которое увеличивает проницаемость стенки сосуда.
Медиаторы воспаления
Система адениловой кислоты содержит производные аденина (аденозин, AMF, ADF), и их количество в воспаленных тканях значительно увеличено. Эти вещества способствуют лейкоцитозу, эмиграции лейкоцитов и фагоцитозу, а также, среди прочего, увеличивают проницаемость сосудистой стенки.
Фермент клеточной мембраны аденилилциклаза катализирует переход АТФ в аденозин-3′-5 ‘- (циклический) монофосфат (цАМФ) и пирофосфат. Обычно клетки и биологические жидкости содержат очень мало cAMF. Он участвует в гуморальной регуляции – это промежуточный член между гуморальным рецептором клетки и внутриклеточными процессами.
В случае повреждения клетки увеличивается активность аденилциклазы и снижается ресинтез АТФ, поэтому количество цАМФ в поврежденной клетке увеличивается и стимулируются процессы регенерации. Печень играет ключевую роль в эвакуации и гидролизе цАМФ из плазмы крови. При заболевании печени эти функции снижены.
АМФ подавляет дегрануляцию лизосом и высвобождение лизосомальных медиаторов, тем самым подавляя дальнейшее развитие воспаления. Адреналин и норадреналин оказывают ингибирующее действие на воспаление через цАМФ.
К эндогенным медиаторам воспаления также относятся лизосомальные компоненты (катионные белки, кислотные и нейтральные протеазы) и продукты активности лимфоцитов – фактор, препятствующий миграции лейкоцитов, гемотаксический фактор, митогенный фактор и т. д. Большинство лизосомальных медиаторов высвобождаются из нейтрофилов и макрофагов.
В зависимости от места их образования, воспалительные посредники делятся на две группы:
- медиаторы, образующиеся в клетках;
- «плавающие» медиаторы, образованные в жидкостях организма, главным образом, в крови.
В первую группу входят вазоактивные амины (гистамин, серотонин), лизосомальные ферменты, катионные белки и др. Гистамин и серотонин присутствуют в клеточных гранулах, поэтому в случае повреждения клеток (тучных клеток, базофилов, тромбоцитов) они появляются первыми (в течение нескольких минут) в месте воспаления.
Однако запас вазоактивных аминов быстро истощается, поскольку эти вещества расщепляются, и вазоактивные амины исчезают из очага воспаления. Поэтому вазоактивные амины называют медиаторами короткого действия. Позже, когда активируется система калихреин-хинин, образуются калидин и брадикинин, а еще позже – простагландины. Они являются медиаторами пролонгированного действия и требуют образования ферментных систем.
Ко второй группе («плавающих») медиаторов относятся фактор Хагемана, система комплемента и тромбоксана, фибринопептиды и др.
Помимо медиаторов воспаления, вызывающих воспалительные реакции, различают и модуляторы воспаления (повреждения). Они не вызывают напрямую воспалительных реакций, но способны усиливать или уменьшать их. Такие эффекты проявляются, например, в системах простагландинов, тромбоксана и адениловой кислоты.
Продолжение статьи
- Часть 1. Этиология и патогенез воспаления. Классификация.
- Часть 2. Особенности обмена веществ при воспалении.
- Часть 3. Физико – химические изменения. Роль нервной и эндокринной систем в развитии воспаления.
- Часть 4. Изменения в периферическом кровообращении при воспалении.
- Часть 5. Экссудация. Экссудат и транссудат.
- Часть 6. Эмиграция лейкоцитов. Хемотаксис.
- Часть 7. Фагоцитоз. Асептическое и острое воспаление.
- Часть 8. Распространение. Последствия. Принципы лечения воспаления.
Поделиться ссылкой:
Источник
