Экспериментальная модель хронического воспаления
РЕФЕРАТ
На тему: «Экспериментальное моделирование воспаления.»
Выполнили студентки 3 курса
лечебного факультета 7-8 группы
Якимова Анастасия Анатольевна и Кравчук Дарья Александровна
Проверила: Маслова М.В.
г.Рязань, 2016
План:
Цель работы
Задачи работы
Введение
1.Экспериментальные модели воспаления
2. Экспериментальное моделирование периодонтита у
животных
Заключение
Библиографический список
Введение
Воспаление есть патологический процесс, который возникает при повреждении тканей и проявляется нарушением кровообращения, изменением крови и соединительной ткани в виде альтерации, экссудации и пролиферации. В этот, по преимуществу местный процесс, в той или иной степени вовлекается весь организм и прежде всего такие системы как иммунная, эндокринная и нервная. Внешние признаки воспаления известны очень давно. Они сформулированы в знаменитой пентаде Цельса — Галена. Это припухлость (tumor), краснота (rubor), жар (calor), боль (dolor) и нарушение функции (functio laesa). Хотя эти симптомы известны уже более 2000 лет, они не утратили своего значения и сегодня; со временем менялось только их объяснение.
Воспаление является важной проблемой и предметом изучения всех отраслей медицины. Отличие заключается лишь в методах исследования. Например, врач- терапевт наблюдает течение воспаления легких (пневмонии) у постели больного, патологоанатом — при вскрытии трупа, а патофизиолог — в эксперименте на животном. Ученик Вирхова Конгейм (1867 г.) впервые изучил в эксперименте на лягушке кровообращение в брыжейке при воспалении, установив при этом все стадии его от гиперемии до стаза. Конгейм также описал процесс эмиграции лейкоцитов через сосудистую стенку. Экспериментальная модель его широко используется ив настоящее время на практических занятиях со студентами (опыт Конгейма) и в научных исследованиях. В 1920 г. Е. Л. Кларк и Е. Р. Кларк применили следующую методику. На двух противоположных участках кожи уха кролика удалили эпидермис и на его место вставили диски из слюды. Между дисками находился тонкий слой ткани. В таком прозрачном окошке можно было непрерывно наблюдать кровообращение, в том числе и при действии флогогенных (воспалительных) агентов. По этой же методике изучают кровообращение в мозговых оболочках. Позже Селье предложил изучать кровообращение в сосудах защечных мешков хомяка. Раздувая мешки воздухом, можно изучать микроциркуляцию крови в них с помощью микроскопа. Данная методика позволяет изучать этот процесс и в динамике. Сегодня для этого сконструированы совершенные икрокинематографические приспособления.
Важнейшим этапом в изучении воспаления было применение биохимических методик. Одним из первых исследователей, применивших эти методики, был Менкин (1948). В настоящее время выделены многие биологически активные вещества-медиаторы воспаления и детально изучено их действие. С помощью электронной микроскопии, ультрацентрифугирования и других методов получены сведения о биологических мембранах, способствующие раскрытию механизма воспалительного отека, прохождения лейкоцитов через сосудистую стенку, скопления их в очаге воспаления и т. д. Эксперимент важен еще и тем, что с его помощью были детально изучены и внедрены в клинику многие противовоспалительные средства. В изучении воспаления особую роль сыграли эксперименты И. И. Мечникова. Особенность его исследований заключалась в том, что воспаление он рассматривал с эволюционных позиций. И. И. Мечников был первым, кто изучил воспаление в филогенезе, т. е. у животных, стоящих на различных ступенях эволюционного развития. На прозрачной личинке морской звезды, представителе беспозвоночных, он открыл явление фагоцитоза и отвел ему основную роль в динамике воспаления. На основании этих наблюдений была построена теория воспаления, которая вошла в науку под названием сравнительно-патологической или эволюционной. В дальнейшем патологи стали широко использовать эволюционный принцип в экспериментальном моделировании, исходя из того, что патологические явления у низших животных, «представляя условия наиболее простые и первобытные, дают ключ к пониманию сложных патологических явлений, входящих в область медицины» (И. И. Мечников, 1892).
Цель работы: изучить особенности экспериментального моделирования воспаления
Задачи:
1.Моделирование воспаления, исследование этого процесса в динамике (от начала до конца);
2.Разработка принципов экспериментальной терапии с дальнейшим использованием данных эксперимента в клинике.
Экспериментальное моделирование воспаления. История.
Воспаление является важной проблемой и предметом изучения всех отраслей медицины. Отличие заключается лишь в методах исследования. Например, врач-терапевт наблюдает течение воспаления легких (пневмонии) у постели больного, патологоанатом — при вскрытии трупа, а патофизиолог — в эксперименте на животном.
Ученик Вирхова Конгейм (1867 г.) впервые изучил в эксперименте на лягушке кровообращение в брыжейке при воспалении, установив при этом все стадии его от гиперемии до стаза. Конгейм также описал процесс эмиграции лейкоцитов через сосудистую стенку. Экспериментальная модель его широко используется и в настоящее время на практических занятиях со студентами (опыт Конгейма) и в научных исследованиях.
В 1920 г. Е. Л. Кларк и Е. Р. Кларк применили следующую методику. На двух противоположных участках кожи уха кролика удалили эпидермис и на его место вставили диски из слюды. Между дисками находился тонкий слой ткани. В таком прозрачном окошке можно было непрерывно наблюдать кровообращение, в том числе и при действии флогогенных (воспалительных) агентов. По этой же методике изучают кровообращение в мозговых оболочках.
Позже Селье предложил изучать кровообращение в сосудах защечных мешков хомяка. Раздувая мешки воздухом, можно изучать микроциркуляцию крови в них с помощью микроскопа. Данная методика позволяет изучать этот процесс и в динамике. Сегодня для этого сконструированы совершенные микрокинематографические приспособления.
Важнейшим этапом в изучении воспаления было применение биохимических методик. Одним из первых исследователей, применивших эти методики, был Менкин (1948). В настоящее время выделены многие биологически активные вещества-медиаторы воспаления и детально изучено их действие.
С помощью электронной микроскопии, ультрацентрифугирования и других методов получены сведения о биологических мембранах, способствующие раскрытию механизма воспалительного отека, прохождения лейкоцитов через сосудистую стенку, скопления их в очаге воспаления и т. д.
Эксперимент важен еще и тем, что с его помощью были детально изучены и внедрены в клинику многие противовоспалительные средства.
В изучении воспаления особую роль сыграли эксперименты И. И. Мечникова. Особенность его исследований заключалась в том, что воспаление он рассматривал с эволюционных позиций. И. И. Мечников был первым, кто изучил воспаление в филогенезе, т. е. у животных, стоящих на различных ступенях эволюционного развития. На прозрачной личинке морской звезды, представителе беспозвоночных, он открыл явление фагоцитоза и отвел ему основную роль в динамике воспаления. На основании этих наблюдений была построена теория воспаления, которая вошла в науку под названием сравнительно-патологической или эволюционной. В дальнейшем патологи стали широко использовать эволюционный принцип в экспериментальном моделировании, исходя из того, что патологические явления у низших животных, «представляя условия наиболее простые и первобытные, дают ключ к пониманию сложных патологических явлений, входящих в область медицины» (И. И. Мечников, 1892).
ЭТИОЛОГИЯ
Любой повреждающий агент, который по силе и длительности превосходит адаптационные возможности ткани, может вызвать воспаление. Все флогогенные факторы принято делить на внешние и внутренние (эндогенные). К внешним относятся микроорганизмы (бактерии, вирусы, грибы); животные организмы (простейшие, черви, насекомые); химические вещества (кислоты, щелочи); механические (инородное тело, давление, разрыв) и термические воздействия (холод, тепло); лучевая энергия (рентгеновские, радиоактивные, ультрафиолетовые лучи).
К эндогенным факторам относят те, которые возникают в самом организме в результате другого заболевания. Например, воспаление может возникнуть как реакция на опухоль, желчные или мочевые камни, образовавшийся в сосудах тромб. Причиной воспаления могут стать комплексы антиген — антитело, если они фиксируются в каком-либо органе.
ПАТОГЕНЕЗ
Среди множества патогенетических факторов воспаления можно выделить несколько, которые имеют решающее значение, определяют начало процесса, его развитие и исход: повреждение от действия флогогенного агента (первичная альтерация); выброс из клеток биологически активных веществ — медиаторов воспаления; освобождение и активация лизосомальных ферментов, действие ^х на биологические макромолекулы (вторичная альтерация); нарушение микроциркуляции, повышение проницаемости стенки сосудов, экссудация; размножение клеток (пролиферация), восстановление дефекта.
Воспаление всегда начинается с повреждения ткани(первичная альтерация). После воздействия этиологического фактора клетки претерпевают ряд структурных и метаболических изменений. Отмечено набухание митохондрий, просветление их матрикса, дезоргани
зация крист, изменение мембраны эндоплазматической сети, уменьшение числа рибосом, появление в цитоплазме различных включений. В поврежденной ткани повышается осмотическое давление, возникает ацидоз, увеличивается содержание воды. Альтерация касается не только тканевых элементов, но и крови; изменяются ее реологические свойства.
Вслед за первичной наступаетвторичная альтерация. Если первичная альтерация является результатом непосредственного действия воспалительного агента, то вторичная не зависит от этого. Причина состоит в том, что повреждение клеток касается прежде всего их цитолеммы, а также мембраны лизосом. При повреждении лизосом освобождаются заключенные в них ферменты (кислые гидролазы), способные расщеплять все вещества, входящие в состав клетки (белки, нуклеиновые кислоты, углеводы, липиды). Далее эти ферменты, при наличии этиологического фактора или уже без него, продолжают процесс альтерации, а также деструкции, в результате чего образуются биологически активные вещества— медиаторы воспаления.По этой причине лизосомы называют еще «стартовой площадкой» воспаления.
В последнее время изучено свыше 10 биологически активных веществ, участвующих в воспалительной реакции. Их можно разделить на две группы: медиаторы, образующиеся в клетках (клеточные), и медиаторы, образующиеся в жидких средах организма
Рекомендуемые страницы:
Воспользуйтесь поиском по сайту:
Источник
1. Кутина С.Н., Маянский Д.Н. Особенности развития цирроза печени у крыс при стимуляции печеночных макрофагов // Бюл. экспер. биол. 1981. N9. С.366-369.
2. Лебедева А.И. Структурно-функциональная характеристика макрофагов, выявленных при имплантации биоматериалов (экспериментально-морфологическое исследование) Автореф. дис. … канд. биол. наук. Уфа. 2004. 23 с.
3. Маянский Д.Н. Роль макрофагов в репаративных процессах. В кн.: Механизмы патологических реакций. Томск. 1991. С. 56-62. (а).
4. Мусина Л.А. Функциональная морфология макрофагов при регенерации тканей, индуцированной аллогенными бооматериалами. Автореф. дис. … док. биол. Наук. Саранск. 2007. 49 с.
5. Муслимов С. А. Морфологические аспекты регенеративной хирургии. Уфа.: Башкортостан. 2000. 168 с.
6. Ройт А., Бростофф Дж., Мейл Д. Иммунология. М.: Мир. 2000. С. 464-489.
7. Серов В.В., Пауков В.С. Воспаление. Руководство для врачей. М.: Медицина. 1995. 640 с
8. Уикли Б. Электронная микроскопия для начинающих. Пер. с англ. М.: Мир. 1975. 324 с.
9. Шехтер А.Б., Серов В.В. Воспаление, адаптивная регенерация и дисрегенерация (анализ межклеточных взаимодействий) // Арх. Патолог. 1991. С. 7-14.
10. Шехтер А.Б., Розанова И.Б. Тканевая реакция на имплантат. В кн.: Биосовместимость. Под ред. В.И.Севастьянова. М. 1999. С. 174-211.
11. Bogdan C., Nathan C. Modulation of macrophage function by transforming growth factor beta, interleukin-4, and interleukin-10 // Ann. N.Y. Acad. Sci. Vol. 685. Р. 1993713-1993739.
12. Cucoranu I., Clempus R., Dikalova A., Phelan P.J., Ariyan S., Dikalov S., Sorescu D. NAD(P)H oxidase 4 mediates transforming growth factor-beta1-induced differentiation of cardiac fibroblasts into myofibroblasts // Circ Res. 2005. Vol. 97. N9. Р. 900-907.
13. Derwin K.A, Baker A.R, Spragg R.K, Leigh D.R, Iannotti J.P. Commercial extracellular matrix scaffolds for rotator cuff tendon repair. Biomechanical, biochemical, and cellular properties // J Bone Joint Surg Am. 2006. Vol. 88. N 12. Р. 2665-2672.
14. Desmouliere A., Chaponnier C., Gabbiani G. Tissue repair, contraction, and the myofibroblast // Wound Repair Regen. 2005. Vol. 13. N1. Р. 7-12.
15. Eyden B. Electron microscopy in the study of myofibroblastic lesions // Semin Diagn Pathol. 2003. Vol. 20. N1. Р.13-24.
16. Keophiphath M., Achard V., Henegar C., Rouault C., Cl?ment K., Lacasa D. Macrophage-secreted factors promote a profibrotic phenotype in human preadipocytes // Mol Endocrinol. 2009. Vol. 23. N1. Р. 11-24.
17. Mackiewicz Z., Rimkevicius A., Petersen J., Andersen C.B., Dudek E., Vytrasova M., Konttinen Y.T. Macrophages overloaded with tissue debris in Wegener’s granulomatosis // Ann Rheum Dis. 2005. Vol. 64. N8. P.1229-1232.
18. Muldashev E.R., Muslimov S.A., Nigmatullin R.T. et al. Basic research conducted on alloplant biomaterials // Eur. J. Ophthalmol. 1999. Vol. 9. N1. Р. 8-13.
19. Sobiczwska E., Szmigielski S. The role of selected growth factors in the wound healing process // Przegl. Lek., 1997. Vol. 54. N 9. Р. 634-638.
20. Sutherland J., Denyer M., Britland S. Motogenic substrata and chemokinetic growth factors for human skin cells // J. Anat., 2005. Vol. 207. N1. Р. 67-78.
21. Toshiyuki Yamamoto Autoimmune mechanisms of scleroderma and a role of oxidative stress // Self Nonself. 2011. Vol. 2. N1. Р. 4-10.
22. Valenzuela N.M., Reed E.F. The link between major histocompatibility complex antibodies and cell proliferation // Transplant Rev (Orlando). 2011. 29 р.
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Живцов О.П.
1
Митрофанов В.Н.
1
Бургов С.Н.
1
Гординская Н.А.
1
1 ФГБУ «Приволжский федеральный медицинский исследовательский центр»
Работа направлена решение актуального вопроса науки: экспериментального моделирования гнойно-воспалительного процесса костных структур с наличием дефекта ткани. Кролику формировали стандартизованный дефект большеберцовой кости размерами 8,0х4,0 мм и глубиной 4,0 мм. Хронизацию воспалительного процесса обеспечивали инфицированием и трёхкратным реинфицированием раны. Для идентификации костного дефекта использовали рентгенографию и компьютерную томографию с трёхмерной реконструкцией сегмента, что подтвердило наличие костной полости. После выведения из эксперимента провели гистоморфологический анализ образцов тканей дефекта, по результатам которого выявили признаки хронического остеомиелитического процесса. Предложенная экспериментальная модель позволяет на ее основе оценивать различные методики санации гнойного очага, хирургического лечения остеомиелитического процесса, эффективности использования остеопластических материалов.
экспериментальная модель
хронический остеомиелит
гнойно-воспалительный процесс
1. Галкин Р.А., Махова А.Н., Сидоров А.Ю. Репаративная регенерация при экспериментальном остеомиелите // Паллиативная медицина и реабилитация. 2004. №2. C.112.
2. Данилов Р.К., Боровая Т.Г., Клочков Н.Д. Экспериментально-морфологический анализ гистогенеза и регенерации тканей (некоторые итоги XX в. и перспективы дальнейших исследований) // Морфология. 2000. Т.117. №4. С.7-16.
3. Матузов С.А., Бусоедов А.В., Котляров В.Н., Сизоненко В.А. Способ моделирования травматического остеомиелита // Патент России № 2129735.1999. Бюл. № 8.
4. Савельев С.Н., Стрелков Н.С., Шарпарь В.Д., Неганов О.А. Морфологическое обоснование возможности замещения дефектов костной ткани материалом “Литар” // Морфологические ведомости. 2007. Т.1, № 1-2. С.211-214.
5. Чернигова, С.В., Байзыханов С.К., Чернигов Ю.В. Оценка клинического статуса кроликов с острым травматическим остеомиелитом трубчатых костей в эксперименте // Вопросы нормативно-правового регулирования в ветеринарии. 2013. №3. С.131-132.
6. Шишацкая Е.И., Винник Ю.С., Маркелова Н.Н., Шагеев А.А., Камендов И.В., Старосветский С.И., Хоржевский В.А., Перьянова О.В., Шумилова А.А., Пахомова Р.А. Исследование остеопластических свойств резорбируемого поли-3-гидроксибутирата in vivo на моделях хронического остеомиелита // Врач-аспирант. 2013. Т.56, №1. С.127-132.
7. Decal bone matrix as a local antibiotic delivery vehicle in a MRSA-infected bone model: An experimental study / S.K.Saraf, A.Yadav, S.Nagwani, M.Sen // Indian J. Orthop. 2010. Vol.44, №3. P.246-251.
8. Efficacy of fosfomycin compared to vancomycin in treatment of implant-associated chronic methicillin-resistant Staphylococcus aureus osteomyelitis in rats / W.Poeppl, T.Lingscheid, D.Bernitzky, U.Y.Schwarze, O.Donath, T.Perkmann, N.Kozakowski, R.Plasenzotti, G.Reznicek, Burgmann H. // Antimicrob. Ag. Chemother. 2014. Vol.58, №9. P.5111-5116.
9. Gentamicin-loaded borate bioactive glass eradicates osteomyelitis due to Escherichia coli in a rabbit model / Z.Xie, X.Cui, C.Zhao, W.Huang, J.Wang, C.Zhang // Antimicrob. Ag. Chemother. 2013.Vol.57, №7. P.3293-3298.
Ключевым положением в проведении экспериментальных исследований с наличием очага хронического гнойного воспаления является выбор или создание адекватной, стандартизованной экспериментальной модели изучаемой патологии. В современной литературе представлены разнообразные экспериментальные модели хронического остеомиелита, преследующие решение разных задач: изучение эффективности применения местных и системных антибактериальных препаратов, способов иммобилизации, методик санации остеомиелитического очага и др. [3, 8].
Для исследования процессов регенерации костной ткани в условиях хронического гнойного воспаления с наличием дефекта используются самые разнообразные технологии создания экспериментального остеомиелитического очага, методики его хирургической санации и замещения. При разработке модели авторы руководствуются характеристиками исследуемого остеопластического препарата, особенностями нормальной анатомии выбранного экспериментального животного, опираясь на типичную морфологическую и микробиологическую картину заболевания. В подавляющем большинстве исследований животным прижизненно проводятся только рентгенологические исследования области оперативного вмешательства. После выведения из эксперимента, как правило, осуществляется качественный гистоморфологический анализ тканей дефекта [2, 4].
Проведение экспериментов на кроликах считается наиболее целесообразным по многим причинам: доступность этих животных, относительная простота обеспечения необходимых условий для содержания, проведения хирургического вмешательства и последующего наблюдения. Кроме этого, их анатомические особенности (крупные трубчатые кости) позволяют нанести необходимый по размеру дефект кости без использования специального инструментария и риска патологических переломов [1, 9].
Описаны разнообразные варианты инфицирующих микроорганизмов, их дозировок и кратности внесения для создания хронического гнойного воспаления. Опубликованы методики создания как одиночных, так и множественных дефектов костной ткани. Одной из наиболее удачных моделей хронического гнойного воспаления костной ткани является методика создания остеомиелитического очага, описанная в работе Матуссис З.Е. (1962). Точная дозировка инфицирующего агента и инородного тела (кварцевого песка) в этой модели не предусматривались. Другой недостаток модели – высокий риск патологического перелома трубчатой кости, а малые размеры дефекта исключают вможность выполнения эффективной хирургической санации. Гноеродный протей, использованный авторами, является не типичным представителем флоры остеомиелитического очага у людей [5, 7]. Для адекватного моделирования важно создание условий для формирования бактериальной биоплёнки и нанесение стандартизованного полостного дефекта [6].
Таким образом, возникает потребность в создании воспроизводимой, обеспечивающей чистоту эксперимента модели костной полости с хроническим гнойным воспалением.
Цель работы: создать стандартизованную экспериментальную модель хронической гнойной костной полости.
Материалы и методы
Эксперименты проводили на 10 кроликах породы «Серый великан» 6-8 месячного возраста весом от 1800 до 2400 г. в отделении экспериментальной хирургии с виварием ФГБУ «ПФМИЦ» Минздрава России в соответствии требованиями «Европейской конвенции о защите позвоночных животных, используемых для экспериментов или в иных научных целях» (Страсбург 18.05.2014г.), согласно приказу Минздравсоцразвития РФ №708н от 23.08.2010г. «Об утверждении правил лабораторной практики». Условия содержания животных в виварии обеспечивали чистоту эксперимента. Выведение животных из эксперимента осуществляли воздушной эмболией под наркозом через 37 суток после введения в эксперимент.
Для подготовки операционного поля удаляли ножницами волосяной покров в области оперативного вмешательства, дезинфицировали растворами антисептиков трехкратно, отгораживали стерильным бельём.
Доступ осуществляли по передней поверхности проксимальной метаэпифизарной области левой большеберцовой кости продольным разрезом с послойным рассечением кожи, подкожной клетчатки, фасции длинной 3,0 см. Острыми крючками разводили края раны. Распатором скелетировали большую берцовую кость на площади 2х1 см. Фрезой диаметром 4,0 мм вдоль оси кости формировали стандартизированный дефект надкостницы, кортикального слоя и губчатого вещества размерами 8,0х4,0 мм и глубиной 4,0 мм (рис. 1). Размеры дефекта контролировали при помощи штангенциркуля ШЦ – 1 с глубиномером и ценой деления 0,1 мм.
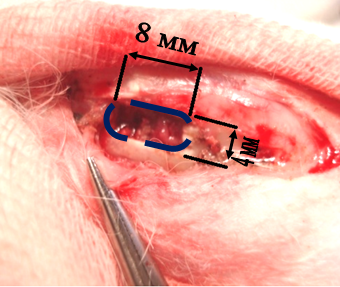
Рис. 1. Стандартизованный дефект большой берцовой кости
В качестве инфекционного возбудителя всем животным применили Staphylococcus Aureus, как наиболее часто выявляемого представителя раневой флоры у пациентов с хроническим остеомиелитом. Использовали музейный штамм Staphylococcus aureus коллекции ГИСК им. Л. А. Тарасевича.
Дефект инфицировали смесью суточной культуры стафилококка в стерильном физиологическом растворе в дозе 40 млн. колониеобразующих единиц (КОЕ) и 0,2 г стерильного кварцевого песка на 1 кг массы тела животного. Кварцевый песок выполнял роль «секвестров» с большой площадью поверхности, что способствовало формированию субстрата для развития хронического гнойного процесса. Завершали операцию ушиванием раны.
Через 72 часа после операции осуществляли пассивное дренирование очага, для чего снимали три шва в проксимальной части раны и разводили её края на протяжении 1 см. Это рассматривали как надежную профилактику генерализации процесса, что исключало риск летального исхода у животных. Одновременно с формированием свища, реинфицировали костную полость культурой Staphylococcus Aureus в дозе 20 млн. КОЕ на 1 кг массы тела кролика. Такие «подсевы» применяли трехкратно с интервалом в 72 часа. Оставшиеся швы кожной раны снимали через 10 суток после оперативного вмешательства. Трёхкратное реинфицирование обеспечило хронизацию гнойного воспалительного процесса (рис. 2).
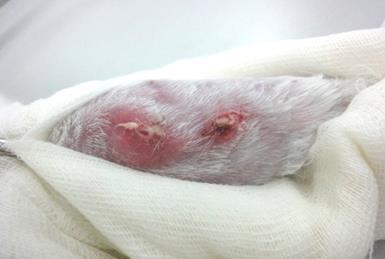
Рис. 2. Хроническая гнойная свищевая костно-мягкотканая рана голени (30 суток после операции).
Для идентификации наличия и топики костного дефекта использовался рентгенологический метод. Рентгенологическое обследование проводили всем животным трёхкратно: интраоперационно после ушивания раны, через 10 суток после формирования дефекта и непосредственно перед выведением. Рентгенографию в двух проекциях выполняли при помощи аппарата «Dira-RC» Компьютерную томографию проводили на аппарате «Toshiba 32 Aquillon», она включала оценку трёхмерной реконструкции сегмента. Визуализировали особенности формы и структуры костной ткани в области очага его точное расположение, конфигурацию.
Микробиологические исследования проводились в лаборатории бактериологии ФГБУ «ПФМИЦ» Минздрава России. Забор биосубстрата для бактериологического анализа выполняли через 14 суток после формирования костного дефекта и непосредственно перед выведением животного из эксперимента. Материалом для исследования служил соскоб со стенок свищевого хода. Идентификацию микроорганизмов производили классическим культуральным методом на анализаторе iEMS Reader FM (Labsystems, Финляндия) с помощью набора тест-систем (Lachema, Чехия).
Наряду с клинико-рентгенологическими и гистоморфологическими данными, подтверждающими формирование хронической гнойной костной полости у экспериментального животного, проводилась динамическая оценка основных показателей общих анализов крови у всех животных через 7, 14, 37 суток от первого внесения инфицирующей смеси в созданный дефект костной ткани.
Результаты:
После прекращения действия наркоза, экспериментальное животное не опиралось на оперированную конечность, поджимая её. Наблюдали гиперемию, локальное повышение температуры, флюктуацию, кролик отдёргивал лапу, что расценивалось как признак боли. Формирование свища приводило к исчезновению флюктуации, отмечали густое гнойное отделяемое в количестве 1-2 мл в сутки. Нарушения функции смежных суставов не определялось. Через 10 дней после оперативного вмешательства наблюдали полное восстановление опороспособности конечности. Гнойно-некротическая рана характеризовалась наличием свищевого хода, дном которого являлась костная ткань. Отмечалось образование участков некрозов мягких тканей и грануляций, легко кровоточащих при зондировании раны. Раневое отделяемое содержало песчинки. У всех животных при микробиологическом исследовании раневого отделяемое выявлена смешанная флора: Staphylococcus Aureus и Escherichia Coli.
Клиническими признаками хронического гнойного воспаления экспериментальной модели считали:
а) существование свищевой гнойной раны на всём протяжении эксперимента после оперативного вмешательства;
б) медленное, мозаичное выполнение раны вялыми, бледными, легко кровоточащими грануляциями;
в) наличие очагов влажного или сухого некроза мягких тканей (кожа, клетчатка, фасция, мышца).
Указанные признаки наблюдали у всех животных. Послеоперационная рентгенография у всех животных выявляла дефект костной ткани в метаэпифизарной области с рентгенологическим просветлением и чередующимися очагами затемнения (рисунок 3А). Участки затемнения обуславливались наличием инородних тел – кварцевого песка. Эти признаки сохранялись до выведения животных из эксперимента. По результатам КТ исследования выявлялся дефект со сторонами 8ммх4мм, который был расположен вдоль оси конечности, имеет чёткие контуры (рис. 3Б).
Через 37 суток на компьютерных томограммах дефект костной ткани имеет неправильную форму, неровные края, свободнолежащие мелкие рентгеноконтрастные объекты в полости, признаки периостальной реакции окружающей очаг.
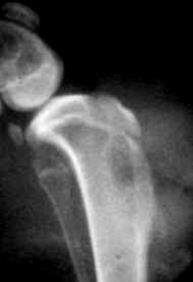
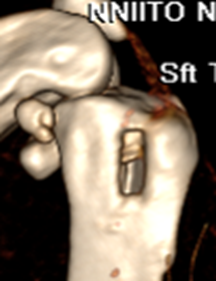
А Б
Рис. 3. А – Рентгенограмма области верхней трети левой голени кролика. Боковая проекция верхней трети левой голени с нанесёным дефектом (1). Б – Интраоперационная трёхмерная реконструкция проксимального метаэпифиза б/берцовой кости с нанесённым дефектом (2).
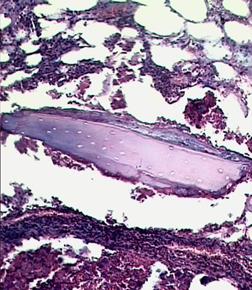
При гистоморфологическом исследовании образцов тканей области гнойного дефекта выявили признаки хронически протекавшего гнойного воспалительного процесса. Со стороны костномозговой полости в тканях, смежных с дефектом визуализировали картину гнойного воспалительного процесса, прилегающего к костному массиву с наличием участков рассасывания костных фрагментов и формированием абсцессов (рис. 4). Очаги гнойного расплавления выявлялись и со стороны периоста. Гнойный процесс распространялся на кортикальную костную пластинку, отмечались участки её рассасывания и образования в новом дефекте грануляционной ткани, что расценивалось как формирование свищевого хода.
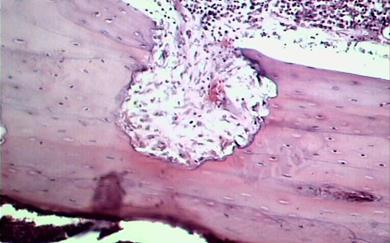
Рис. 4. Участок распада кортикальной костной ткани, прилегающей к дефекту – формирование абсцесса. (×200). 1 — кортикальная костная пластинка, прилегающая к дефекту; 2 — очаг рассасывания костной ткани; 3 — гнойно-воспалительный инфильтрат в костномозговом канале; 4 — периост.
Вокруг отграничивающихся участков воспаления обнаружены разрозненные безостеоцитные костные балки (рис. 5).

Рис. 5. Безостеоцитный костный фрагмент в области очага хронического воспаления (×200). 1 – очаг гнойного воспаления; 2 – безостеоцитный костный фрагмент; 3 – костный мозг.
Таким образом, разработанная модель обеспечивала формирование хронической гнойной костно-мягкотканой раны с достоверными клинико-инструментальными и морфологическими признаками хронического остеомиелита. Информативным свидетельством хронического гнойного воспаления костной ткани оказались и данные КТ на 37 сутки эксперимента: содержимое очага низкой рентгенологической плотности, периостальная реакция окружающая очаг.
Через 7 суток от начала эксперимента число лейкоцитов возрастает на 18,6 ± 3,1%, тромбоцитов на 14,8 ± 1,7%. Гемоглобин снижается на 15,3 ± 2,4%. Через 14 суток, число лейкоцитов превышает исходные показатели на 10,4 ± 2,1%, тромбоцитов на 14,3 ± 2,3%. Гемоглобин ниже исходных на 10,3 ± 0,5%. Через 30 суток все измеряемые показатели не возвращались к исходным значениям (рис. 6).
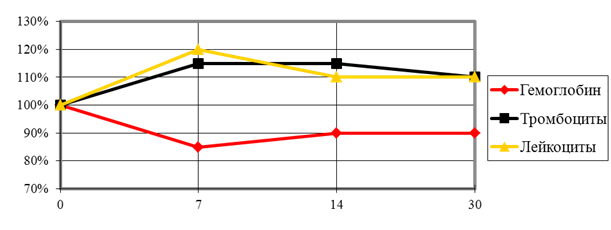
Рис. 6. Динамика лабораторных показателей.
Динамика лабораторных показателей соответствует развитию хронического процесса под влиянием травмы кости, инфекционного фактора и инородных тел. Такие изменения могут служить первыми лабораторными признаками хронизации раневого процесса у экспериментальных животных.
Выводы:
Таким образом, предложенная экспериментальная модель, включающая стандартизованные дозы инфицирующего агента и дефект кости, позволяет достичь формирования хронической гнойной костной раны с признаками хронического остеомиелита, что позволит на ее основе оценивать различные методики санации гнойного очага, хирургического лечения остеомиелитического процесса, эффективности использования остеопластических материалов.
Рецензенты:
Королёв С.Б., д.м.н., профессор, заведующий кафедрой травматологии, ортопедии и военно-полевой хирургии им. М.В. Колокольцева Государственного бюджетного образовательного учреждения высшего профессионального образования «Нижегородская государственная медицинская академия» Министерства здравоохранения Российской Федерации, г. Нижний Новгород;
Ежов И.Ю., д.м.н., заведующий отделением травматологии и ортопедии федерального бюджетного учреждения здравоохранения «Приволжский окружной медицинский центр» федерального медико-биологического агентства, г. Нижний Новгород.
Библиографическая ссылка
Живцов О.П., Митрофанов В.Н., Бургов С.Н., Гординская Н.А. ЭКСПЕРИМЕНТАЛЬНАЯ МОДЕЛЬ ХРОНИЧЕСКОЙ ГНОЙНОЙ КОСТНОЙ ПОЛОСТИ // Современные проблемы науки и образования. – 2015. – № 6.;
URL: https://science-education.ru/ru/article/view?id=23642 (дата обращения: 19.12.2020).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
