Элементы воспаления скопления клеток
Фагоцитоз – это способность определенных клеток (фагоцитов) удерживать и переваривать плотные частицы. Это явление было открыто И. Мечниковым.
Фагоцитоз осуществляется микрофагами (нейтрофилами) и системой мононуклеарных макрофагов.
Мононуклеарные макрофаги
Система (MMS) включает следующие элементы:
- промоноциты (костный мозг);
- моноциты (кровь);
- тканевые макрофаги;
- гистиоциты соединительной ткани;
- печеночные клетки Куппера;
- легочные альвеолярные макрофаги;
- свободные и фиксированные макрофаги лимфатической ткани;
- плевру и перитонеальные макрофаги.
Клетки мононуклеарной системы объединяет общее происхождение гемопоэтических клеток и саморегуляция.
Моноцитопоэз
Моноцитопоэз – это стимулирующий фактор колонии фибробластов и фактор роста макрофагов, но он же подавляет (отрицательная саморегуляция) интерферон фибробластов и лейкоцитов и т. д.
Процесс фагоцитоза делится на четыре стадии:
- Приближение.
- Адгезия.
- Оседание;
- Стадия пищеварения.
Фаза приближения
Фагоцит приближается к объекту – бактериям, мервому клеточному элементу, инородному объекту. При движении под действием хемотаксиса цитоплазма фагоцита образует удлинения (псевдоподии).
Адгезия
Способствует образованию аминополисахаридов на поверхности фагоцитов и перекрытию фагоцитарного объекта белками сыворотки, особенно иммуноглобулинами. Последний механизм по сути является опсонизацией – бактерии и поврежденные клетки перекрываются с IgM, IgG и компонентами комплемента (C3, C5 и др.), что облегчает адгезию к фагоциту.
Адгезия
Поверхность фагоцита заряжена отрицательно, поэтому адгезия лучше, если объект, подлежащий фагоцитозу, заряжен положительно. Менее фагоцитарны отрицательно заряженные объекты, такие как опухолевые клетки.
Оседание
Этап фагоцитации объекта – путь инвагинации. Сначала фагоцит образует углубление, а затем фагосому – вакуоль, содержащую объект, подлежащий фагоцитозу. НАДН-зависимая оксидаза в мембране фагоцитов активируется до образования фагосом; в результате O2 превращается в O 2 ~ (супероксид-анион) и образуется H 2 O 2.
Эти продукты обладают бактерицидным действием, а также вызывают образование свободных радикалов. Под действием пероксидаз и каталаз H 2 O 2 расщепляется и высвобождается молекулярный O 2. Свободные радикалы и активный молекулярный O 2 действуют на мембрану фагоцита и объект, подлежащий фагоцитозу, активируя перекисное окисление липидов.
Липопероксиды и свободные радикалы неустойчивы к лизосомным мембранам и способствуют высвобождению лизосомальных ферментов.
Стадия пищеварения
Лизосомы присоединяются к фагосоме, содержащей фагоцитарный объект. Эти органеллы содержат все ферменты, необходимые для расщепления углеводов, белков, жиров и нуклеиновых кислот. В еще неактивной форме они попадают в вакуоль фагоцитов.
Пищеварительная вакуоль образуется при pH около 5,0, близком к оптимальному для лизосомальных ферментов. Активируются лизосомальные ферменты, и фагоцитарный объект постепенно переваривается. Во время стадии пищеварения проницаемость мембраны фагосомы увеличивается, содержимое фагосомы ускользает в цитоплазму, и микрофаг умирает (этому процессу способствует ацидоз). В этом случае фагоцитарный микроорганизм также может сохранять жизнеспособность.
Роль макрофагов в воспалительном процессе
Макрофаги начинают участвовать в фагоцитозе позже микрофагов. Макрофаги также более устойчивы к гипоксии и ацидозу, например, моноциты жизнеспособны даже при pH 5,5.
В очаге воспаления макрофаги выполняют несколько функций:
- Фагоцитируют бактериальные остатки, оставшиеся после эвакуации гноя и продуктов распада тканей – очищающая функция;
- Высвобождают лизосомальные ферменты – гиалуронидазу, аминопептидазу и др;
- Синтезируют компоненты системы комплемента и простагландины.
Взаимодействие макрофагов и лимфоцитов при хроническом воспалении
В то же время воспаленная тканевая среда также стимулирует образование фибробластов и фиброцитов. Постепенно появляется новая, богатая сосудами грануляционная ткань.
Фагоцитоз стимулируется продуктами повреждения тканей – внутриклеточные белки, ферменты, полипептиды, аминокислоты, электролиты и т. д., биологически активными веществами, половыми гормонами, тироксином, адреналином, лихорадкой. Но подавляется недостатком стимулирующих факторов, глюкокортикоидов, гликолортикоидов, ацетилхолина, ацетилхолина.
Фагоцитоз
Считается, что клетки плаценты и злокачественные опухоли способны секретировать вещество, которое подавляет функцию макрофагов, иммунологические реакции лимфоцитов и эмиграцию лейкоцитов, что приводит к значительному ослаблению или даже прекращению воспаления.
Объекты, которые фагоциты не могут переваривать, остаются в этих клетках в течение длительного времени и покрываются тонкой пленкой аминополисахаридов. После гибели фагоцитов они повторно фагоцитируются или выводятся из организма. Процесс, при котором фагоцит после переваривания высвобождает часть продуктов своего фагоцитоза в окружающую среду, называется экструзией.
Фагоцитоз – не единственный в организме механизм борьбы с воспалением. Большинство микроорганизмов погибают в условиях ацидоза, а также от ферментов, высвобождаемых во время гибели клеток и функционирования иммунокомпетентной системы.
Нейтрофилы во внеклеточном пространстве секретируют катионные белки, которые могут убивать ферменты без ферментов и фагоцитоза. Таким образом, воспалительные очаги постепенно избавляются от микроорганизмов и мертвых клеток.
Асептическое и острое воспаление
Дальнейшее течение воспаления зависит от того, является ли воспаление асептическим или бактериальным.
В асептических воспалительных условиях, например, вокруг хирургического шва, инородного тела, стенка микрофагов (нейтрофилов) начинает формироваться в течение нескольких часов, достигая максимума в течение дня.
Позже появляется следующий вал макрофагов, который достигает максимума через 2-3 раза. в день. Эмигрировавшие лейкоциты постепенно становятся неподвижными, больше не могут делиться и погибают в течение 3-5 дней. 2-3. на 5 сутки начинает формироваться стенка фибробластов, а на 5 сутки – соединительнотканная капсула.
Таким образом, в случае острого воспаления патогенный агент в организме преобразует белки, которые участвуют в реакции антиген-антитело, медиаторы и модуляторы воспаления, систему фагоцитов и миграцию клеток. В результате заканчивается острое воспаление. Однако, если инфекционные агенты попадают в участок асептического воспаления, например, в результате травмы, это воспаление становится септическим (бактериальным) воспалением.
Бактериальные воспалительные состояния бактерий и токсинов, не вызывающие гиперемии, экссудации и эмиграции лейкоцитов. Между клетками воспаленных тканей и особенно вокруг кровеносных сосудов накапливается все больше и больше микрофагов. Лизосомы микрофагов содержат множество активных ферментов, и эти клетки также начинают процесс фагоцитоза. При пальпации воспаленная ткань в это время кажется плотной, поэтому это называется стадией воспалительной инфильтрации.
По мере прогрессирования воспаления лейкоциты и те тканевые клетки, которые претерпели необратимые изменения во время воспаления, погибают. В этих клетках высвобождаются лизосомальные ферменты, которые расщепляют тканевые белки, белковые и липидные комплексы и другие структуры. Это стадия гнойного размягчения воспаления.
Эти стадии наблюдаются, например, у пациентов с гнойным воспалением перикарда (фурункул), гнойным воспалением апокринных потовых желез (гидраденит) и гнойным воспалением соединительной ткани (флегмона). При вдыхании воспаленная ткань выглядит мягкой, с характерным раскачиванием – флюктуацией. Образуется замкнутое скопление гноя – абсцесс.
Гнойное воспаление перикарда
Гной разрывается в направлении наименьшего сопротивления (либо наружу, либо внутри тела). Если гной попадает в кровоток (пемия), в организме может развиться множество очагов гноя, но под действием микроорганизмов и токсических веществ – угрожающее общее заболевание (сепсис, септикопиемия). Поэтому важно диагностировать накопление гноя и обеспечить хирургический дренаж гноя наружу.
Продолжение статьи
- Часть 1. Этиология и патогенез воспаления. Классификация.
- Часть 2. Особенности обмена веществ при воспалении.
- Часть 3. Физико – химические изменения. Роль нервной и эндокринной систем в развитии воспаления.
- Часть 4. Изменения в периферическом кровообращении при воспалении.
- Часть 5. Экссудация. Экссудат и транссудат.
- Часть 6. Эмиграция лейкоцитов. Хемотаксис.
- Часть 7. Фагоцитоз. Асептическое и острое воспаление.
- Часть 8. Распространение. Последствия. Принципы лечения воспаления.
Поделиться ссылкой:
Источник
Воспаление (лат. inflammatio) – это сложный процесс реакции организма на внешний или внутренний повреждающий (болезненный) фактор. Воспаление направлено на устранение этого фактора, восстановление поврежденных тканей и защиту от развития заболеваний.
Таким образом, воспаление выполняет защитную функцию в организме, но только тогда, когда оно острое. Хроническое воспаление перестает быть физиологическим фактором и становится патогеном, ведущим к аутоиммунным заболеваниям и раку.
Воспаление – это естественный процесс, который происходит на определенных этапах. Без воспалительной реакции, которая активирует иммунную систему для борьбы с патогеном, например, вирусом, бактериями, травмированными участками, мы не смогли бы пережить даже самую маленькую инфекцию.
Сложность воспалительного процесса отражается в часто используемых терминах – состояние, процесс или воспалительная реакция.
Симптомы воспаления
Симптомы острого воспаления были впервые описаны римским ученым и энциклопедистом Аврелием Цельсом (25 г. до н.э. – 50 г. н.э.). в единственной работе «Медицина», которая сохранилась до наших дней, он описал четыре основных симптома острого воспаления, которые иногда называют тетрадой Цельса:
- боль (лат. dolor);
- повышенная температура (лат. calor);
- покраснение (лат. rubor);
- отек (лат. tumor).
Пятый признак воспаления – потеря функции и повреждение органов (лат. Functiolaesa) был добавлен немного позже, возможно, греческим врачом и философом Галеном (129-200 н.э).
Покраснение кожи является результатом увеличения кровотока в области, пораженной патогенными микроорганизмами, отек – это результат проникновения белка и клеток из сосудов в ткани – все это вызывает боль. Температура также является следствием увеличения кровотока. В свою очередь, «потеря функции» означает, что орган не функционирует должным образом.
В развитии воспалительной реакции участвуют многие физиологические механизмы, связанные как с клетками – гранулоцитами, моноцитами, тромбоцитами, лимфоцитами Т и В, тучными клетками, эндотелиальными клетками кровеносных сосудов, макрофагами, фибробластами, так и с веществами, выделяемыми ими – медиаторами воспаления. Со временем могут быть поражены целые органы и могут возникнуть системные симптомы – повышение температуры тела, потеря веса, мышечная атрофия, чувство общей слабости.
Воспаление при ларингите
Как возникает воспаление?
Чаще всего повреждающий фактор, который инициирует воспалительный процесс, приходит извне. Это может быть:
- физическое повреждение – химическое, тепло или холод, механическая травма;
- биологический агент – бактерии, вирус, чужеродный белок.
Также бывает, что причиной воспаления является процесс, происходящий внутри организма – эмболия артерии, сердечный приступ или развитие рака.
Изменения в кровеносных сосудах всегда являются корнем воспалительной реакции. Сосуды расширяются, и их проницаемость увеличивается. Это приводит к проникновению медиаторов и воспалительных клеток в окружающие ткани.
Составляющие воспаления
Острое воспаление выполняет важную защитную функцию – оно удаляет возбудителя и восстанавливает нормальную функцию органа. Переход острой фазы в хроническую фазу часто связан с потерей контроля организма над воспалительными механизмами и, следовательно, с функциональными нарушениями и даже повреждением пораженной ткани. Этот процесс можно сравнить с превращением острой боли (защитной функции) в хроническую боль, которая становится самой болезнью.
Патогенез воспалительного процесса
Воспалительная реакция неразрывно связана с иммунным ответом. Начинается с контакта патогена со специализированными клетками иммунной системы, так называемыми антигенпрезентирующие клетки. Когда клетки стимулируются, они продуцируют и высвобождают медиаторы воспаления, которые имеют решающее значение для инициации и поддержания воспалительного процесса.
Медиаторы оказывают про-и противовоспалительное действие на клетки-мишени, модулируя течение воспаления. Со временем адаптивная иммунная система (специфическая реакция) также участвует в борьбе с повреждающим фактором. Работа этой системы чрезвычайно точна – взаимодействие лимфоцитов Т и В приводит к выработке специфических антител, которые селективно нейтрализуют возбудителя.
Правильно функционирующая иммунная система эффективно распознает патогены и эффективно уничтожает их, не повреждая свои собственные клетки и ткани. Однако в определенных ситуациях иммунорегуляторные механизмы могут работать с дефектом – возникает воспалительная реакция на аутоантигены.
Это состояние встречается при многих аутоиммунных заболеваниях (диабет 1 типа, ревматоидный артрит, красная волчанка, целиакия, болезнь Хашимото).
Поделиться ссылкой:
Источник
Воспаление. Характеристики этапов воспаления
Воспаление есть местная реакция организма рефлекторного характера, связанная с местным раздражением или повреждением ткани, эта реакция по существу является приспособительной, а следовательно, и биологически целесообразной. В ее основе лежат сосудисто-тканевые изменения. Микроскопически воспаление выражается альтерацией, экссудацией и пролиферацией.
Под альтерацией понимают поврежденные ткани, то в более легких степенях воспаления морфологически проявляется различными дистрофиями, а в более тяжелых — некробиозом и некрозом, может произойти также десквамацня клеток. Эти изменения часто связаны с прямым воздействием повреждающего фактора (механическая травма, химический или термический ожог и т. д.), но они могут быть и следствием воспалительных изменений, нарушения кровообращения и тканевого обмена. В зависимости от условий (сила и характер воздействия, состояние организма) альтеративные явления бывают или ограниченными, или значительно распространенными.
Экссудацией называют изменения со стороны сосудистой сети в зоне воспаления, выражающиеся в ее расширении, нарушении тока крови (вплоть до стазов) и выхождении из сосудистого русла жидкой ее части, содержащей белок и лейкоциты. Жидкую часть крови и клеточные элементы, вышедшие из сосудов, называют экссудатом.
Расширению сосудов предшествует короткий период спазма, а выходу лейкоцитов — их краевое расположение в сосудах; выход жидкой части и клеток крови происходит в капиллярах и венах. Эмигрируют преимущественно непрофильные гранулоциты, реже встречаются ацидофильные и базофильные гранулоциты. Поскольку продолжительность жизни гранулоцнтов в тканях исчисляется 7 днями, то обнаруживаемые по истечении этого срока неизмененные клетки следует считать вышедшими позднее. В ранние сроки из кровяного русла выходят в основном гранулоциты, а в более поздние — лимфоциты и моноциты. По виду они мало отличаются от гистиоцитов, число которых увеличивается в стадии пролиферации. Лимфоциты и моноциты располагаются преимущественно в краевой зоне, нередко образуя скопление по ходу сосудов.

Продолжительность жизни лимфоцитов намного больше, чем гранулоцитов. Выход эритроцитов наблюдается в случаях геморрагической формы воспаления, при этом они быстро разрушаются.
Серозное воспаление может развиваться в коже; оно сопровождается образованием пузырей в результате отслаивания (расслаивания) эпидермиса и скопления под ним (в его толще) мутноватой желтоватой жидкости. Из паренхиматозных органов серозное воспаление бывает в сердце, печени и почках, где серозная жидкость скапливается по ходу стромы, перисинусоидных пространств и в капсуле клубочков.
Серозное воспаление постоянно приходится констатировать при исследовании таких судебно-медицинских объектов, как кожа при ожогах и отморожениях II степени (пузыри). Нередко обнаруживают его в сердце при скоропостижной смерти (миокардит), а также в мягких мозговых оболочках при черепно-мозговой травме (лептоменингит). Такое воспаление может развиваться в плевре, брюшине, перикарде при тупой травме груди и живота.
Серозное воспаление обычно сохраняет свой характер до окончания процесса или переходит в серозно-геморрагическое, серозно-гнойное, серозно-фибринозное; оно может развиваться как коллатеральное вокруг гнойного геморрагического очага.
Иногда серозное воспаление несет в себе элементы аллергической реакции. Это проявляется резким набуханием коллагеновых структур и некоторым изменением их тинкториальных свойств, а также появлением среди клеток инфильтрата ацидофильных гранулоцитов.
При серозно-геморрагическом воспалении имеется примесь к экссудату большего или меньшего количества эритроцитов как следствие повышенной проницаемости стенок сосудов. Это воспаление, как сказано выше, может развиваться на фоне серозного, но может возникать первично как геморрагическое. В судебно-медицинской практике его нередко наблюдают при скоропостижной смерти от респираторных вирусных заболеваний.
– Также рекомендуем “Серозно-гнойное воспаление. Продуктивное воспаление”
Оглавление темы “Изменения тканей организма в патологии”:
1. Воспаление. Характеристики этапов воспаления
2. Серозно-гнойное воспаление. Продуктивное воспаление
3. Стресс-реакция. Морфология стресса
4. Изменения гипоталамуса при стрессе. Гипофиз при стрессе
5. Аденогипофиз при стрессе. Морфология надпочечников при стрессе
6. Трупные пятна. Гистология трупных пятен
7. Стадия гипостаза. Стадии стаза и имбибиции
8. Характеристика стадии имбибиции. Изменения кожи в области трупных пятен
9. Трупные гипостазы. Микроскопия трупных гипостазов
10. Трупное окоченение. Степень трупного окоченения
Источник
Лекция 15
ПРОДУКТИВНОЕВОСПАЛЕНИЕ
• Продуктивное, или пролиферативное, воспаление характеризуется преобладанием пролиферации клеточных элементов. Главными признаками продуктивного воспаления являются: инфильтрация мононуклеарами, особенно макрофагами, лимфоцитами и плазматическими клетками, пролиферация фибробластов, во многих случаях — нарастающий фиброз и выраженная в той или иной степени деструкция (альтерация) ткани. При этом Процессы экссудации также имеют место, но они отходят на второй план.
Этиология. Причины продуктивного воспаления разнообразны — биологические факторы (вирусы, риккетсии, бактерии, грибы, паразиты), физические и химические факторы (чаще имеет место пролонгированная экспозиция неповреждающими, но потенциально токсичными субстанциями типа асбеста, оксида кремния (IV) и т.п.; инородные тела и др.)» иммунные реакции, в частности такие, которые возникают, например, против собственных тканей при аутоиммунных болезнях. Иногда непосредственно этиологический фактор вызывает продуктивную реакцию, что особенно типично для вирусов и риккетсии. Учитывая часто наблюдаемую персистенцию этиологического фактора, основными особенностями продуктивного воспаления считают длительное воздействие патогенного раздражителя и хроническое течение (только в редких случаях оно протекает остро). Длительная антигенная стимуляция, развивающаяся зачастую на фоне измененной реактивности организма, приводит к развитию реакций гиперчувствительности.
Для продуктивного воспаления характерны пролиферация клеток гематогенного и гистиогенного происхождения, дифференцировка их и клеточные трансформации (схема 21). В очагах продуктивного воспаления отмечается выраженная пролиферация моноцитов. Моноциты начинают эмигрировать относительно рано и в пределах 48 ч становятся преобладающими. Достигнув экстраваскулярных тканей, моноциты трансформируются в макрофаги. Появление макрофагов осуществляется тремя механизмами. Во-первых, из циркулирующей крови. Это наиболее важный источник. Стимулом для появления моноцитов служат фибриноген, пептиды, катионные белки нейтрофилов, лимфокины, некоторые факторы роста (трансформирующий фактор роста, тромбоцитарный фактор роста), а также фрагменты разрушающегося коллагена и фибронектин. Каждый из них играет роль при определенных обстоятельствах. Например, лимфокины появляются во время иммунных реакций типа ГЗТ. Во-вторых, местная пролиферация — путем митотического деления макрофагов после эмиграции их из крови. В-третьих, пролонгированное выживание (“бессмертные клетки”) и иммобилизация макрофагов в зоне воспаления. Этот вариант типичен для медленных вирусных инфекций или в случаях отложения малотоксичных веществ типа инертных липидов, угольной пыли.
Макрофаг является центральной фигурой при продуктивном воспалении благодаря большому количеству биологически активных продуктов, которые он может производить. Одни из этих продуктов токсичны по отношению к тканям (например, метаболиты кислорода, протеазы), другие вызывают приток клеток иных типов (лимфоцитов, нейтрофилов, фибробластов), каждая из которых вносит свою лепту в широкую палитру изменений при хроническом воспалении, для которого характерны прогрессирующее повреждение тканей и последующие функциональные Нарушения.
Макрофаг — основной представитель системы моноцитарных фагоцитов (СМФ), его нередко называют профессиональным фагоцитом, так как основной его функцией является эндоцитоз, а еще точнее, фагоцитоз. Для осуществления этой функции на поверхности макрофага имеются десятки специфических рецепторов, в частности развитая и сложная система Fc-рецепторов к различным иммуноглобулинам, лектиноподобные рецепторы для захвата бактерий, грибов и т.д.
Фагоцитоз — характерная черта продуктивного воспаления, однако он далеко не всегда завершается полным перевариванием чужеродного агента. Во многих случаях живые агенты, обладая защитными механизмами, выживают внутри макрофагов (эндоцитобиоз), и процесс приобретает хронический характер.
Являясь самой распространенной клеткой среди других клеток воспалительного инфильтрата, макрофаг в то же время занимает ключевую позицию в клеточных кооперациях при продуктивном воспалении (схема 22). Важнейшими продуктами секреции макрофагов являются цитокины (ИЛ-1, ИЛ-2, ИЛ-5, ИЛ-6, ИЛ-8, ФНО-а), с помощью которых осуществляются прежде всего активация лимфоцитов и межклеточные взаимоотношения, и факторы роста (ФРФ, ТцФР, КСФ, ТФР), стимулирующие клеточную пролиферацию, в частности, Т- и В-лимфоцитов, эндотелиоцитов, тромбоцитов и клеток-предшественников миелоидного ряда в костном мозге. Влияние на эндотелий заключается в том, что, с одной стороны, происходит его пролиферация, с другой — усиливается адгезия тромбоцитов. Кроме того, к секреторным продуктам макрофага относится огромное количество ферментов (кислые фосфатазы — гидролазы, липазы; эстераза, нейтральные протеазы — эластаза, коллагеназа и др.), реактивные метаболиты кислорода (пероксид водорода, супероксидный анион-радикал), биоактивные л-и -п и д ы , например производные арахидоновой кислоты (простаг-ландины, лейкотриены, ФАТ), фибронектин, цАМФ, оксид азота (II) и др.
Схема 21. Пролиферация, дифференцировка, трансформация клетоквочагевоспаления
Схема 22. Взаимоотношениемакрофагасклеткамив очагевоспаления
Клеточные кооперации, т.е. взаимодействие макрофага и других клеток воспалительного инфильтрата между собой, с одной стороны, и взаимодействие клеток с волокнистыми структурами и различными компонентами экстрацеллюлярного матрикса, с другой, осуществляются с помощью комплекса интегриновых рецепторов. Например, кооперация макрофаг —■ лимфоцит осуществляется с помощью интрацеллюлярных адгезивных молекул (ICAM-1). При этом в межклеточных кооперативных взаимоотношениях важную роль играют антигены гистосовместимости (система HLA): они выступают в качестве маркеров, осуществляющих антигенное считывание, а также выполняют роль универсальных рецепторов, представляющих чужеродные антигены.
Другими часто встречающимися клетками, помимо макрофага, при продуктивном воспалении являются лимфоциты, плазматические клетки, эозинофилы и тучные клетки.
Плазматические клетки секретируют антитела, направленные либо против персистирующих антигенов в зоне воспаления, либо против поврежденных компонентов ткани. В ряде случаев плазматические клетки превращаются в гомогенные шаровидные образования, которые называют гиалиновыми шарами, или тельцами Русселя.
Лимфоциты мобилизуются как в антительных, так и в клеточных иммунных реакциях. Однако при неиммунном воспалении лимфоциты встречаются также очень часто, и причина этого явления до сих пор является загадкой для морфологов. При иммунном воспалении лимфоциты активируются, контактируя с антигенами. Активированные лимфоциты вырабатывают лимфокины — главные стимуляторы моноцитов и макрофагов, и 7-интерферон, который способствует активации и дифференцировке макрофагов. В то же время активированные макрофаги выделяют монокины (ИЛ-1), которые в свою очередь влияют на функцию Т- и В-лимфоцитов.
Эозинофилы преобладают в клеточных инфильтратах прежде всего при паразитарных инфекциях, т.е. в случаях иммунных реакций, связанных с IgE. Эозинофилы относят к хемотаксическим агентам, привлекающим главным образом тучные клетки, гранулы которых содержат главный базовый протеин, очень токсичный для паразитов. Эозинофилы, хотя и являются главными при паразитарных инфекциях, вносят свой вклад в повреждение тканей при состояниях гиперчувствительности.
Нейтрофильные лейкоциты обычно являются ключевым признаком экссудативного воспаления, однако в ряде случаев довольно четко “уживаются”признаки хронического продуктивного и острого (экссудативного) воспаления. Это наблюдают, например, при актиномикозе, при активном хроническом гастрите.
Но наиболее значимым для течения и исхода продуктивного воспаления оказывается влияние макрофага (ФРФ, ИЛ-1, ФНО-а) вместе с тромбоцитами (ТцФР, ТФР-) и Т-лимфоцитами ФНО-а) на фибробласты. Медиаторы этих трех эффекторных клеток усиливают пролиферацию и метаболизм фибробластов и тем самым индуцируют синтез коллагена. Таким образом, еще одной существенной особенностью продуктивного воспаления является развитие склероза в исходе воспаления. Механизм, который приводит к воспроизводству и распространенной пролиферации фибробластов, к сосудистой пролиферации, накоплению коллагена и фиброзу при хроническом продуктивном воспалении, аналогичен тому, который возникает при заживлении ран (см. лекцию 16 “Воспаление, регенерация и дисрегенерация”).
Выделяют следующие виды продуктивного воспаления: 1) интерстициальное (межуточное); 2) гранулематозное; 3) воспаление с образованием полипов и остроконечных кондилом.
ИНТЕРСТИЦИАЛЬНОЕ (МЕЖУТОЧНОЕ) ВОСПАЛЕНИЕ
Этот вид воспаления характеризуется образованием очагового или диффузного воспалительного клеточного инфильтрата в строме паренхиматозных органов — миокарда, печени, почек, легких. Инфильтрат представлен лимфоцитами, гистиоцитами, плазматическими клетками, единичными нейтрофилами, эозинофилами и тучными клетками. В паренхиматозных элементах органов выявляются выраженные дистрофические, а иногда и некробиотические изменения. Подобные изменения наблюдаются в кардиомиоцитах, например при миокардите Абрамова — Фидлера, в гепатоцитах при вирусном гепатите.
В исходе хронического интерстициального воспаления разрастается соединительная ткань. При некоторых заболеваниях печени хроническое интерстициальное воспаление приводит к развитию цирроза.
ГРАНУЛЕМАТОЗНОЕВОСПАЛЕНИЕ
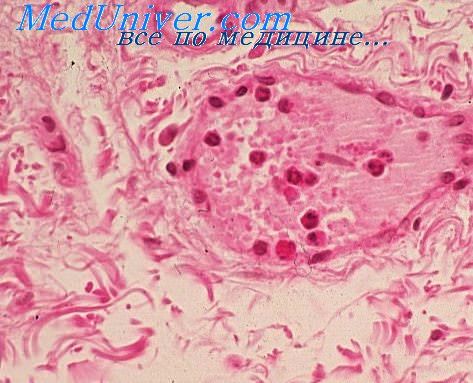
Гранулематозное воспаление — вариант продуктивного воспаления, при котором доминирующим типом клеток являются активированные макрофаги (или их производные), а основным морфологическим субстратом — гранулема.
Гранулема, или узелок (бугорок, по Р.Вирхову), — это очаговое скопление способных к фагоцитозу клеток моноцитарно-макрофагальной природы. Основным представителем клеток СМФ является макрофаг, который, как уже упоминалось, образуется из моноцита. На “поле” воспаления моноцит делится лишь один раз, а затем трансформируется, как показал опыт с культурой ткани, в макрофаг. Но на этом трансформации не заканчиваются. Через 7 дней после возникновения и размножения макрофаг превращается в эпителиоидную клетку. Для этого необходимы продукты активированных Т-лимфоцитов, особенно 7-интерферон. Эпителиоидные клетки по сравнению с макрофагами имеют более низкую фагоцитарную способность (у них отсутствуют вторичные лизосомы и макрофагальные гранулы), но лучше развитую бактерицидную и секреторную активность — они синтезируют факторы роста (ФРФ, ТФР), фиброне-ктин-1, ИЛ-1. На второй неделе эпителиоидные клетки трансформируются путем деления ядер без деления клетки (реже путем слияния между собой) в гигантские многоядерные клетки Пирогова — Лангханса, а через 2—3 нед — в гигантские клетки инородных тел.
Особенностями гигантских клеток Пирогова — Лангханса являются крупные размеры (до 40—50 мкм), наличие большого (до 20) количества ядер, которые располагаются эксцентрично с одной стороны в форме подковы. В гигантской клетке инородных тел ядер еще больше — до 30 (описывают даже до 100), но они располагаются преимущественно в центре клетки. Оба типа гигантских клеток отличает отсутствие лизосом, поэтому, захватывая различные патогенные факторы, гигантские клетки не в состоянии их переварить, т.е. фагоцитоз в них подменяется эндоцитобиозом. В случаях микробной инвазии эндоцитобиоз поддерживается наличием в цитоплазме секреторных гранул, например липидных включений при туберкулезе. Однако в основном секреторная функция их резко подавлена, факторы роста и цитокины, в частности, вообще не синтезируются.
Морфогенез гранулемы складывается из следующих четырех стадий:
▲ накопление в очаге повреждения ткани юных моноцитарных фагоцитов;
▲ созревание этих клеток в макрофаги и образование макрофагальной гранулемы;
▲ созревание и трансформация моноцитарных фагоцитов и макрофагов в эпителиоидные клетки и образование эпителиоидно-клеточной гранулемы;
▲ трансформация эпителиоидных клеток в гигантские (Пирогова — Лангханса и/или инородных тел) и формирование гигантоклеточных гранулем.
Таким образом, учитывая преобладающий клеточный состав гранулемы, по морфологическим признакам различают три вида гранулем: 1) макрофагальную гранулему (простую гранулему, или фагоцитому); 2) эпителиоидно-клеточную гранулему; 3) гигантоклеточную гранулему.
Этиология гранулематоза. Различают эндогенные и экзогенные этиологические факторы развития гранулем. Кэндогенным относят труднорастворимые продукты поврежденных тканей, особенно жировой ткани (мыла), а также продукты нарушенного обмена, такие как ураты. К экзогенным факторам, вызывающим образование гранулем, относят биологические (бактерии, грибы, простейшие, гельминты), органические и неорганические вещества (пыли, дымы и т.п.), в том числе лекарственные.
В настоящее время гранулемы по этиологии разделяют на две группы: 1) гранулемы установленной этиологии и 2) гранулемы неустановленной этиологии [Струков А.И., Кауфман О.Я., 1989]. Первую группу в свою очередь подразделяют на две подгруппы: инфекционные и неинфекционные гранулемы.
К инфекционным относят гранулемы при сыпном брюшном тифах, бешенстве, вирусном энцефалите, актиномикозе, шистосомозе, туберкулезе, лепре, сифилисе и др.
Неинфекционные гранулемы развиваются при попадании в организм органической и неорганической пыли шерсть, мука, оксид кремния (IV), асбест и др., инородных тел медикаментозных воздействиях (гранулематозный гепатит, олео гранулематозная болезнь).
К гранулемам неустановленной этиологии относят гранулемы при саркоидозе, болезни Крона, первичном билиарном циррозе и др.
Патогенез гранулематоза. Далеко не полный перечень этиологических факторов выявляет совершенно очевидную закономерность — гранулематозное воспаление протекает, как правило, хронически и развивается при следующих двух условиях: 1 наличие веществ, способных стимулировать СМФ, созревание трансформацию макрофагов; 2) стойкость раздражителя по отношению к фагоцитам. Такой раздражитель в условиях незавершенного фагоцитоза и измененной реактивности организма оказывается сильнейшим антигенным стимулятором для макрофага и Т- и В-лимфоцитов. Активированный макрофаг с помощью ИЛ-1 еще в большей степени привлекает лимфоциты, способствуя их активации и пролиферации, — завязываются механизмы клеточно-опосредованного иммунитета, в частности механизмы ГЗТ (подробнее см. лекцию 17 “Реакции гиперчувствительности”)- В этих случаях говорят об иммунной гранулеме.
Иммунные гранулемы чаще построены по типу эпителиоидно-клеточных узелков, но в них всегда имеется примесь довольно большого количества лимфоцитов и плазматических клеток. Развиваются они прежде всего при таких инфекциях, как туберкулез, лепра, сифилис, склерома. Иногда продукты тканевого повреждения становятся источником антигенного раздражения и в этих случаях могут подключаться аутоиммунные механизмы гранулемообразования. Наконец, гранулемы, вызванные органическими частицам пыли и аэрозолями, содержащими белки птиц, рыб, шерсть животных, как правило, по механизму их развития являются также антигенно-опосредованными. Хотя иногда возникают механизмы образования гранулем, опосредованные антителами.
К числу неиммунных гранулем относится большинство гранулем, развивающихся вокруг инородных тел, состоящих, прежде всего из частиц органической пыли (например, оксид бериллия (II) является соединением, вызывающим иммунные гранулемы саркоидного типа). Фагоцитоз в клетках неиммунных гранулем более совершенен, и построены они чаще по типу фагоцитомы либо гигантоклеточной гранулемы, состоящей из клеток инородных тел. При сравнении этих гранулем с иммунными отмечается меньшее количество лимфоцитов и плазматических клеток.
К числу критериев в оценке гранулем относят показатель клеточной кинетики, т.е. степени быстроты обмена (обновления) клеток внутри гранулемы, на основании которого выделяют быстро и медленно обновляющиеся гранулемы. Быстро обновляющиеся (за 1—2 нед) гранулемы продуцируют очень токсичные вещества (микобактерии туберкулеза, лепры), построены в основном по типу эпителиоидно-клет?
