Эозинофильное воспаление при хобл
Современные представления о хронической обструктивной болезни легких (ХОБЛ) характеризуются многообразием клинико-функциональных особенностей заболевания и гетерогенностью воспалительного ответа. Воспаление является одним из ключевых патофизиологических механизмов ХОБЛ и, соответственно, важной мишенью для фармакологического воздействия. Эозинофильный вариант воспаления при ХОБЛ ассоциируется с частыми обострениями и высокими темпами прогрессирования заболевания. Исследования последних лет свидетельствуют о существенном влиянии эозинофильного воспаления не только на особенности течения и прогноз больных ХОБЛ, но и на терапевтический ответ. Эозинофильный фенотип ХОБЛ служит предиктором эффективности ингаляционных глюкокортикостероидов, что следует учитывать при выборе фармакотерапии данной патологии.
Введение
Современные представления о хронической обструктивной болезни легких (ХОБЛ) свидетельствуют о сложном по своей патофизиологии и морфологии заболевании, для которого характерны многообразные клинико-функциональные проявления и гетерогенный воспалительный ответ. Длительное время ключевой клеткой воспаления дыхательных путей при ХОБЛ считался нейтрофил, тогда как эозинофильное воспаление рассматривалось в качестве типичной цитологической характеристики бронхиальной астмы – БА [1, 2]. Вместе с тем накоплены многочисленные данные, свидетельствующие о гетерогенности воспалительного ответа у больных ХОБЛ как в стабильном состоянии [3, 4], так и при обострении заболевания [5, 6]. В частности, результаты исследований последних лет демонстрируют эозинофильное воспаление дыхательных путей у значительной части больных ХОБЛ при исключении сопутствующей БА [7, 8].
Растущее число исследований, посвященных многообразию клинических форм ХОБЛ, свидетельствует о существенном влиянии эозинофильного воспаления не только на особенности течения и прогноз больных ХОБЛ, но и на различия терапевтической эффективности ингаляционных глюкокортикостероидов (ИГКС), что подтверждает фенотипическую гетерогенность заболевания.
Эозинофилия крови как косвенный маркер эозинофильного воспаления дыхательных путей при ХОБЛ
При оценке воспалительного ответа при ХОБЛ и БА предпочтение отдается исследованию цитологической характеристики содержимого дыхательных путей. Эозинофильный вариант ХОБЛ определяется при наличии ≥3% эозинофилов в цитологии индуцированной мокроты [3]. Эозинофилия мокроты, по данным ряда исследователей, встречается у трети (34–38%) больных ХОБЛ в стабильном состоянии [3, 4]. Следует отметить, что цитологический анализ индуцированной мокроты является методически сложной и трудоемкой задачей для большинства клинических лабораторий и во многих случаях малодоступен в реальной клинической практике.
В связи со сказанным привлекают внимание результаты исследований, показывающие, что содержание эозинофилов в мокроте коррелирует с уровнем эозинофилии крови [6, 9]. Механизм взаимосвязи уровня эозинофилов в периферической крови и выраженности воспалительного процесса в дыхательных путях при ХОБЛ изучен недостаточно. Вместе с тем продемонстрированы существенные различия уровня эозинофилии крови больных ХОБЛ с таковой мокроты и без нее, что подтверждается корреляционным анализом (r=0,535; p

Кроме того, выраженность эозинофильного воспаления в бронхах, в частности в подслизистой оболочке дыхательных путей у больных ХОБЛ при исключении БА, также коррелирует с показателем эозинофилии периферической крови (r=0,57; р=0,009) [10]. Аналогичные данные, подтверждающие взаимосвязь уровней эозинофилии крови и мокроты, получены и у больных БА [11–13], что позволяет рассматривать эозинофилию крови в качестве универсального маркера эозинофильного воспаления дыхательных путей. Необходимо отметить, что анализ крови в отличие от исследования индуцированной мокроты широко доступен, легко выполним и может проводиться всем больным, поэтому число эозинофилов крови в качестве биомаркера заслуживает самого пристального внимания для фенотипической характеристики воспаления при ХОБЛ.
Изучение клинических особенностей эозинофильного фенотипа ХОБЛ позволило выявить существенные различия частоты обострений у больных ХОБЛ в зависимости от уровня эозинофилии периферической крови [14, 15]. При этом подчеркивается, что эозинофилия крови является независимым фактором риска обострений заболевания. Ретроспективный анализ некоторых исследований свидетельствует о закономерном увеличении вероятности обострений ХОБЛ по мере нарастания числа эозинофилов периферической крови. Так, у больных ХОБЛ с эозинофилией крови
В современных научных публикациях по ХОБЛ отсутствуют строго согласованные количественные критерии эозинофильного воспаления с учетом выраженности эозинофилии периферической крови. Однако большинство исследователей определяют эозинофильный вариант воспаления при уровне эозинофилии ≥2%, или 200 и более клеток/мкл, периферической крови [3, 14, 16]. Проект федеральных клинических рекомендаций по ХОБЛ, представленный на сайте Российского респираторного общества [17], предлагает использовать в качестве критерия эозинофильного воспаления вне обострения заболевания уровень эозинофилии крови >300 клеток/мкл.
Доля больных ХОБЛ с эозинофилией периферической крови ≥2%, по данным литературы, существенно варьирует: от 32 до 75% [7, 14, 16]. Представленный разброс по числу больных в зависимости от уровня эозинофилии крови (рис. 1), вероятнее всего, можно объяснить различающимися критериями включения/исключения и возможным участием в некоторых из представленных исследований больных ХОБЛ в сочетании с БА. Вместе с тем в клинических исследованиях, критерии включения/исключения которых были прицельно ориентированы на изолированную ХОБЛ без возможной БА, хотя и наблюдалось меньшее число больных с эозинофилией, тем не менее и у них частота уровня эозинофилов в крови >2% была достаточно высокой, составив 27–37% [7, 8].
Большое клиническое значение для фенотипической характеристики того или иного заболевания имеет оценка воспроизводимости или стабильности оцениваемого биомаркера. N. Negewo и соавт. показали, что повторный анализ уровня эозинофилии крови больных ХОБЛ с интервалом 1 месяц в среднем характеризовался высоким внутриклассовым коэффициентом корреляции – 0,8 (95% доверительный интервал [ДИ] – 0,66–0,88; р200 клеток/мкл) в периферической крови в качестве обоснованного предиктора эозинофилии дыхательных путей и, соответственно, широко доступного в клинической практике диагностического биомаркера эозинофильного фенотипа ХОБЛ.
Характеризуя клинические особенности эозинофильного фенотипа ХОБЛ, следует иметь в виду неблагоприятное модифицирующее влияние эозинофильного воспаления на эволюцию заболевания. В частности, при эозинофильном фенотипе ХОБЛ увеличивается частота обострений [15, 18] и темпы прогрессирования заболевания [16], что приводит к неблагоприятному прогнозу и повышенной летальности по сравнению с пациентами без увеличенного уровня эозинофилов в крови и/или мокроте. Было показано, что эозинофилия крови >275 клеток/мкл ассоциируется с увеличением риска смерти в 4,8 раза среди больных ХОБЛ с анамнезом обострений заболевания [19]. Кроме того, анализ показателей летальности продемонстрировал, что указанный уровень эозинофилии крови в общей популяции на протяжении 30-летнего периода наблюдения был связан с увеличением общей смертности на 40% [20].
К настоящему времени накоплены убедительные данные о том, что выделение эозинофильного фенотипа ХОБЛ имеет большое значение не только в связи с клиническими особенностями и прогнозом заболевания, но и с точки зрения его дифференцированной терапии. В частности, эффективность и безопасность ИГКС для больных ХОБЛ существенно ассоциированы с выраженностью эозинофильного воспаления.
Эозинофилия при ХОБЛ как предиктор эффективности терапии ИГКС
Хорошо известно, что воспаление дыхательных путей является одним из ключевых патофизиологических механизмов ХОБЛ и, соответственно, важной мишенью для фармакологического воздействия. В связи с этим до недавнего времени добавление ИГКС к длительно действующим бронходилататорам рассматривалось в качестве обязательного шага терапевтического алгоритма для больных тяжелой и крайне тяжелой ХОБЛ [21]. В последние годы целесообразность назначения ИГКС в терапии ХОБЛ подвергается существенному пересмотру, поскольку влияние этой группы препаратов на легочное и системное воспаление неоднозначно [22]. Кроме того, в ряде исследований был обнаружен повышенный риск развития пневмонии и туберкулеза легких на фоне применения этого класса препаратов у больных с ХОБЛ [23,24]. Все вышеизложенное послужило предпосылкой для поиска новых терапевтических мишеней и анализа соотношения польза/риск для ИГКС при различных фенотипах ХОБЛ, в т.ч. его эозинофильном варианте.
Анализ данных двух рандомизированных исследований, в которых оценивались комбинированная терапия флутиказоном фуроатом и вилантеролом, а также монотерапия вилантеролом, свидетельствует о значительных различиях частоты обострений ХОБЛ, зависимых от исходного уровня эозинофилии крови в сравниваемых группах. При комбинированной терапии по сравнению с группой монотерапии вилантеролом частота обострений ХОБЛ в год у пациентов с уровнем эозинофилов в крови ≥2% снижалась на 29% (р
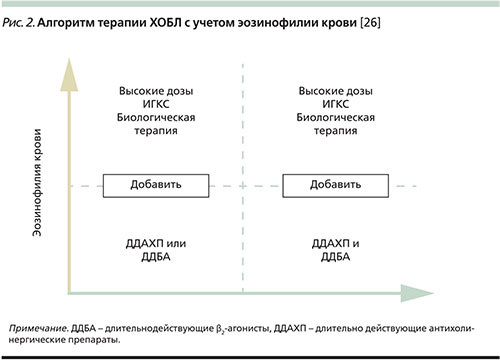
Полученные данные позволяют рассматривать уровень эозинофилов крови не только в качестве биомаркера более частых обострений ХОБЛ и предиктора их снижения на фоне терапии ИГКС, но и как индикатор, позволяющий прогнозировать высокую вероятность развития обострений ХОБЛ при отмене ИГКС. Результаты проведенных исследований еще раз подтверждают вывод, согласно которому исследование уровня эозинофилов периферической крови позволяет не только персонализировать терапию ХОБЛ, но и оптимизировать ее эффективность (рис. 2) [26]. Аналогичные алгоритмы терапии ХОБЛ, учитывающие уровень эозинофилии крови, в самое последнее время представлены и другими авторами [27, 28].
Анализируя взаимосвязь эозинофилии и обострений ХОБЛ, следует отметить, что повышенный уровень эозинофилов в периферической крови не только ассоциируется с более частыми обострениями, но и является предиктором их тяжести [29]. Так, у пациентов с эозинофилией крови ≥200 клеток/мкл и/или ≥2% риска повторных госпитализаций в течение 12 месяцев по поводу тяжелого обострения ХОБЛ или любых других состояний, требующих стационарного лечения, был значительно выше по сравнению с больными, у которых регистрировалось меньшее число эозинофилов для тяжелых обострений ХОБЛ и для госпитализаций по другим причинам (отношение шансов [ОШ]=3,59 [1,65–7,82]; p=0,0013) и (ОШ=2,32 [1,10–4,92]; p=0,0277) [29].
Эозинофильный фенотип ХОБЛ ассоциируется не только с повышением частоты обострений и их тяжести, но и с более быстрыми темпами снижения легочной функции. Это показал ретроспективный анализ эффективности ИГКС в исследовании ISOLDE: у больных ХОБЛ были выявлены существенные различия ежегодного снижения ОФВ1 в зависимости от исходного числа эозинофилов крови (рис. 3) [16]. У больных ХОБЛ с эозинофилией крови менее 2% терапия флутиказоном пропионатом по сравнению с группой плацебо не сопровождалась различиями показателей скорости снижения ОФВ1 – 54,2 и 51,3 мл/год соответственно (р=0,688), тогда как у пациентов с числом эозинофилов в крови ≥2% темпы падения легочной функции были существенно ниже в группе флутиказона пропионата, составив 33,9 мл/год по сравнению с показателем группы плацебо 74,5 мл/год (р=0,003).
Таким образом, анализ результатов приведенного исследования убедительно подтверждает мнение, cогласно которому для эозинофильного фенотипа ХОБЛ характерно более быстрое нарастание бронхиальной обструкции, тогда как терапия ИГКС позволяет значительно замедлять скорость прогрессирования заболевания при данном фенотипе болезни.

Также не менее важными представляются вопросы безопасности длительного применения ИГКС больными ХОБЛ в зависимости от уровня эозинофилии периферической крови. Проведенный мета-анализ 10 рандомизированных клинических исследований с участием 10 861 пациента, основной целью которого стало определение различий в отношении риска развития пневмонии у больных ХОБЛ с низким (
Более низкая частота пневмоний у пациентов с эозинофильным фенотипом ХОБЛ рассматривается специалистами с позиций активного участия эозинофилов в иммунно-воспалительных реакциях, опосредованных Тh-2-клетками, а также противоинфекционной активности эозинофильных гранулоцитов [30]. Соответственно, уменьшение числа эозинофилов может говорить о повышенной восприимчивости к инфекции или быть следствием недавно перенесенной инфекции. Кроме того, у пациентов с ХОБЛ и уровнем эозинофилов крови
Таким образом, эозинофильный фенотип ХОБЛ наряду с отмеченными выше клинико-функциональными особенностями заболевания характеризуется и клинически значимыми особенностями ответа на терапию ИГКС, уменьшающими в этой группе больных частоту обострений и снижающими темп прогрессирования бронхиальной обструкции.
Заключение
Приводимые в настоящем обзоре материалы свидетельствуют о существенном вкладе эозинофильного воспаления в клинические проявления ХОБЛ, включая и особенности терапевтического ответа, что позволяет рассматривать эозинофилию при ХОБЛ в качестве самостоятельной фенотипической характеристики заболевания.
Эозинофильный фенотип ХОБЛ, диагностируемый по уровню эозинофилии мокроты и/или крови, достаточно широко распространен и определяется примерно у трети больных. Эозинофильное воспаление в значительной степени модифицирует течение ХОБЛ, влияя на частоту обострений и темп прогрессирования обструктивных нарушений, что в конечном счете обусловливает и более высокую смертность в этой группе больных. Вместе с тем использование ИГКС в терапии эозинофильного фенотипа оказывает существенное влияние на эволюцию ХОБЛ, снижая частоту обострений и замедляя скорость прогрессирования заболевания.
Таким образом, выделение в клинической практике эозинофильного фенотипа ХОБЛ играет важную роль, поскольку не только детализирует клинические особенности заболевания, но и обосновывает целесообразность назначения ИГКС (в комбинации с ДДБА), что повышает эффективность лечения в данной группе больных.
1. Barnes P.J. The cytokine network in asthma and chronic obstructive pulmonary disease. J. Clin. Invest. 2008;118(11):3546–56.
2. Barnes P.J. Mechanisms in COPD: differences from asthma. Chest. 2000;117(Suppl. 2):10–4.
3. McDonald V.M., Higgins I., Wood L.G., Gibson P.G. Multidimensional assessment and tailored interventions for COPD: respiratory utopia or common sense? Thorax. 2013;68(7):691–94.
4. Leigh R., Pizzichini M.M., Morris M.M., Maltais F., Hargreave F.E., Pizzichini E. Stable COPD: predicting benefit from high-dose inhaled corticosteroid treatment. Eur. Respir. J. 2006;27(5):964–71.
5. Bafadhel M., Greening N.J., Harvey-Dunstan T.C., Williams J.E., Morgan M.D., Brightling C.E., Hussain S.F., Pavord I.D., Singh S.J., Steiner M.C. Blood Eosinophils and Outcomes in Severe Hospitalized Exacerbations of COPD. Chest. 2016;150(2):320–28.
6. Bafadhel M., McKenna S., Terry S., Mistry V., Reid C., Haldar P., McCormick M., Haldar K., Kebadze T., Duvoix A., Lindblad K., Patel H., Rugman P., Dodson P., Jenkins M., Saunders M., Newbold P., Green R.H., Venge P., Lomas D.A., Barer M.R., Johnston S.L., Pavord I.D., Brightling C.E. Acute exacerbations of chronic obstructive pulmonary disease: identification of biologic clusters and their biomarkers. Am. J. Respir. Crit. Care Med. 2011;184:662–71.
7. Singh D., Kolsum U., Brightling C.E., Locantore N., Agusti A., Tal-Singer R. Eosinophilic inflammation in COPD: prevalence and clinical characteristics. Eur. Respir. J. 2014;44:1697–700.
8. Cosio B.G., Soriano J.B., Lopez-Campos J.L., Calle-Rubio M., Soler-Cataluna J.J., de-Torres J.P. Defining the asthma – COPD overlap syndrome in a COPD cohort. Chest. 2015;307(8):980251.7
9. Negewo N.A., McDonald V.M., Baines K.J., Wark P.A., Simpson J.L., Jones P.W., Gibson P.G. Peripheral blood eosinophils: a surrogate marker for airway eosinophilia in stable COPD. Int. J. COPD. 2016;11:1495–504.
10. Eltboli O., Mistry V., Barker B., Brightling C.E. Relationship between blood and bronchial submucosal eosinophilia and reticular basement membrane thickening in chronic obstructive pulmonary disease. Respirology. 2015;20(4):667–70.
11. Westerhof G.A., Korevaar D.A., Amelink M., de Nijs S.B., de Groot J.C., Wang J., Weersink E.J., en Brinke A., Bossuyt P.M., Bel E.H. Biomarkers to identify sputum eosinophilia in different adult asthma phenotypes. Eur. Respir. J. 2015;46(3):688–96.
12. Zhang X.Y., Simpson J.L., Powell H., Zhang X.Y., Simpson J.L., Powell H., Yang I.A., Upham J.W., Reynolds P.N., Hodge S., James A.L., Jenkins C., Peters M.J., Lin J.T., Gibson P.G. Full blood count parameters for the detection of asthma inflammatory phenotypes. Clin. Exp. Allergy 2014;44(9):1137–45.
13. Fowler S.J., Tavernier G., Niven R. High blood eosinophil counts predict sputum eosinophilia in patients with severe asthma. J. Allergy Clin. Immunol. 2015;135(3):822–24.
14. Pavord I.D., Lettis S., Locantore N., Pascoe S., Jones P.W., Wedzicha J.A., Barnes N.C. Blood eosinophils and inhaled corticosteroid/long-acting β-2 agonist efficacy in COPD. Thorax. 2016;71:118–25.
15. Pascoe S., Locantore N., Dransfield M.T., Barnes N.C., Pavord I.D. Blood eosinophil counts, exacerbations, and response to the addition of inhaled fluticasone furoate to vilanterol in patients with chronic obstructive pulmonary disease: a secondary analysis of data from two parallel randomised controlled trials. Lancet Respir. Med. 2015;3:435–42.
16. Barnes N.C., Sharma R., Lettis S., Calverley P.M. Blood eosinophils as a marker of response to inhaled corticosteroids in COPD. Eur. Respir. J. 2016;47(5):1374–82.
17. Хроническая обструктивная болезнь легких. Клинические рекомендации. 2016. URL: https://spulmo.ru/obrazovatelnye-resursy/federalnye-klinicheskie-rekomendatsii/
18. Watz H., Tetzlaff K., Wouters E.F., Kirsten A., Magnussen H., Rodriguez-Roisin R., Vogelmeier C., Fabbri L.M., Chanez P., Dahl R., Disse B., Finnigan H., Calverley P.M. Blood eosinophil count and exacerbations in severe chronic obstructive pulmonary disease after withdrawal of inhaled corticosteroids: a post-hoc analysis of the WISDOM trial. Lancet Respir. Med. 2016;4(5):390–98.
19. Hospers J.J., Schouten J.P., Weiss S.T., Rijcken B., Postma D.S. Asthma attacks with eosinophilia predict mortality from chronic obstructive pulmonary disease in a general population sample. Am. J. Respir. Crit. Care Med. 1999;160:1869–74.
20. Hospers J.J., Schouten J.P., Weiss S.T., Postma D.S., Rijcken B. Eosinophilia is associated with increased all-cause mortality after a follow-up of 30 years in a general population sample. Epidemiology. 2000;11:261–68.
21. Global Strategy for the Diagnosis, Management, and Prevention of Chronic Obstructive Pulmonary Disease, Global Initiative for Chronic Obstructive Lung Disease (2010). www.goldcopd.org
22. Barnes P.J. Glucocorticosteroids: current and future directions. Br. J. Pharmacol. 2011;163(1):29–43.
23. Dong Y.H., Chang C.H., Lin Wu F.L., Shen L.J., Calverley P.M., Lofdahl C.G., Lai M.S., Mahler D.A. Use of inhaled corticosteroids in patients with COPD and the risk of TB and influenza: systematic review and meta-analysis of randomized controlled trials. a systematic review and meta-analysis of randomized controlled trials. Chest. 2014;145(6):1286–97.
24. Kew K.M., Seniukovich A. Inhaled steroids and risk of pneumonia for chronic obstructive pulmonary disease. Cochrane Database Syst. Rev. 2014;10(3):CD010115.
25. Magnussen H., Disse B., Rodriguez-Roisin R., Kirsten A., Watz H., Tetzlaff K., Towse .L, Finnigan H., Dahl R., Decramer M., Chanez P., Wouters E.F., Calverley P.M.; WISDOM Investigators. Withdrawal of inhaled glucocorticoids and exacerbations of COPD. N. Engl. J. Med. 2014;371(14):1285–94.
26. Pavord I.D., Agusti A. Blood eosinophil count: a biomarker of an important treatable trait in patients with airway disease. Eur. Respir. J. 2016;47(5):1299–303.
27. Hizawa N. LAMA/LABA vs ICS/LABA in the treatment of COPD in Japan based on the disease phenotypes. Int. J. Chron. Obstruct. Pulmon. Dis. 2015: 1093–102.
28. Kerwin E. A new alphabet for COPD care. Eur. Respir. J. 2016;48(4):972–75.
29. Couillard S., Larivee P., Courteau J., Vanasse A. Eosinophils in chronic obstructive pulmonary disease exacerbations are associated with increased readmissions. Chest. 2016: S0012-3692(16)60762-6.
30. Pavord I.D., Lettis S., Anzueto A., Barnes N. Blood eosinophil count and pneumonia risk in patients with chronic obstructive pulmonary disease: a patient-level meta-analysis. Lancet Respir. Med. 2016;4(9):731–41.
Автор для связи: И.Н. Трофименко – д.м.н., доцент кафедры клинической аллергологии и пульмонологии ИГМАПО – филиала ФГБОУ ДПО РМАНПО Минздрава РФ, Иркутск; e-mail: tin11@mail.ru
Источник
Эозинофильное воспаление при других легочных заболеваниях.Несмотря на то, что до сих пор некоторые авторы рассматривают БА как форму эозинофильного бронхита, следует учитывать, что эозинофилия мокроты и лаважной жидкости и даже наличие кристаллов ШаркоЛейдена сами по себе еще не доказывают БА, т.к. эти находки иногда встречаются у больных с обструктивной болезнью легких, при различных инфекциях, опухолях, эозинофильной пневмонии, лекарственной аллергии. При некоторых заболеваниях, протекающих с эозинофильным воспалением, типичным является бронхообструктивный синдром – симптоматический бронхоспазм, который следует дифференцировать с БА sui generis. Обструкция дыхательных путей у больных с атопией, индуцированной грибами, может протекать в двух формах: неосложненная астматическая реакция (грибковая БА), связанная с высоким уровнем грибных спор и проявляющаяся ТН-2-типом клеточного ответа с опосредованным IgE реакциями, и более сложная реакция, при которой происходит колонизация эпителия вирулентными грибами, продуцирующими протеазы (бронхолегочный аспергиллез). При этом стимулируется иммунный ответ, включающий синтез всех субклассов антител направленных против микроорганизмов, происходит усиленная инфильтрация эозинофилами дыхательных путей, повреждение эпителия и подлежащей легочной ткани, в частности белкового матрикса легочной паренхимы, протеазами грибов и дегранулирующими эозинофилами, что в условиях, например, недостаточной терапии глюкокортикоидами приводит к формированию бронхоэктазов на фоне отсутствия полноценной элиминации грибов. Легочная эозинофилия и бронхообструктивный синдром встречаются при синдроме Черджа-Стросса (Churg-Strauss), при коллагеновых сосудистых болезнях, что доказывает важную роль сосудистых изменений (иммунного васкулита) в генезе бронхоспазма.
Легочную эозинофилию и IgE опосредованные реакции вызывает легочная стадия миграции некоторых гельминтов, например аскарид. Наиболее значительное повышение уровня IgE и легочная эозинофилия встречается при так называемой тропической эозинофилии у больных филяриозом. Большинство легочных эозинофилии характеризуется инфильтрацией легочной ткани, фокальными ателектазами и бронхообструктивный синдромом, связанным с гиперчувствительностью немедленного тина или (реже – при иммунных васкулитах) с иммунокомплексной реакцией. В ряде случаев легочная эозинофилия и сочетающаяся с ней эозинофилия периферической крови протекают без признаков гиперчувствительности и без развития НГБ, например при эозинофильной пневмонии, гистиоцитозе X. Идиопатические эозинофильные пневмонии делят на острые и хронические. Они отличаются не только по характеру клинического течения (острое начало, возможность спонтанного улучшения и отсутствие рецидивов, с одной стороны, и персистирующее течение, возможность рецидивов и необходимость стероидной терапии – с другой), но также по характеру воспаления в бронхах: лимфоцитарно-эозинофильное – при острой эозинофильной пневмонии и преимущественно эозинофильное со значительным повышением уровня эозинофилов при хронической эозинофильной пневмонии, что может свидетельствовать об их различном патогенезе, в частности, предполагается гиперчувствительность к некоторым ингалируемым антигенам у больных с атопией как причина острой эозинофильной пневмонии. Вопреки высказываемой ранее точке зрения об отсутствии проявлений атопии у больных с хронической эозинофильной пневмонией сейчас показано, что не менее 50% таких больных имеют в анамнезе бронхиальной астмы, полипоз носа, аллергический ринит или лекарственную аллергию. Легочную эозинофилию со значительным повышением количества эозинофилов в лаважной жидкости и в периферической крови иногда вызывают лекарства (сульфаниламиды, противомалярийные препараты, антибиотики и др.), при этом возникает легочная инфильтрация, быстро и, как правило, бесследно исчезающая после прекращения приема соответствующего препарата и терапии глюкокортикоидами. Вероятно, больные с острой и хронической идиопатической эозинофильной пневмонией и лекарственными пневмонитами, несмотря на объединяющее их эозинофильное воспаление бронхов, представляют весьма гетерогенную группу: у одних больных возникает НГБ и бронхообструктивный синдром, у других – нет. В основе этих различий лежат разнообразные первичные биологические дефекты, отличающиеся в каждой группе больных: степень активации тех или иных клеток воспаления, спектр выделяемых ими цитокинов, особенности экспрессии различных рецепторов и молекул адгезии и др. Во всяком случае, четко объяснить, почему при сходстве клинической картины, например, у больных бронхиальной астмой иногда имеется эозинофильное воспаление, а иногда его нет, почему эозинофильное воспаление не всегда вызывает НГБ и бронхообструкцию и какие условия для этого являются необходимыми и достаточными, в настоящее время затруднительно. – Также рекомендуем “Неэозинофильные варианты воспаления бронхов у больных бронхиальной астмой.” Оглавление темы “Роль гормонов и биологически активных веществ в воспалении бронхов.”: |
Источник
