Как лечить воспаление после операции

Послеоперационная серома – это скопление серозной жидкости в зоне шва, обусловленное травматизацией мягких тканей. Является осложнением хирургических вмешательств. Рассасывается самостоятельно либо принимает хроническое течение. Проявляется припухл остью в области шва, чувством распирания, неприятными ощущениями и эффектом переливания жидкости при перемене положения тела. При крупных серомах наблюдаются нарушение общего состояния, субфебрилитет. Патология может осложняться инфицированием, формированием некроза. Лечение – пункции или дренирование с активной аспирацией на фоне медикаментозной терапии. В отдельных случаях требуются повторные операции.
Общие сведения
Послеоперационная серома (серома шва) – распространенное осложнение раннего послеоперационного периода. Чаще всего встречается в общей хирургии, маммологии, онкологии и пластической хирургии. По различным данным, частота образования клинически значимых сером после операций, сопровождающихся значительной отслойкой мягких тканей, колеблется от 0,8% до 80% и более. Осложнение может развиваться у пациентов любого возраста и пола, чаще встречается у женщин средней и старшей возрастной группы.
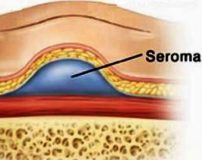
Послеоперационная серома
Причины
Серома является полиэтиологическим состоянием, рассматривается как осложнение обширных хирургических вмешательств. Некоторые специалисты придерживаются мнения, что скопление жидкости в проекции послеоперационной раны нельзя считать осложнением, поскольку оно представляет собой нормальный процесс заживления в фазе экссудации.
В подтверждение своей точки зрения ученые приводят данные ультразвуковых исследований, согласно которым послеоперационные серомы (в том числе – клинически незначимые) обнаруживаются у 100% пациентов. Основными провоцирующими факторами образования крупных сером, требующих проведения активных лечебных мероприятий, являются:
- значительная отслойка жировой клетчатки;
- большая раневая поверхность;
- грубые хирургические манипуляции с тканями (многочисленные разрезы, захват раздавливающим инструментом и пр.);
- чрезмерное использование коагуляции;
- большая толщина подкожной жировой клетчатки (более 5 см).
К числу предрасполагающих условий относят индивидуальные особенности организма, нарушения иммунитета, сахарный диабет и хронические соматические заболевания, негативно влияющие на процесс заживления раны. Чаще всего послеоперационные серомы образуются после абдоминопластики, герниопластики, маммопластики, мастэктомии, аппендэктомии, холецистэктомии. При использовании имплантатов имеет значение раздражение окружающих тканей и развитие асептического воспаления вследствие контакта с эндопротезом.
Патогенез
Существуют различные точки зрения на патогенез сером. Согласно наиболее популярной, обширные разрезы, отслойка мягкотканных структур, раздавливание или прижигание тканей и другие факторы вызывают значительные повреждения мелких лимфатических сосудов. Лимфатические сосуды тромбируются медленнее кровеносных, в результате лимфа долгое время изливается в ткани. На этапе экссудации жидкая часть крови выходит за пределы кровеносных сосудов, что увеличивает количество жидкости в тканях.
В полостях, возникших в области послеоперационной раны, скапливается соломенно-желтая жидкость, содержащая макрофаги, тучные клетки, лейкоциты и белковые фракции. В норме эта жидкость асептическая. При попадании микроорганизмов возможно нагноение с формированием абсцесса. Крупные скопления жидкости оказывают давление на окружающие ткани, нарушают кровоснабжение, вследствие чего могут образовываться участки некроза по краю швов.
Классификация
В клинической практике используют классификацию, в основе которой лежит необходимость и тактика лечения патологии. Согласно этой систематизации выделяют три группы послеоперационных сером:
- 1 группа. Асимптоматические образования, не требующие проведения лечебных мероприятий.
- 2 группа. Симптоматические серомы, для устранения которых достаточно пункций или активного дренирования.
- 3 группа. Симптоматические скопления жидкости, требующие проведения повторной операции.

Серома шва
Симптомы послеоперационной серомы
Маленькие образования не вызывают неприятных ощущений и нарушений общего состояния. Единственными признаками серомы являются припухлость и положительный симптом флюктуации в области послеоперационных швов. Иногда пациенты отмечают ощущение переливания жидкости во время изменения положения тела. Гиперемия кожи в зоне швов обычно отсутствует.
Больные с крупными серомами жалуются на неинтенсивную тянущую боль, чувство давления или распирания, которые усиливаются в положении стоя. В проекции швов выявляется валикообразная флюктуирующая припухлость. Длина припухлости обычно совпадает с длиной шва, ширина может варьироваться от 2-3 до 10 и более сантиметров. Возможны локальная гиперемия, слабость, утомляемость, повышение температуры тела до субфебрильных цифр.
Осложнения
Наиболее серьезным осложнением является нагноение серомы. При большом количестве жидкости формируются крупные абсцессы. Возможно расплавление подлежащих тканей с развитием перитонита. У некоторых больных развивается сепсис. Некрозы при серомах, как правило, протекают более благоприятно, захватывают небольшие участки тканей в области швов. Хронические серомы ухудшают качество жизни, существенно увеличивают период нетрудоспособности после операций.
Диагностика
Обычно серомы развиваются в период стационарного послеоперационного лечения, поэтому диагноз выставляется лечащим врачом. Диагностика базируется на данных объективного осмотра, при необходимости назначаются дополнительные исследования. Программа обследования может включать:
- Физикальный осмотр. В пользу серомы свидетельствует наличие ограниченного выбухания тканей в сочетании с положительным симптомом флюктуации. При отсутствии инфицирования гиперемия не выявляется или незначительная, пальпация малоболезненна. При инфицировании кожа багрово-синюшная, ощупывание резко болезненно, определяется плотный отек окружающих тканей.
- УЗИ мягких тканей. Показано для подтверждения диагноза при сомнительном симптоме флюктуации, для уточнения размеров крупных сером на этапе подготовки к хирургическому вмешательству. Свидетельствует о наличии полости, заполненной жидкостью.
- Лабораторные анализы. Для изучения характера содержимого серомы проводят цитологическое исследование. При подозрении на инфицирование выполняют бакпосев жидкости для определения возбудителя, назначают общий анализ крови для оценки выраженности воспаления.

Тактика лечения зависит от размеров серомы, наличия признаков инфицирования
Лечение послеоперационной серомы
Лечение осуществляется в стационарных условиях. При крупных образованиях, отсутствии признаков рассасывания показана комплексная терапия, включающая в себя консервативные и оперативные мероприятия.
Консервативная терапия
Целью консервативного лечения является снижение вероятности инфицирования, устранение асептического воспаления, уменьшение количества жидкости. Применяются медикаменты следующих групп.
- Антибиотики. При отсутствии нагноения пациентам для профилактики назначают препараты широкого спектра действия внутримышечно. При появлении признаков инфицирования план антибиотикотерапии корректируют с учетом чувствительности возбудителя.
- НВПС. Нестероидные противовоспалительные средства уменьшают проявления воспаления и количество жидкости, выделяющейся в просвет полости послеоперационной серомы. Возможно внутримышечное введение или пероральный прием.
- Глюкокортикоиды. Гормональные препараты устраняют асептическое воспаление, блокируют образование жидкости. Медикаменты вводят в полость серомы после удаления жидкости.
Хирургическое лечение
Тактика хирургического лечения определяется размерами серомы, эффективностью лечебных мероприятий на предыдущих стадиях. При неосложненных серомах возможны следующие варианты:
- Пункции. Наиболее простой способ удаления жидкости. Выполняется 1 раз в несколько дней, для полного излечения обычно требуется 3-7 пункций.
- Активная аспирация. При неэффективности пункций, значительном объеме серомы в полость образования устанавливают дренаж с устройством для активной аспирации.
- Реконструктивные операции. Показаны при упорном хроническом течении сером, отсутствии результата после лечения более щадящими способами.
При нагноившихся серомах производится вскрытие, дренирование гнойной полости. При образовании участков некроза проводят перевязки до отторжения струпа и полного заживления раны. Все хирургические методы применяют на фоне консервативной терапии.
Прогноз
Прогноз в большинстве случаев благоприятный. Небольшие серомы нередко рассасываются самостоятельно в течение 1-2 недель. Эффективность пункций при серомах на фоне плановых пластических и абдоминальных операций составляет около 90%. Реконструктивные вмешательства требуются редко. Процент нагноений незначительный, осложнение чаще развивается после экстренных операций, при наличии сопутствующей патологии, излишнем весе.
Профилактика
Профилактические мероприятия включают тщательную оценку риска хирургических вмешательств, детальное предоперационное обследование, соблюдение техники проведения операций. Хирургам необходимо воздерживаться от слишком широких разрезов, грубых манипуляций с тканями, чрезмерного использования коагулятора.
Источник
Сергушев С.Г.
Что мы понимаем под термином «воспаление»? Воспаление – это типический патологический процесс, развивающийся при повреждении тканей и проявляющийся нарушением кровообращения, изменением крови и соединительной ткани в виде альтерации, экссудации и пролиферации. Само понятие «воспаление» гораздо старше, чем само человечество, поскольку воспалительная реакция уже существовала, когда на Земле появились первые многоклеточные организмы. Признаки воспаления описаны еще в древности Цельсом и Галеном. Они дали основные признаки, которые хорошо известны, и их учат еще студенты:
• tumor (припухлость, отек),
• rubor (жар, температура),
• calor (покрасненние),
• dolor (боль),
• functio laesa.
Этиологические причины воспаления. Любая причина, по силе и длительности превосходящая адаптационные возможности ткани, вызывает воспаление. Причины воспаления (флогогенные факторы) могут быть двух видов: внешние и внутренние.
Флогогенные факторы: экзогенные (внешние) – ‘микроорганизмы (бактерии, вирусы, грибы), животные организмы (простейшие, черви, насекомые), химические вещества (кислоты, щелочи), механические (инородные тела, травма) и термические воздействия (холод, тепло), лучевая энергия (рентгеновские, ультрафиолетовые лучи). Эндогенные (внутренние) факторы – это факторы, возникающие в самом глазу в результате иного заболевания (опухоль, отслойка сетчатки, глаукома, диабет, аутоиммунные заболевания).
Каковы же механизмы начала, развития и исхода процесса воспаления? Прежде всего это повреждение от действия флогогенного агента (первичная альтерация), которая вызывает выброс из клеток и образование биологически активных веществ – медиаторов воспаления, освобождение и активацию лизосомальных ферментов, действие их на биологические макромолекулы (вторичная альтерация), которые в свою очередь вызывают нарушения микроциркуляции, повышение проницаемости стенок сосудов, экссудацию. Все это приводит к размножению клеток (пролиферация) и ликвидации дефекта.
Итак, стадии воспаления:
• альтерации (повреждения): первичная, вторичная;
• экссудации и эмиграции;
• пролиферации и репарации: пролиферация, завершение воспаления.
Хотелось бы остановиться на общих принципах терапии, которые применяются в разработке практически любой схемы лечения. Лечение должно быть, прежде всего, этиотропным, направленным на устранение причины или этиологического фактора; патогенетическим, направленным на прерывании самих процессов воспаления; саногенетическим, т.е. обращать внимание нужно не только на тот орган, который мы лечим и непосредственно на который жалуется пациент, а лечить весь организм в целом; и симптоматическим, направленным на подавление патологических симптомов (жар, боль и т.д.).
Какие противовоспалительные средства сейчас существуют? Прежде всего, это нестероидные противовоспалительные средства (НПВС); стероидные противовоспалительные средства (СПВС) и противовоспалительные средства медленного действия, или средства так называемой «базисной» терапии. В патогенезе некоторых воспалительных (как правило, системных) заболеваний существенную роль играет гиперчувствительность замедленного типа. В ее осуществлении участвуют цитотоксические Т-лимфациты, разрушающие клетки, имеющие на своей поверхности антигены.
При лечении этих заболеваний и применяются базисные средства, для которых характерно развитие медленного эффекта – через несколько месяцев после начала лечения (делагил, пенициллинамин, препараты золота), цитостатики, а также циклоспорины.
Хотелось бы коротко сказать о стероидах. Плюсами стероидной терапии являются очень мощный противовоспалительный эффект, антипролиферативный эффект и иммуносупрессия. Правда, минусов больше. Прежде всего, это повышение внутриглазного давления (ВГД) при длительном их использовании, замедление регенерации и как следствие, возникновение трофических язв роговицы, ухудшение течения вирусных заболеваний, поскольку возникает иммуносупрессия, помутнение хрусталика, так называемая «стероидная» катаракта, как правило, при пероральном применении стероидных препаратов, также возможно помутнение стекловидного тела и нарушение аккомодации.
На рис. 1 как пример показаны формулы стероидов, которые вырабатываются собственно в организме, и какой процесс происходит, пока они достигают конечной точки. Это сложные биохимические реакции, занимающие достаточно долгое время и требующие больших энергетических затрат.
Нестероидные противовоспалительные препараты. НПВС ингибируют циклооксигеназный (ЦОГ) путь, препятствуя образованию простагландинов, которые являются основным фактором развития воспалительного процесса после хирургического вмешательства, в основном по поводу катаракты и развития кистозного макулярного отека (КМО).
Сочетанное применение кортикостероидов и НПВС показало синергическое взаимодействие, поскольку места приложения у этих групп препаратов разные.
Стойкий миоз способен существенно осложнить работу хирурга в ходе операции по удалению катаракты, затрудняя ход хирургической процедуры.
Всем хирургам хорошо известна ситуация, представленная на рис. 2.
Несмотря на применение мидриатиков, проведение хирургом всех возможных технических приемов, зрачок остается узким, и это осложняет всю дальнейшую работу. Применяются различные устройства, которые помогают справиться с мидриазом, но механическое воздействие достаточно травматично для радужки и осложняет течение послеоперационного процесса. Применение до операции НПВС способно существенно помочь в уменьшении интраоперационного миоза.
Вторая точка приложения – это лечение воспаления. НПВС часто назначаются совместно со стероидами для лечения воспалительного процесса, спровоцированного оперативным лечением глаз. Стероиды регулируют экспрессию клеточных белков, что ведет к снижению метаболизма арахидоновой кислоты и, как следствие, к снижению синтеза простагландинов, которые являются основными в этом процессе.
Третья точка приложения – это предупреждение КМО. КМО является самой частой причиной снижения зрения после рутинных операций по удалению неосложненной катаракты. По оценкам ряда авторов, возникает у 12% пациентов из группы низкого риска, перенесших хирургию катаракты.
Развитие КМО обуславливается нарушением внутреннего гематоретинального барьера из-за воздействия простагландинов.
Факторы риска возникновения КМО:
• предшествующее воспаление глаза;
• проблемы с эпиретинальной или витреоретинальной мембраной;
• диабетическая ретинопатия;
• сосудистые болезни глаз или сердечно-сосудистые заболевания;
• наличие в анамнезе пигментного ретинита.
У пациентов, подверженных повышенному риску возникновения КМО, профилактическое лечение необходимо начать раньше и продолжать на протяжении более длительного периода времени.
На рис. 3 показаны тракции витреомакулярной зоны, которые очень часто трудно диагностировать при осмотре глазного дна, тем более, если у пациента имеется серьезное помутнение хрусталика.
Все это приводит к развитию патологии в центральном отделе. Сами по себе нестероидные средства, конечно, такие тракции не убирают, и требуется последующая витреоретинальная хирургия.
«Терапевтическое» решение этой проблемы представила компания Алкон, впервые продемонстрировав препарат JETREA (OCRIPLASMIN).
Первое именно фармакологическое лечение витреомакулярных тракций у взрослых, включая пациентов с макулярными отверстиями менее 400m. Вводится он интравитреально и как фермент позволяет убрать тракции из витреомакулярной зоны.
Как правильно применять НПВС?
Адекватное применение НПВС максимизирует эффективность лечения и минимизирует осложнения (рис. 4-5). Адекватное применение подразумевает применение в течение 4-х недель после операции по удалению катаракты для профилактики КМО с ограничением применения у пациентов с поврежденной роговицей. Это особенно актуально для пациентов, перенесших ФРК.
Также их нужно с осторожностью применять у пациентов с выраженным синдромом «сухого глаза». НПВС после рефракционных операций используются в первую очередь для обеспечения анальгезирующего эффекта, использование после операции должно быть немедленным и не должно применяться в течение всего процесса заживления эпителиальных ран.
Хотелось бы остановиться на том, что нового в этом направлении мы сегодня получили для клинической практики. Офтальмологическая суспензия непафенака 0.1%, коммерческое название НЕВАНАК®. Показанием является лечение боли и воспаления после хирургии катаракты. Режим дозирования: одна капля 3 раза в день за день до операции, в день хирургического вмешательства и в течение 14 дней после него. Это первое и единственное нестероидное пролекарство для применения в офтальмологии.
В состав входит консервант: 0.005% бензалкония хлорид. К сожалению, без консерванта обойтись нельзя, но тем не менее компании удалось поддержать физиологическое значение pH: 7.4, поэтому неприятных ощущений от применения данного препарата у пациента нет.
Что такое пролекарство? Это такое «модное» понятие, которое на самом деле известно в медицине с давних пор. Начало было положено Буссом в 1875 г., когда был применен салицилат Na в лечении ревматических синдромов. Сам по себе салицилат Na был достаточно агрессивен, вызывая язвенные поражения ЖКТ. Чтобы избежать таких осложнений, Дрессером в 1899 г., т.е. почти 20 лет спустя, было получено пролекарство – ацетилсалициловая кислота, которую мы до сих пор успешно применяем. Еще один пример пролекарства. Paul Ehrlich в 1909 г. предлагает сольварсан – это суспензия, которая применялась при лечении сифилиса. Препарат содержал мышьяк. От этого препарата были тяжелые токсические последствия. Carl Voegtlin в 1925 г. предложил препарат мафарсен, который также являлся пролекарством и не имел таких тяжелых патологических последствий на организм и успешно применялся вплоть до наступления эры антибиотиков.
На рис. 6 показана пролекарственная структура и ее метаболическая трансформация. Непафенак преобразуется в мощный ингибитор фермента циклооксигеназы амфенак гидролазами глазной ткани .
Сам по себе непафенак достаточно мягкий препарат, но с помощью гидролазы глазной ткани превращается в мощный блокатор циклооксигеназной системы. Поскольку препарат работает вместе с гидролазами глазной ткани, он самостоятельно оптимизирует свое действие: при введении в глаз непафенак метаболизируется внутриглазными тканями, т.е. он проходит роговицу, попадает в радужку и цилиарное тело, затем также беспрепятственно проникает в задний отрезок глаза.
Итак, пролекарственная формула нового поколения минимизирует возникновение токсичности, и главное, на что бы я хотел обратить внимание, это минимальная системная абсорбция, в 1700 раз меньше разовой пероральной дозы, когда наступает клинический эффект.
На рис. 7 показана скорость проникновения непафенака в роговицу по сравнению с другими известными препаратами, например, с часто встречающимся на рынке диклофенаком. По шкале см/с видно, что он проникает быстрее почти в 3 раза, сильно опережая по проницаемости все остальные препараты.
Эффективность в передней камере глаза. В 2000 г. было проведено Gamache D.A. исследование по оценке противовоспалительного эффекта непафенака 0.1% в сравнении с диклофенаком 0.1%. Результаты представлены на рис. 8. Это продукция простагландинов в радужке и цилиарном теле новозеландских кроликов-альбиносов после разовой местной дозы. Видно, как непафенаком подавляется продукция простагландинов в отличие от диклофенака.
Также была проведена оценка противовоспалительной эффективности среди пациентов, проходящих хирургию катаракты. На рис. 9 показан процент клинического выздоровления при осмотре на 1, 3, 7, 14-й дни после операции. Оранжевые столбики – это группа плацебо, желтые – пациенты, получавшие суспензию Неванак®. Практически все (90% случаев) имели клиническое выздоровление уже на 14-е сутки в отличие от групп плацебо (около 30%).
На рис. 10 показан процент пациентов без жалоб на боль в послеоперационном периоде. Уже на первый день после операции группа пациентов, получавших непафенак, в 2 раза превышала результаты группы плацебо. На 3-й день боль исчезла у 90% пациентов, получавших непафенак в отличие от контрольной группы.
На заднем отрезке глаза также было проведено исследование, было показано мощное ингибирующее действие. Препарат направленно воздействует на циклооксигеназу внутриглазной ткани (COX-1: конституционный синтез тромбоцитами; COX-2: индуцированный цитокином (ИЛ-1(3)), воздействуя на все зоны гематоофтальмического барьера.
Метаболический путь этого препарата схож с метаболизмом арахидоновой кислоты. Он одинаково ингибирует все простагландины (PGE2, PG12) радужки и цилиарного тела ( PGF2g, PGA1, PGD2), подавляет синтез простагландина E2 (PGE2) в сетчатке и ингибирует нарушение гематоретинального барьера.
Оценивалась эффективность этого препарата и в профилактике отека сетчатки, способность местных форм непафенака, кеторолака и диклофенака предотвращать развитие индуцированного отека сетчатки.
На рис. 11 показано сокращение количества протеинов в стекловидном теле в сравнении с группой контроля. Нельзя сказать, что диклофенак или кеторолак в данном случае не работают. Работают, но гораздо менее эффективней по сравнению с группой, получающей непафенак. И уменьшение количества PGE2 в стекловидном теле также показывает, что это средство почти в 200 раз эффективней диклофенака (рис. 12).
Хочу рассказать о некоторых особенностях Неванака, которые мы получили, начав его применение в клинической практике. Прежде всего его необходимо хорошо встряхивать, поскольку это эмульсия. К сожалению, это чудо-лекарство применяется только у взрослых, т.е. с 18 лет. Не рекомендуется его применение во время беременности и лактации, поскольку таких исследований не проводилось. Также нужно обратить внимание на пациентов, принимающих ТРОМБО АСС. Это достаточно большая группа, особенно пожилых пациентов с сердечно-сосудистыми заболеваниями, поскольку может быть некий синергизм воздействия этих препаратов. Также с Рис. 9. Процент клинического выздоровления при каждом осмотре Рис. 10. Процент пациентов без жалоб на боль осторожностью надо применять этот препарат пациентам с синдромом «сухого глаза». Но для таких пациентов у компании Алкон есть неплохая линейка препаратов, которая позволяет бороться и с этим недугом. Также среди некоторых особенностей неванака хотелось бы отметить противодействие между хорошо известными противоглаукомными средствами простагландинового ряда и нашим противовоспалительным препаратом. Кто кого победит, сказать трудно, но в своей практике мы стараемся некоторое время избегать применения таких препаратов у пациентов, которые готовятся к катарактальной хирургии, но потом назначаем снова, как правило, повышения давления за это время не возникает.
Выводы:
• В клиническую практику вошел новый препарат в виде пролекарственной формы;
• На до- и постмаркетинговом этапе проведены многочисленные плацебоконтролируемые исследования, доказавшие его высокую проницаемость, прицельность действия, эффективность и безопасность;
• Высокоэффективен в противовоспалительной терапии, купировании болевого синдрома, поддержании мидриаза во время ФЭК, профилактике и купировании КМО;
• Хорошо сочетается со стероидными противовоспалительными средствами;
• Доступен для поликлинической и стационарной практики.
Источник
