Клетки при хроническом воспалении
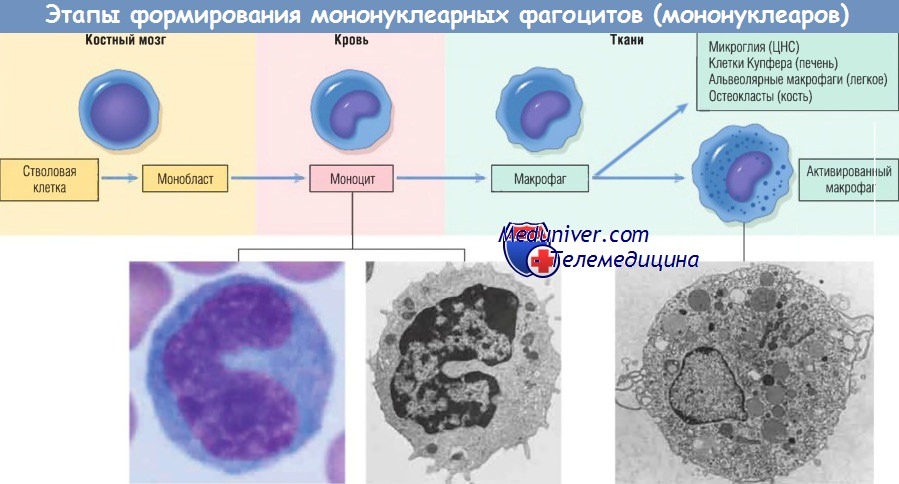
Клетки участвующие в хроническом воспалении – макрофаги и другие клетки
Макрофаг — главная клетка, участвующая в процессе хронического воспаления. Макрофаги являются частью системы мононуклеарных фагоцитов (иногда называемой ретикулоэндотелиальной системой), состоящей из клеток, близкородственных клеткам костного мозга, включая моноциты и тканевые макрофаги.
Тканевые макрофаги диффузно разбросаны по соединительной ткани или расположены в таких органах, как печень (клетки Купфера), селезенка и лимфатические узлы (гистиоциты синусов), легкие (альвеолярные макрофаги), а также в ЦНС (микроглия). Мононуклеарные фагоциты происходят из клеток-предшественников костного мозга, которые дифференцируются в моноциты. Из крови моноциты мигрируют в разные ткани и дифференцируются в макрофаги.
Период полужизни моноцитов длится около 1 дня, когда как период жизни тканевых макрофагов составляет несколько месяцев или лет. Превращение стволовой клетки костного мозга в тканевый макрофаг регулируется различными факторами роста и дифференцировки, цитокинами, молекулами адгезии и клеточными взаимодействиями.
Моноциты начинают мигрировать во внесосудистые ткани на ранних стадиях развития острого воспаления и в течение 48 час могут стать доминирующим типом клеток инфильтрата. Экстравазация моноцитов управляется теми же стимулами, которые участвуют в миграции нейтрофилов и представлены молекулами адгезии и химическими медиаторами с хемотаксическими и активирующими свойствами.
При попадании моноцита во внесосудистую ткань он подвергается трансформации в большую фагоцитарную клетку — макрофаг. Макрофаги активируются различными стимулами, включая микробные продукты, активирующие TLR и другие клеточные рецепторы, цитокины (например, IFN-y), секретированные сенсибилизированными Т-лимфоцитами и естественными клетками-киллерами, и другие химические медиаторы.
В результате активации макрофагов происходят элиминация таких повреждающих агентов, как микробы, и инициация процессов репарации, а также повреждение ткани (при хроническом воспалении).

Активация макрофагов приводит также к повышению уровней лизосомных ферментов и активных форм кислорода и азота, продукции цитокинов, факторов роста и других медиаторов воспаления. Некоторые из этих продуктов токсичны для микробов и организма (например, активные формы кислорода и азота) или ВКМ (протеазы); другие вызывают миграцию клеток (например, цитокины, хемотаксический стимул); третьи влияют на пролиферацию фибробластов, отложение коллагена и ангиогенез (например, факторы роста).
Разные популяции макрофагов выполняют различные функции: некоторые необходимы при киллинге микробов и воспалении, другие очень важны при репарации.
Впечатляющий арсенал медиаторов делает макрофаги мощным союзником организма в защите от непрошеных гостей, но в то же время при неправильной активации макрофаги могут вызывать значительное разрушение ткани, которое является одним из признаков хронического воспаления. Процесс разрушения ткани сам по себе может активировать каскад воспалительной реакции, поэтому одновременно могут присутствовать признаки и острого, и хронического воспаления.
При недолгом процессе воспаления, если стимул удален, макрофаги в итоге либо умирают, либо уходят в лимфатические сосуды и лимфоузлы. При хроническом воспалении происходит накопление макрофагов в результате их мобилизации из кровотока и местной пролиферации в очагах воспаления.
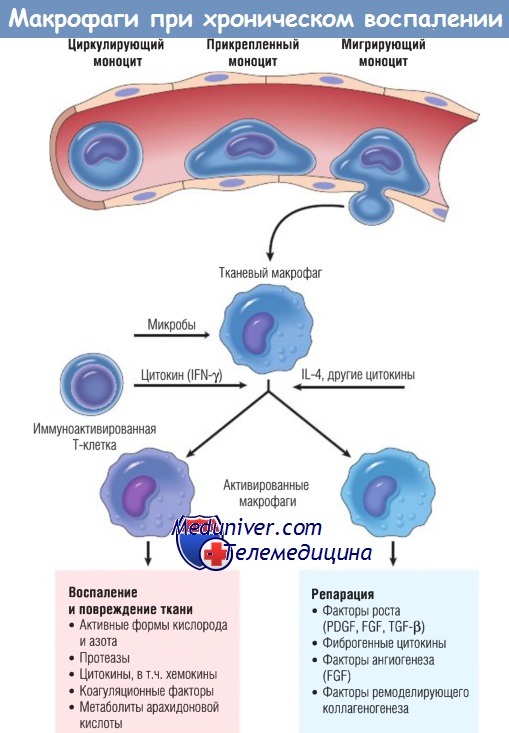
Роль активированных макрофагов при хроническом воспалении.
Макрофаги активируются неиммунными стимулами, например эндотоксином, или цитокинами из иммуноактивированных Т-клеток (особенно IFN-y).
Перечислена продукция активированных макрофагов.
FGF — фактор роста фибробластов; IFN — интерферон; IL — интерлейкин;
PDGF — тромбоцитарный фактор роста; TGF — трансформирующий фактор роста.
В развитии хронического воспаления участвуют и другие типы клеток: лимфоциты, клетки плазмы крови, эозинофилы и тучные клетки:
– лимфоциты мобилизуются в ходе как антителоопосредованных, так и клеточно-опосредованных иммунных реакций. Антиген-стимулированные лимфоциты (эффекторные клетки и клетки памяти) различных типов (Т- и В-клетки) используют разные пары адгезивных молекул (селектинов, интегринов и их лигандов) и хемокины для миграции в очаг воспаления. Цитокины активированных макрофагов, в основном TNF, IL-1 и хемокины, усиливают мобилизацию лейкоцитов, запуская стадию персистенции воспалительной реакции.
Лимфоциты и макрофаги взаимодействуют по реверсивному типу, что играет важную роль в развитии хронического воспаления. Макрофаги презентируют антигены Т-клеткам и продуцируют мембранные молекулы (костимуляторы) и цитокины (например, IL-12), которые стимулируют ответ Т-клеток. Активированные Т-клетки продуцируют цитокины, некоторые из которых мобилизуют моноциты из кровотока, и IFN-y — мощный активатор макрофагов. В результате этих взаимодействий Т-клеток и макрофагов в воспалительную реакцию вовлекается иммунная система, что делает реакцию хронической и тяжелой. Термин «иммунное воспаление» отражает наличие выраженного иммунного компонента в воспалительном процессе, например ответа Т- и В-клеток;
– клетки плазмы крови образуются из активированных В-клеток и продуцируют антитела, направленные либо против персистирующих чужеродных или собственных антигенов в очаге воспаления, либо против компонентов поврежденной ткани. При некоторых сильных воспалительных реакциях скопление лимфоцитов, антигенпрезентирующих клеток и клеток плазмы крови может напоминать морфологическое строение лимфоидного органа, особенно лимфоузла, содержащего хорошо сформированные герминативные центры.
Подобные очаги скопления лимфоцитов называют третичными лимфоидными органами. Такой тип лимфоидного органогенеза часто встречается в синовиальных оболочках у пациентов, длительно страдающих ревматоидным артритом;
– эозинофилами изобилуют иммунные реакции, опосредованные IgE и паразитарными инфекциями. Особо важный хемокин для мобилизации эозинофилов — эотаксин. Эозинофилы содержат гранулы, имеющие главный основной белок (высокоактивный катионный белок), который токсичен для паразитов, но может вызвать лизис эпителиальных клеток млекопитающих. Таким образом, эозинофилы контролируют паразитарные инфекции, но также участвуют в повреждении ткани при иммунных реакциях, например аллергии;
– тучные клетки широко распространены в соединительных тканях по всему телу и могут участвовать как в острых, так и в хронических воспалительных реакциях. Тучные клетки экспрессируют на своей поверхности рецептор FceRI, связывающийся с Fc-фракцией антитела IgE. При реакции гиперчувствительности немедленного типа антитела IgE связываются с клеточными Fc-peцепторами, специфично распознающими антиген, клетка дегранулируется и высвобождает медиаторы — гистамин и простагландины. Этот тип ответа наблюдается при пищевой аллергии, укусах насекомых, лекарственной аллергии, иногда с ужасающими исходами (например, анафилактическим шоком).
Тучные клетки тоже присутствуют при реакциях хронического воспаления и секретируют множество цитокинов, т.е. они способны как усиливать, так и ограничивать воспалительную реакцию в разных ситуациях.
Как правило, присутствие нейтрофилов характерно для острого воспаления, но и при многих формах хронического воспаления, длящегося месяцами, выявляется большое количество нейтрофилов, индуцированных либо персистирующими микробами, либо медиаторами, продуцированными активированными макрофагами и Т-лимфоцитами. При хронических бактериальных инфекциях костей (остеомиелите) нейтрофильный экссудат может сохраняться многие месяцы. Нейтрофилы также важны при хроническом воспалении в легких, индуцированном курением или другим стимулом.
Помимо мононуклеарного характера клеточного инфильтрата при хроническом воспалении часто происходит пролиферация кровеносных и лимфатических сосудов. Этот процесс стимулируют факторы роста, продуцируемые макрофагами и эндотелиальными клетками.
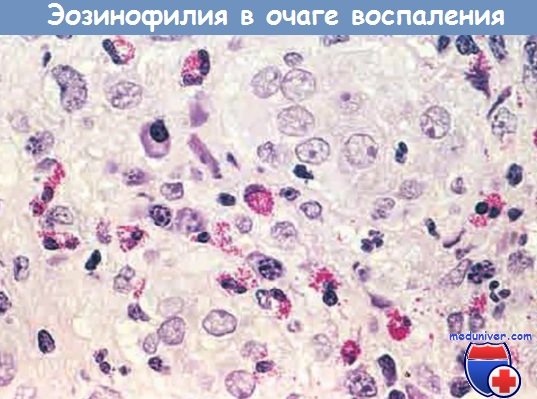
Очаг воспаления с большим количеством эозинофилов (эозинофилия)
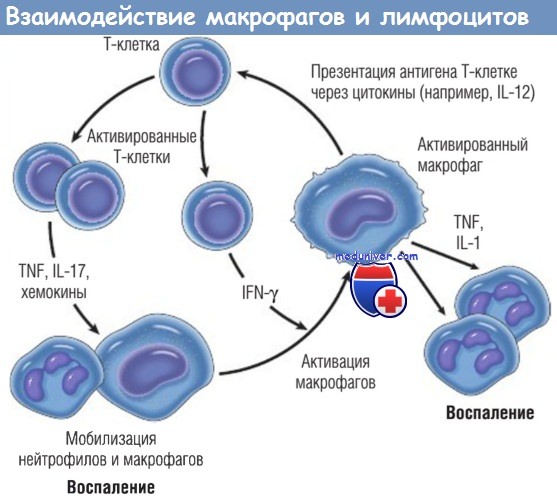
Взаимодействия макрофагов и лимфоцитов при хроническом воспалении.
Активированные Т-клетки продуцируют цитокины, которые мобилизуют макрофаги (TNF, IL-17, хемокины), и IFN-y, который является мощным активатором макрофагов.
Разные типы Т-клеток (Тh1 и Тh17) могут продуцировать различные типы цитокинов.
В свою очередь, активированные макрофаги стимулируют Т-клетки, презентируя им антигены через цитокины (например, IL-12).
IFN — интерферон; IL — интерлейкин; TNF — фактор некроза опухоли.
– Рекомендуем ознакомиться со следующей статьей “Причины и механизмы гранулематозного воспаления. Что такое гранулема?”
Оглавление темы “Патофизиология”:
- Клетки участвующие в хроническом воспалении – макрофаги и другие клетки
- Причины и механизмы гранулематозного воспаления. Что такое гранулема?
- Влияние воспаления на организм в целом (системные симптомы воспаления)
- Варианты воспалительной реакции и ее последствия
- Пути заживления и обновления тканей – репарация, регенерация
- Регуляция деления и пролиферации клеток в тканях
- Виды стволовых клеток и их характеристика
- Эмбриональные стволовые клетки и их характеристика
- Индуцированные плюрипотентные стволовые клетки (ИПСК) и их характеристика
- Где присутствуют стволовые клетки у взрослых?
Источник
Клеточные механизмы защитных реакций организма при воспалении.Основные закономерности развития необратимых патологических изменений в клетках при первичной и вторичной альтерации Рассматривая воспаление как типовой патологический процесс, протекающий в виде последовательно сменяющих друг друга, а в ряде случаев развивающихся параллельно стадий альтерации, экссудации и пролиферации, необходимо отметить, что при определенных условиях течение воспалительных реакций может иметь как преимущественно защитно-приспособительный, так и разрушительный характер. Воздействие на ткани различных по своей природе факторов (химических, физических, бактериальных), как правило, приводит к развитию первичной альтерации. Степень выраженности и распространенность альтеративных изменений определяется интенсивностью действующего фактора, устойчивостью клеток к этому воздействию и способностью клеточных механизмов компенсировать патологические изменения. Повреждение ткани сопровождается выделением биологически активных веществ, способных еще в большей степени увеличивать альтеративные процессы – вызывать вторичную альтерацию. Независимо от особенностей воздействующего фактора, индуцирующего воспалительный процесс, все изменения в клетках можно свести к следующим типам:
Деструктивные процессы в тканях, возникающие в альтернативной стадии (фазе) воспаления, имеют преимущественно патологический характер. Их выраженностью в значительной степени определяется возможная степень неблагоприятного течения воспалительного процесса в целом. При обратимых сублетальных изменениях клетка способна адаптироваться и восстанавливать свою структуру и функцию. В этом случае, как правило, происходит снижение интенсивности метаболических процессов, ограничение потребления кислорода, угнетение процессов окислительного фосфорилирования, активирование гликолиза, уменьшение запасов макроэргических фосфорных соединений, падение уровня активности K-Na-АТФ-азы, ингибирование внутриклеточных ферментов, активирующих анаболические процессы. В процессе необратимого повреждения клетки наблюдается постепенное увеличение объема внутриклеточных структур (расширение эндоплазматической сети, набухание митохондрий, увеличение объема лизосом). Летальные изменения в клетках сопровождаются повреждением наружной и внутриклеточных мембран, в результате чего повышается их пассивная проницаемость для ионов. Одним из кардинальных признаков повреждения клетки является увеличение содержания натрия в цитозоле и выход во внеклеточную среду калия. Тяжелые метаболические расстройства клеточных функций сопровождаются увеличением содержания кальция в цитозоле. В нормальных условиях в цитоплазме регистрируется низкая концентрация кальция, не превышающая 10″‘ моль/л, которая обеспечивается непрерывной работой Са-АТФаз. Основные запасы кальция содержатся в эндоплазматическом ретикулуме, большая часть мембраны которого плотно покрыта белком с молекулярной массой 110 кДа, являющегося Са-насосом. Концентрация кальция в эндоплазматическом ретикулуме в 10 000-100 000 раз выше чем в цитозоле. Деполяризация клеточной мембраны и гидролиз мембранных липидов сопровождаются раскрытием кальциевых каналов, по которым кальций из внутриклеточных депо (цистерн эндоплазматического ретикулума, митохондрий) или интерстициального пространства устремляется в цитозоль. Возникающие в ходе воспаления метаболические нарушения энергообеспечения работы транспортных систем клеток изменяют нормальное протекание процессов реабсорбции кальция, который устремляется из кальцийсодержащих структур и внеклеточной среды в цитозоль по механизмам пассивного транспорта. – Также рекомендуем “Изменения клеток при альтеративной стадии воспаления.” Оглавление темы “Ключевые механизмы воспаления легких.”: |
Источник
Клетки, функции которых активируются при воспалении, подразделяют на две группы по месту их пребывания на момент воздействия повреждающего агента: первая — дендритные клетки, макрофаги и тучные клетки, которые содержатся в тканях постоянно (клетки-резиденты), вторая — другие клетки, поступающие в зону воспаления извне (клетки-эмигранты). К ним относятся гранулоциты (ней-трофильные, эозинофильные), моноциты и лимфоциты.
Дендритные клетки вместе с моноцитами-макрофагами относятся к антиген-представляющим, или антигенпрезентирующим, клеткам (АПК), которые способны представлять Т-хелперам на своей цитоплазматической мембране инородные процессированные антигены вместе с молекулами ГКГС II класса. Благодаря наличию разветвленных отростков они образуют важную систему защиты в поверхностных структурах организма (кожа и слизистые оболочки) и органах (лимфатические узлы, селезенка, легкие), расположенных на путях наиболее возможного проникновения флогогенов. Кроме того, активированные АПК продуцируют специфические сигналы — “угрозы”. К этой группе относятся провоспалительные цитокины, такие как ИЛ-1, ИЛ-6, ФНО-α, ФНО-β и γ-ИФ, различные хемокины и др. Роль ИЛ-1 особенно важна. Под его влиянием Т-лимфоцитыхелперы 1-го типа в момент презентации антигена начинают продуцировать ИЛ-2, который активирует пролиферацию и дифференциацию Т-лимфоцитов-киллеров, а также функцию моноцитов-макрофагов и натуральных киллеров.
Макрофаги. “Классически активированные” в начале воспалительного процесса инфекционными факторами и Т-хелиерами 1-го типа макрофаги синтезируют ИЛ-1. Он находит свои мишени — клетки мышечной, костной, нервной тканей, синовиоциты, гепатоциты, лимфоциты. На мембранах этих клеток имеются специфические рецепторы для ИЛ-1. Действие ИЛ-1 стимулирующее и универсальное, т. е. проявляется при любой болезни воспалительной этиологии (инфекционной или неинфекционной), причем на ранних ее этапах. Есть основания считать, что ранние симптомы болезни (головная боль, боль в мышцах и суставах, сонливость, лихорадка, лейкоцитоз, повышение уровня белков, в том числе и иммуноглобулинов) объясняются именно действием ИЛ-1 (рис. 31).

Роль указанных макрофагов не ограничивается продукцией ИЛ-1. Они также синтезируют более 100 биологически активных провоспалительных цитокинов, фосфолипаз, протеиназ, лизосомальных гидролаз, факторов комплемента, эйкозаноидов, активных кислородных радикалов, в том числе NO, и др. Основная функция этих макрофагов — фагоцитоз собственных клеток, инфицированных бактериями, вирусами, простейшими, грибами, и погибших клеток, в том числе нейтрофилов.
“Альтернативно активированные” Т-хелперами 2-го типа макрофаги синтезируют противовоспалительные цитокины, ингибиторы протеиназ, антифосфолипазы, антиоксиданты, ингибиторы комплемента, биогенных аминов, кининов, фибринолиза, факторы роста и компоненты внеклеточного матрикса. Такое изменение функции моноцитов-макрофагов происходит лишь после обезвреживания флогогенного фактора, его переваривания и преобразования антигена в растворимую форму.
Тучные клетки (тканевые базофилы, мастоциты, лаброциты) после повреждения выбрасывают гистамин, гепарин и лейкотриен D4, факторы хемотаксиса нейтрофилов (ФХН) и эозинофилов (ФХЭ), фактор активации тромбоцитов (ФАТ), которые содержатся в их гранулах. Гистамин и гепарин прежде всего действуют на сосуды (гиперемия). Лейкотриен D4 является хемоаттрактантом, а также вызывает спазм неисчерченных мышц бронхиол и кишечника.
Нейтрофильные гранулоциты. Основная функция этих клеток — фагоцитоз грамотрицательных бактерий и некоторых грибов (гноеродная микрофлора). Попав в кровь из костного мозга, они под влиянием хемоаттрактантов мигрируют из сосудов и в большом количестве скапливаются в очаге воспаления. Размножение клеток, миграция, участие в фагоцитозе регулируются БАВ, для которых на поверхностной мембране нейтрофилов существуют специфические рецепторы.
В цитоплазме нейтрофильных гранулоцитов есть два типа гранул: первичные азурофильные (больших размеров) — обычные лизосомы, в состав которых входят кислые гидролазы, лизоцим, миелопероксидаза. Вторичные (специфические) гранулы более мелкие, а главное — они содержат другой набор веществ (ферментативных и неферментативных), щелочную фосфатазу, лизоцим и неферментативные (катионные) белки. Гликопротеид лактоферрин является хелатором железа (связывает 2 моль железа на 1 моль белка), отбирая у бактерий важное для их жизнедеятельности железо. Вместе с тем, снижение благодаря лактоферрину концентрации Fe2+тормозит образование гидроксильного радикала в реакции Фентона, что уменьшает повреждение собственных тканей. Мощнейшим бактерицидным фактором нейтрофилов служат активные кислородные радикалы, особенно гипохлорит, образующийся под влиянием миелопероксидазы.
Эозинофильные гранулоциты. Их роль в воспалении определяется способностью адсорбировать и разрушать свободный гистамин с помощью гидролитического энзима гистаминазы и обезвреживать лейкотриены арилсульфатазой-В. Антихимотрипсин-α1 ингибирует сериновые протеиназы. Важную роль играют эозинофильные цитотоксические белки (основной белок белок эозинофилов), которые способны повреждать гельминты и их личинки и нейтрализовать гепарин. Миграция и активация эозинофильных гранулоцитов происходят под действием фрагментов (С5а) и компонентов (С5, С6, C7) комплемента, пептидов тучных клеток, лейкотриенов и веществ, вырабатываемых гельминтами.
Тромбоциты. Роль тромбоцитов в процессе воспаления заключается большей частью в том, что они принимают непосредственное участие в процессах микроциркуляции. Очевидно, это наиболее постоянные и универсальные клетки воспаления. В них содержатся вещества, влияющие на проницаемость сосудистой стенки, ее тонус и адгезивные свойства, на рост и размножение клеток, а главное — на способность крови свертываться.
Лимфоциты принимают участие в любом воспалении, особенно иммунной этиологии. Иммунный ответ, как и эффекторная фаза иммунных реакций, регулируется растворимыми медиаторами (интерлейкинами). Основными продуцентами интерлейкинов являются T-лимфоциты, моноциты и тканевые макрофаги.
Фибробласты пролиферируют и активируются в последней стадии воспаления, накапливаясь в очаге воспаления, где они синтезируют коллаген, эластин и гликозаминогликаны. Обобщенные данные о клетках воспаления приведены в табл. 11.


Медиаторы воспаления — это БАВ, являющиеся центральным звеном патогенеза воспаления, поскольку оказывают непосредственное регуляторное влияние на воспалительный процесс, как правило, в пределах очага воспаления (табл. 12). Различают гуморальные и клеточные медиаторы воспаления.
Медиаторы, на момент повреждения находящиеся в плазме крови, называются гуморальными медиаторами. Они представляют собой систему протеиназ плазмы крови, которые синтезируются преимущественно в макрофагах и гепатоцитах и попадают в кровь в неактивном состоянии. Клеточные медиаторы либо синтезируются заново в процессе воспаления уже в активном состоянии (эйкозаноиды и АКР), либо депонируются в гранулах и везикулах клеток и при воспалении активируются и секретируются (биогенные амины, лизосомальные ферменты, катионные белки). Основной причиной образования и/или высвобождения медиаторов клеточного происхождения является альтерация. Именно в результате повреждения клеток выделяются и активируются лизосомальные ферменты, которые в свою очередь активируют другие ферменты, в том числе и пропротеиназы плазмы крови. При этом протеолитические ферменты расщепляют белки не до конца (ограниченный протеолиз), вследствие чего образуются протеиназы и другие специфические активные вещества, дающие определенный патофизиологический эффект Одни из них действуют преимущественно на сосуды, усиливая проницаемость их стенки, другие — на миграцию лейкоцитов, а некоторые — на размножение клеток.
Первым, кто увидел в воспалении определенный “порядок”, закономерность, был В. Менкин. В воспалительном экссудате он выявил химические вещества и установил их влияние на некоторые характерные для воспаления реакции: гиперемию, экссудацию, лейкоцитоз, хемотаксис. С той поры в фактическом материале многое изменилось, однако это направление (химия воспаления) успешно развивается.
Клеточные медиаторы воспаления представлены биогенными аминами, лизосомальными ферментами, неферментативными катионными белками, эозинофильными цитотоксическими белками, активными кислородными радикалами (см. выше), эйкозаноидами, фактором активации тромбоцитов, цитокинами.
Биогенные амины главным образом депонируются в гранулах тучных клеток (гистамин) и тромбоцитах (серотонин, адреналин и норадреналин). Дегрануляция и выброс этих медиаторов происходит под влиянием флогогенных факторов, цитокинов, лизосомальных ферментов, катионных белков, АКР, а также комплексов антигенов с IgE и IgG4, фиксированных на Fc-рецепторах тучных клеток в процессе анафилактической реакции. Адреналин и норадреналин вызывают быстрый и кратковременный спазм сосудов, а гистамин — расширение артериол, повышение проницаемости сосудов микроциркуляторного русла с развитием отека, спазм гладкомышечных клеток, раздражение болевых рецепторов. Серотонин в очаге воспаления действует на мелкие сосуды подобно гистамину, но спазмирует более крупные.
Лизосомальные ферменты нейтрофилов и макрофагов вместе с АКР, катионными белками и мембранатакующим комплексом комплемента являются основным средством защиты от микроорганизмов, убивая и переваривая их в фаголизосомах. В то же время эластаза, коллагеназа и другие нейтральные протеиназы обусловливают разрушение базальных мембран и других матриксных белков, усиливая вторичную альтерацию и повышая проницаемость сосудистой стенки.
Катионные белки адсорбируются на негативно заряженной мембране бактерий и других клеток благодаря своему положительному заряду. Встраивание этих неферментативных белков в мембрану клеток вызывает образование нерегулируемых ионных каналов, через которые в клетки проникают кальций, натрий и вода, что ведет к их набуханию, активации протеиназ и фосфолипаз, разрушению и гибели клеток.
Эозинофильные цитотоксические белки фиксируются преимущественно на наружной оболочке гельминтов, опсонизированной IgE, что приводит к ее повреждению. Это делает эозинофилы главным средством борьбы с гельминтами и одновременно фактором воспаления при гельминтозе.
Эйкозаноиды, как и АКР, образуются заново в процессе воспалительной реакции из ПНЖК, входящих в состав клеточных мембран. Преобладание в рационе, а следовательно, и в клеточных мембранах ω-6-ПНЖК (арахидоновой и линолевой) обусловливает избыточное образование при повреждении тканей сильных провоспалительных факторов — лейкотриена B4 и тромбоксана A2, а также проста-гландинов ПГЕ2, ПГF2α. В то же время достаточное количество в рационе ω-3-ПНЖК способствует образованию ПГI3, оказывающего выраженное противовоспалительное действие, лейкотриена B5 и тромбоксана A3 — слабых провоспалительных факторов.
Фактор активации тромбоцитов является 1-алкил-2-ацетилглицерил-3-фосфорилхолином, образующимся из ацетил-лизофосфатидилхолина мембран нейтрофилов, моноцитов, эндотелиоцитов, тучных клеток и тромбоцитов под влиянием эндотоксина бактерий, тромбина, ангиотензина II, гистамина, брадикинина, ИЛ-1, ФНО-α. ФАТ в свою очередь стимулирует синтез цитокинов, кининов, NO. Он акгивирует фосфолипазу С, что приводит к образованию диацилглицерола, который посредством дегрануляции тромбоцитов стимулирует их адгезию и агрегацию, активирует гранулоциты, способствует продукции АКР и повреждению клеточных мембран, что усиливает приток в цитоплазму Са2+. Диацилглицерол и Ca2+ активируют фосфолипазу A2, в результате чего из фосфолипидов мембран высвобождается арахидоновая кислота с образованием провоспалительных эйкозаноидов. При этом тромбоксан A2 суживает и тромбирует сосуды, в том числе и венечные, лейкотриен B4 вызывает бронхоспазм и эмиграцию нейтрофилов, а ПГI2 может обусловить вазодилатацию. ФАТ в 100—10 000 раз сильнее, чем гистамин, повышает проницаемость сосудов микроциркуляторного русла и является самым мощным активатором тромбоцитов и нейтрофилов.
Цитокины — низкомолекулярные белки или гликопептиды, секретируемые клетками крови, стромы и иммунной системы. Они оказывают паракринное и аутокринное регулирующее воздействие на рост, развитие и функцию клеток-мишеней посредством специфических рецепторов, экспрессию которых клетки в определенной степени могут контролировать. Важнейшими цитокинами являются факторы некроза опухолей, интерлейкины, хемокины, интерфероны и факторы роста.
ФИО-α (кахексия) продуцируется различными типами клеток, в том числе моноцитами-макрофагами, лимфоцитами, опухолевыми клетками и адипоцитами. В низких концентрациях он стимулирует синтез и экспрессию молекул клеточной адгезии на эндотелиоцитах, что обеспечивает адгезию к ним нейтрофилов. ФНО-α повышает фагоцитарную активность нейтрофилов и макрофагов, усиливает синтез лимфокинов хелперными T-лимфоцитами и стимулирует пролиферацию В-лимфоцитов. В высоких концентрациях ФНО-α вызывает внутри-сосудистый тромбоз и некроз опухолевой ткани, усиливает продукцию ИЛ-1, ИЛ-6, простагландинов, что может привести к развитию шока, блокирует тирозинкиназную активность инсулиновых рецепторов мышечных и печеночных клеток, обусловливая их инсулинорезистентность.
ФИО-β (лимфотоксин) вырабатывается акгивированными T-лимфоцитами. Главная его функция — индукция апоптоза клеток-мишеней.
Интерлейкины, хемокины и интерфероны рассматриваются далее при изложении эмиграции лейкоцитов и фагоцитоза, а значение факторов роста анализируется при рассмотрении процессов пролиферации и репарации.
Гуморальные медиаторы воспаления представлены в основном кининами и системой комплемента.
Кинины — группа вазоактивных полипептидов, образующихся в результате каскада биохимических реакций, которые начинаются с активации сериновой протеиназы — фактора Xaгeмана (XII фактор свертывающей системы крови). Столкновение с поврежденной поверхностью или изменение внутренней среды (температуры, pH) приводит к тому, что этот фактор становится активным и действует на прекалликреин, являющийся неактивной протеиназой, которая содержится в плазме крови, превращая его в активный фермент калликреин. Последний в свою очередь действует на α2-глобулины (кининоген), отщепляя от них полипептидную цепь, состоящую из 9 (брадикинин) или 10 (каллидин) аминокислотных остатков. Кинины плазмы крови оказывают непосредственное влияние на тонус и проницаемость сосудистой стенки, обусловливая расширение артериол и повышая проницаемость стенки капилляров. Кроме того, они вызывают типичные для воспаления зуд и боль. Медиаторы калликреин-кининовой системы при воспалении влияют на реологические свойства крови, ее способность к свертыванию и фибринолизу. На схеме 9 показано, как активированный фактор Хагемана инициирует процессы кининобразования, гемокоагуляции и фибринолиза. Выпадение нитей фибрина и образование тромбов в очаге воспаления определенным образом связаны с состоянием калликреин-кининовой системы.

Еще один важный медиатор воспаления гуморального происхождения — комплемент, представляющий собой каскадную систему протеиназ. Известно, что комплемент является защитным фактором организма, однако вместе с тем он может вызывать повреждение собственных тканей, наблюдающееся при воспалении, особенно иммунном. Это объясняется тем, что фрагменты комплемента С3а и С5а активируют выброс медиаторов из тучных клеток и образование лейкоцитами АКР, которые повреждают как микроорганизмы, так и собственные клетки. Фрагмент С5b способен фиксироваться на сенсибилизированных и несенсибили-зированных антителами клетках, образовывать мембранатакующий комплекс С5b6789, который разрушает мембраны и осуществляет лизис поврежденных клеток. Фрагмент С5а усиливает хемотаксис нейтрофилов и повышает проницаемость сосудистой стенки. Наконец, микроорганизмы, мембрана которых покрыта (опсонизирована) фрагментом комплемента С3b, экспрессируют на фагоцитах рецептор комплемента 1-го типа (CRl) и становятся объектом активного фагоцитоза. Опсонизации бактерий фрагментом С3b способствует предыдущее связывание фосфатидилхолина их мембран с белком острой фазы — С-реактивным протеином.
Медиаторы воспаления осуществляют свое влияние преимущественно местно, т. е. в очаге воспаления: оно описывается при характеристике течения воспалительного процесса. В норме незначительное количество медиаторов (а при неблагоприятном течении воспаления — большое) поступает в общий кровоток, что проявляется общими признаками местного процесса.
Влияние медиаторов воспаления на уровне организма
Влияние медиаторов воспаления на организм включает:
1. Влияние на гипоталамус. Проинфламматорные медиаторы, такие как ИЛ-1, ИЛ-6, ФНО-α, попадая в общую циркуляцию, действуют на гипоталамус. Это воздействие имеет по крайней мере два результата: во-первых, способствует повышению локальной продукции ПГЕ2, что в свою очередь, изменяя уровень терморегуляции, обусловливает повышение температуры тела; во-вторых, активируя выброс кортикотропинного рилизинг-гормона, они усиливают продукцию кортикотропина (AKTГ) аденогипофизом, а также выделение глюкокортикоидов корковым веществом надпочечников. Это повышение уровня глюкокортикоидов в крови действует как отрицательная обратная связь, которая тормозит неограниченное нарастание признаков воспаления.
2. Влияние медиаторов воспаления на печень. В ответ на системное действие медиаторов повышается продукция в печени так называемых белков острой фазы (острофазных). В настоящее время известно несколько десятков этих белков, которые в острый период воспаления защищают организм от бактерий и веществ, образующихся в результате деструкции собственных тканей. К таким белкам прежде всего относятся СРП и сывороточный предшественник амилоида (СПА). По химической структуре они состоят из пяти полипептидных колец (в СПА — в удвоенном наборе) и потому имеют название пентраксинов. Их уровень в крови при воспалении может повышаться в 100—1000 раз. Поэтому пентраксины являются очень чувствительными индикаторами, которые сигнализируют о возникновении воспаления в организме, что широко используется в клинике.
Среди других белков острой фазы следует назвать сывороточный амилоид А (САА), гаптоглобин, гемопексин, церулоплазмин, трансферрин, лактоферрин, ингибиторы протеиназ, активированные компоненты комплемента, различные факторы роста. Их уровень при воспалении повышается не так выражено, лишь в несколько раз. Белки острой фазы играют разнообразную роль. Они связывают вредные продукт, делают недоступными для бактерий важные нутриенты (железо, цинк, медь, цианокобаламин), ослабляют генерализацию реакции и стимулируют репаративные процессы. Тем не менее, как уже указывалось выше, в случае очень мощного влияния патогенных проинфламматорных факторов возможна угрожающая для жизни генерализация воспалительного процесса, которая получила название “синдром системного действия медиаторов воспаления”. В иных случаях при хроническом воспалении длительная продукция CAA и СПА приводит к их накоплению как в очаге воспаления, так и в других участках организма (селезенке, почках) в виде аморфной нерастворимой белковой массы — амилоида, нарушающего структуру и функцию клеток и органов.
Источник