Клеточными медиаторами действующими в очаге воспаления
/ / – . .
2.1.3. – . .
, , – , , (-, , ), , , , .
, , – . – – – , – , , .
– , – , – . -. , , – , – .
. (), – , () (- -), . – . – , -, -.
– . , – .
, – (5, 3, 3b, 5 – 9, 5 des Arg) , ( ., 1988; .., .., .., 1994; .., 1994). – (, -), , , – ( , – , ).
– (, , ), , , (, –, -, 22, ).
-, , – -. , , , : , , -, ( .., .., 1997).
, – , . , , – , – (-α) . , – , -, -.
– . – – . – : , . – : -, ( .., 1979; .., 1989).
-, , . , – , – , .
.
– .
– ( .., – .., .., 1989).
: – , .
, , , .
.
. (.., .., 1974; .., .., 1981).
. – , – , . – . – , , – , 3 5 , – , , , -, .
– -. – 1- . , – , , – . – – .
(), (), , .
. -, . – , , -, , . – , , , – – , – . – , . , – .
(). , , , . ( .., 1981; .., . ., 1983; ..,1986).
, – , , – , – , .
, , , , .
– , .
, – . – , , , . – . ( .., 1990).
– , , – , – . , , .
, . – , -/ , – (, , – .) ( ..,1984; ..,1989). – 100 , – /, .
1. : , , , .
2. : , -1, -3, -6, -8, 10,-12, -15, , , -, , 2, 3, 5.
3. : -, -, -, , .
4. : Y,YII, IX, X, , .
5. : , , . , .
-1 15 , , -, , , . . -1 1972 I. Gery B. Waksman. -1 : / ( .., 1994). -1 – , – – -1 -1, (Gery I., Waksman B., 1972; Cannon J.G.,Tatro J.B., Reichlin S. et al., 1986).
-1 – – , , , , – , – () – , ( .. ., 1990; .., 1996).
-1 – , – .
-1 , .
-1 – , , – .
-1 – , – , , -.
-1 -, , , , .
() – , , ( .., 1996).
: , — – (-3).
.
, 17- , – , , . -3 .
– 5- , , , .
-, -3 -, 5- , , , -, .
, , – ( .., 1997), – , , , , . -SF ( ), G-CSF ( ). , – .
-7 , -.
-9 – .
-11 , – .
: TNF, -1, -6 G-CSF. -. – , , , , , , – , . -1 -6, – — , -. .
, , - 17 . - , -. -, , 25 . , , , , – , . -1 -6, – – , -. .
-1, – ( .., 1994). – , -, – , , , , , – , . – , – . – , (-2, -3, -6, -8, -10 .) , – . , .
. , , 8 ( ..,1980) , -:
1. , ( ; ).
2. , (, ; , ; , -).
3. (; , – ; , – ; , ).
4. (, -; ; ).
5. (; , ).
6. , ( ; – ).
7. , – -.
8. , .
– , – -.
( .., .., 1980), – : ; , – ; , .
1. – , -, -. , , , . , , , .
2. , , – . – (-1, -2, -3 .) ( .., – .., 1991). -1 .
-2 – -, , – . -2 – -. -2 – , , – ( .., .. ., 1990).
-3 – , , , , — .
-4 – -, , – – .
-5 – -, – , -.
3. , -, , (). , – – , – , , – – – .
, , – -.
– – , – .
, - - – -, – .
- – — – – . – - .
--2, -6 (-6) – 26 -, , , , – – -, -.
– 6 – – – , – , . -6 . -6 – . -6 -1, . -6 – , – – (Pullicino E.A., Carli F., Poole S. et al., 1990). -1, -6, -a – – – , .
-8 – . – , -, .
-9 -11 – , – (-9) – (-11) ( .., 1997).
-10 – -, , , -. –. -10 – , , – -, -2, -3, , – . -10 -, -, .
– . , – , – , , , , ( .., 1989). , – : , .
– . 2. : , .
, , – . 2. , . – , G2, 2. :
1. 2 I2 .
2. 2 – 2.
3. 2 2, F2, D2.
– . 2 , F2a – . – , . 2, , , , – . – . – , – G2, , – 2. – – . – 2 , -. . – . () . – -5 – 4 (4). 4 α- D4, 4. 4, D4, 4 . . , 4 .
4 , -, , . 4, 4, 4 – , – , , , -. – .
– , , . .
– 2. , -, , , , , , ( .., .., .., 1989).
, , – , , – , .
.
, , , , , , . . – . : , , – , -, , , , ( .., .., 1986; .., 1989).
, – . – . ( .., .., 1983).
, – -, . – , , , , – . , – , – . , – , , – , -, , α1-, – .
: , , , , -, .
– , , -.
(NO)- -, L- NO- , , – , , ( .., 1996; .., 1997).
NO , -, -, -, , , ( .., 1997).
NO- , , , -1,, , (Forstermann H., Schmidt H.H., Pollock J.C., 1991).
NO- – –, , , , .
NO -, – -. – . , NO – (Angaard E., 1994).
NO – , , , -, , ( .., 1996). – NO NO -, , – . – – NO.
NO- ( – ) . – , NO- . NO- , .
, , -, , , — . – – , , G, .
, . – . – – ( .., .., .., .., 1990). G – . – , – , , – . , , .
-, , .
. – , .
, 2- – . –1 -2 ( -) : –, , -, . -. XII – , . , – , , – – . , – , – .
, , .
, . , , .
, , – ( .., .., .., 1991; .., .., .., 1994).
, , – ( .., .., .., 1982). , – , , -, , , , – .
, . -, , , , , .
: , , .
, – , – , , — .
. – , 20 . 3 ( .., .., 1996; .., ..,1996).
– . – G M, – – . – – , , , , , IgA, IgG, IgE .
, – , .
– – , , , 3 3-.
– . , 2- , 3- , – , 5- , 5 – 9- . 5- – .
, – :
1. – .
2. , , .
3. .
4. .
5. – .
6. -1, , , .
7. , – , .
, – , , – .
| |
Источник
Образование и реализация эффектов БАВ – одно из ключевых звеньев воспаления. БАВ обеспечивают закономерный характер развития воспаления, формирование его общих и местных проявлений, а также исходы воспаления. Именно поэтому БАВ нередко именуют как «пусковые факторы», «организаторы», «внутренний двигатель», «мотор» воспалительной реакции, «медиаторы воспаления».
Медиаторы воспаления- БАВ, • образующиеся при воспалении, • обеспечивающие закономерный характер его развития и исходов, • формирование его местных и общих признаков.
Все медиаторы воспаленияили их неактивные предшественники образуются в различных клетках организма. Тем не менее их подразделяют на клеточные и плазменные.
Клеточные медиаторывысвобождаются в очаге воспаления уже в активированном состоянии непосредственно из клеток, в которых они синтезировались и накопились.
Плазменные медиаторыобразуются в клетках и выделяются в межклеточную жидкость, лимфу и кровь, но не в активном состоянии, а в виде предшественников. Эти вещества активируются под действием различных промоторов преимущественно в плазме крови. Они становятся физиологически дееспособными и поступают в ткани.
Медиаторы воспаления
Клеточные:
Гистамин (из гранул тучных клеток) – местное расширение сосудов, повышение их проницаемости, особенно венул.
Серотонин (из тромбоцитов, хромаффинных клеток слизистой оболочки пищеварительного канала) – спазм посткапиллярных венул, повышение проницаемости стенки сосудов.
Лизосомальные ферменты (гранулоциты, тканевые базофилы, макрофаги) – вторичная альтерация, хемотаксис.
Катионные белки (нейтрофильные гранулоциты) – повышение проницаемости стенки сосудов.
Простогландины (арахидоновая кислота) – проницаемость сосудов, отек, хемотаксис.
Тромбоксан (тромбоциты) – агрегация тромбоцитов, вазоконстрикция, свертывание крови.
Простациклин (эндотелиоциты) – дезагрегация тромбоцитов, расширание сосудов.
Лейкотриены (лейкоциты) – хмеотаксис, сокращение гладких мышц, отек.
Гуморальные медиаторы:
Кинины (альфа-глобулины крови) – расширение капилляров, увеличение проницаемости, боль, зуд.
Система комплемента (плазма крови) – хемотаксис, цитолиз.
12. Модуляторы воспаления. Механизмы их образования и действия.
Модуляторы воспаления = медиаторы воспаления.
Все медиаторы воспаленияили их неактивные предшественники образуются в различных клетках организма. Тем не менее их подразделяют на клеточные и плазменные.
Клеточные медиаторывысвобождаются в очаге воспаления уже в активированном состоянии непосредственно из клеток, в которых они синтезировались и накопились.
Плазменные медиаторыобразуются в клетках и выделяются в межклеточную жидкость, лимфу и кровь, но не в активном состоянии, а в виде предшественников. Эти вещества активируются под действием различных промоторов преимущественно в плазме крови. Они становятся физиологически дееспособными и поступают в ткани.
Медиаторы воспаления
Клеточные:
Гистамин (из гранул тучных клеток) – местное расширение сосудов, повышение их проницаемости, особенно венул.
Серотонин (из тромбоцитов, хромаффинных клеток слизистой оболочки пищеварительного канала) – спазм посткапиллярных венул, повышение проницаемости стенки сосудов.
Лизосомальные ферменты (гранулоциты, тканевые базофилы, макрофаги) – вторичная альтерация, хемотаксис.
Катионные белки (нейтрофильные гранулоциты) – повышение проницаемости стенки сосудов.
Простогландины (арахидоновая кислота) – проницаемость сосудов, отек, хемотаксис.
Тромбоксан (тромбоциты) – агрегация тромбоцитов, вазоконстрикция, свертывание крови.
Простациклин (эндотелиоциты) – дезагрегация тромбоцитов, расширание сосудов.
Лейкотриены (лейкоциты) – хмеотаксис, сокращение гладких мышц, отек.
Гуморальные медиаторы:
Кинины (альфа-глобулины крови) – расширение капилляров, увеличение проницаемости, боль, зуд.
Система комплемента (плазма крови) – хемотаксис, цитолиз.
С-реактивный белок – Белок острой фазы, чувствительный индикатор повреждения тканей при воспалении, некрозе, травме.
Получил свое название из-за способности вступать в реакцию преципитации с С-полисахаридом пневмококков (важный механизм ранней защиты организма от инфекции). С-реактивный белок стимулирует иммунные реакции, в том числе фагоцитоз, участвует во взаимодействии Т- и В-лимфоцитов, активирует систему комплемента по классическому типу. Синтезируется преимущественно в гепатоцитах.
Уровень С-реактивного белка быстро и многократно (в сотни раз) увеличивается при воспалениях различной природы и локализации, паразитарных инфекциях, травмах и опухолях, сопровождающихся воспалением и некрозом тканей. Концентрация остальных острофазных белков редко увеличивается более чем в 3-5 раз от значений нормы. Синтез С-реактивного белка растет уже через 4-6 часов после начала воспалительного процесса (до увеличения количества гранулоцитов), достигает пика через 1-2 дня, при успешном выздоровлении его уровень быстро снижается, поскольку полупериод циркуляции в крови С-реактивного белка составляет 6 часов. По диагностической значимости сопоставим с СОЭ, но уровень С-реактивного белка растет и снижается быстрее. Концентрация С-реактивного белка в крови имеет высокую корреляцию с активностью заболевания, стадией процесса. С переходом заболевания в хроническую стадию уровень С-реактивного белка снижается до полного его исчезновения и вновь возрастает при обострении процесса. После неосложненного оперативного вмешательства величина этого показателя возрастает, но в послеоперационном периоде он быстро нормализуется. При любых заболеваниях или после операции присоединение бактериальной инфекции, будь то местный процесс или сепсис, сопровождается повышением уровня С-реактивного белка. Уровень С-реактивного белка при вирусной и спирохетной инфекции возрастает незначительно, поэтому его высокие значения в сыворотке крови при отсутствии травмы обычно указывают на наличие бактериальной инфекции. На уровень С-реактивного белка не оказывают особого влияния изменения гормонального статуса, в том числе и во время беременности. Определение С-реактивного белка ценно в диагностике сепсиса у новорожденных.
Относительно новая область применения этого показателя – оценка риска развития атеросклероза и связанных с ним осложнений. Разработанные в последнее время высокочувствительные методы определения С-реактивного белка (чувствительность <0.5 мг/л), используемые в данное время в практике нашей лаборатории, могут улавливать изменение С-реактивного белка не только в условиях острого, но также и хронического, низкой степени выраженности, эндогенного воспаления. Показано, что повышение С-реактивного белка в интервале концентраций <10 мг/л и пограничных с верхней границей нормы значений свидетельствует о повышенном риске развития атеросклероза и может быть показателем дестабилизации атеросклеротической бляшки, а также показателем риска первого инфаркта, тромбоэмболии. Вероятность сердечно-сосудистых осложнений у таких пациентов возрастает при наличии параллельно других факторов риска (повышенный уровень холестерина, фибриногена, гомоцистеина и др.).
Соседние файлы в папке К экзамену
- #
- #
- #
- #
- #
- #
Источник
Этиологиявоспаления. Компонентывоспаления
В общей патологии воспаление принято рассматривать как типовой общепатологический процесе, т.е. универсальную, стандартную форму ответа организма на действие различных болезнетворных факторов. Особенность воспаления как биологического процесса заключается в его защитно-приспособительной функции, которая состоит в сосудисто-мезенхимальной реакции на повреждение, направленной на ликвидацию повреждающего агента и восстановление поврежденной ткани. Воспаление – это очень сложная реакция всего организма, которая возникает обычно в месте действия болезнетворного фактора как экзогенного, так и эндогенного происхождения. При этом отмечается целый комплекс сосудисто-тканевых изменений как функционального, так и морфологического характера. Это наиболее частая форма типовых патологических процессов, лежащая в основе многих клинически различных заболеваний. В эволюционном плане воспалительная реакция сложилась как защитная реакция организма, носит приспособительный характер. Одной из особенностей воспаления является повышение обмена веществ в очаге воспаления, отсюда происходит его латинское название «inflammatio» (воспламенение). Название воспаления отдельных органов складывается из названия самого органа с окончанием «ит» (itis), обозначающим в латинском языке воспаление. Например, воспаление плевры – плеврит, воспаление аппендикулярного отростка – аппендицит и т.д. Хотя есть и исключения из этого правила, например, пневмония – воспаление легких, флегмона – воспаление клетчатки и т.д. Этиология воспаления представлена широким спектром факторов как экзогенного, так и эндогенного происхождения. К факторам экзогенного (внешнего) происхождения относят группы: 1) инфекционного характера (вирусы, паразиты, микроорганизмы); 2) химического происхожения (яды, кислоты); 3) физического происхождения (температурный фактор, лучистая энергия); 4) механические факторы (травмы, переломы и т.д.). К эндогенным (внутренним) факторам, приводящим к возникновению воспалительной реакции, можно отнести тромбоз, некроз, инфаркты, кровоизлияния, отложения солей, нарушение нервной трофики и т.д. Несмотря на разнообразие причин, приводящих к возникновению воспаления, закономерности воспалительной реакции общие. Однако характер воспалительного процесса в каждом конкретном случае отличается и зависит от: 1. характера причин, его вызвавшего; 2. реактивности организма, в котором возникает воспаление; 3. локализации воспалительного процесса и 4. длительности воздействия флогогенного (греч. phlogosis – воспаление) агента. Воспаление – это сложившаяся в процессе эволюции общая сосудисто-тканевая реакция организма, возникающая в месте действия повреждающего агента и состоящая из 3-х основных компонентов: 1. дистрофии ткани (альтерации); 2. сосудистой реакции (расстройств микроциркуляции) с явлениями эксудации и эмиграции и 3. пролиферации. Три компонента воспаления протекают одновременно, но, в зависимости от формы воспаления либо его стадии, может наблюдаться превалирование того или иного компонента. Динамика воспалительного процесса, независимо от вызывающих его причин, всегда достаточно стандартна. Патогенетическую основу воспаления составляют три взаимосвязанных компонента – альтерация, сосудистые расстройства с явлениями эксудации и эмиграции, пролиферация. Альтерация (от лат. alteratio – изменение, alter) – это комплекс обменных, физико-химических, структурно-функциональных изменений в очаге воспаления, а также образование и (или) активация медиаторов воспаления. Иначе говоря, это комплекс структурных и функциональных изменений вследствие нарушения питания и обмена веществ в очаге воспаления. Принято выделять первичную и вторичную альтерацию (дистрофию) в очаге воспаления. Первичная альтерация возникает в ответ на прямое воздействие флогогенного агента. Реакцию первичной альтерации как бы пролонгирует действие причины воспаления. Вторичная альтерация возникает под действием факторов первичной альтерации. Эти воздействия опосредованы нервной системой, физико-химическими факторами (ацидоз, дисиония и т.д.), а в основном медиаторами воспаления. Воспаление начинается с нарушения обмена веществ в очаге, которое носит как качественный, так и количественный характер. В частности, по выражению немецкого ученого Шаде, в очаге воспаления происходит «пожар обмена», т.е. все интенсивно горит, но не сгорает. И интенсификация обмена веществ в очаге воспаления не полностью обеспечивается кислородом вначале за счет самой интенсификации и относительной недотаточности кислорода, а затем и замедления кровотока, отсюда понижения доставки кислорода. Происходит недоокисление продуктов, медленное выведение кислых продуктов (молочной кислоты, пировиноградной кислоты, жирных кислот, кетоновых тел, аминокислот, БАВ) и накопление их в очаге воспаления (ацидоз или по Шаде Н- гипериония). Иначе говоря, обменные изменения в очаге воспаления включают в себя интенсификацию процессов распада углеводов, белков и жиров, усиление анаэробного гликолиза и тканевого дыхания, разобщение биологического окисления и фосфорилирования, снижение активности анаболических процессов. Следствием указанных изменений являются увеличение теплопродукции, развитие дефицита макроэргов, накопление продуктов обмена, образование медиаторов воспаления. Нарушение минерального обмена в очаге воспаления сопровождается увеличением концентрации К, Na, Са, что способствует усилению проницаемости сосудов, повышению эксудации и местному отеку и повышению осмотического давления (гиперосмия по Шаде). Этим объясняются главные признаки воспаления – припухлость и боль. Изменение соотношения К, Na/Са определяет высвобождение ацетилхолина. Комплекс физико-химических изменений в очаге воспаления сводится к следующему. Накопление недоокисленных продуктов (молочной кислоты, аминокислот и проч.) приводит к ацидозу (Н – гипериония). Кислотность среды снижается до 6,8-6,0 и ниже. Ацидоз вначале носит компенсированный характер (за счет буферных систем ткани и крови), затем может переходить в некомпенсированный («пожар обмена» нарастает, отток крови замедляется), и тогда наступает гибель клеток, мертвая ткань подвергается автолизу (расплавлению) с образованием аммиака, поэтому в гнойном фокусе воспаления реакция ткани щелочная. Ацидоз и другие нарушения обмена, являющиеся следствием интенсификации обмена ведут к повышению концентрации молекул в очаге воспаления, которые в растворе определяют осмотическое давление. Т.е. в очаге воспаления возникает осмотическая гипертония (гиперосмия по Шаде). Давление при этом увеличивается до 19-20 атм. (при норме 8 атм.). Этот факт способствует выходу жидкой части крови из сосуда в ткань (экссудации) и нарастанию механического давления. Кроме того, ацидоз ведет к повышению дисперсности и гидрофильности коллоидов, набуханию их, таким образом повышению онкотического давления (гиперонкия по Шаде). Эти три явления в очаге воспления названы Шаде гиперплетией ткани (от слов греч. hyper- сверх, слишком, plethysmus- увеличение) .
Медиаторывоспаления – это комплекс биологически активных веществ, опосредующих действие флогогенных факторов, определяющих развитие и исходы процесса воспаления.
Вследствие действия этиологического фактора происходит первичная альтерация, в частности, повреждение лизосом. Вследствие этого происходит высвобождение ферментов , продолжающих деструкцию
( вторичную альтерацию) и приводящих к образованию медиаторов. Т.о. лизосомы можно считать стартовой площадкой воспаления.
По происхождению условно различают клеточные и плазменные (гуморальные) медиаторы.
К клеточныммедиаторам относят группу веществ, которые образуют клетки, принимающие участие в развитии воспаления:
1. Полиморфноядсрные лейкоциты (ПЯЛ), в основном нейтрофилы и базофилы, являются источником: высокоактивных лизосомальных гидролаз, клеточных белков, простагландинов, лейкотриенов, интерлейкинов, биогенных аминов.
Эозинофилы в очаге воспаления участвуют, в основном, в обезвреживании оксидантов и лейкотриенов. Эти клетки играют важную роль в развитии аллергического компонента воспаления.
Мононуклеарные клетки – лимфоциты, моноциты, тканевые макрофаги – вырабатывают лимфокины и монокины, а также выделяют большое количество ферментов (протеазы, эстеразы, гидролазы).
Тромбоциты являются источником:
– адгезивных белков
– АДФ
– серотонина
– лизосомальных ферментов
– фактора Виллебранда
4. Тучные клетки (лаброциты) выделяют:
– биогенные амины
– фактор активации тромбоцитов (ФАТ)
– лейкотриены (входят в состав МРС анафилаксии)
– эозинофильный хемотаксический фактор
– нейтрофильный хемотаксический фактор
– гепарин
5. Другие клетки тканей, подвергшихся активации или разрушению, могут быть источниками:
– лизосомальных ферментов
– простагландинов
– продуктов перекисного окисления липидов и др.
Группуплазменныхмедиаторов составляют вещества, поступающие в очаг воспаления в основном из плазмы крови. К ним относятся компоненты системы комплемента, кинины, факторы свертывающей системы крови и др. Клеточные и плазматические медиаторы взаимодействуют. Например, многие продукты ПЯЛ опосредуют свое влияние на проницаемость сосудов через плазменные факторы; фактор Виллибранда системы свертывания крови является активатором тромбоцитов.
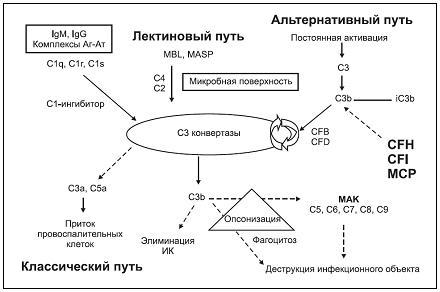
Существуют три пути активации комплемента:

Реакциякомлементанаразвите воспалительногопроцесса:

Медиаторы воспаления – продолжение
Посвоейприроде медиаторы воспаления объединяются в следующие
группы:
Биогенныеамины.
1. Гистамин (основные источники – базофилы, тучные клетки). В малых концентрациях реализует свое действие через мембранные рецепторы Н1 и вызывают чувство кожного зуда, жжения, боли. В более высоких концентрациях реализует свое действие через мембранные рецепторы типа Н2 и оказывают следующие действия:
-увеличивает продукцию простагландинов Е2 и Р2а, тромбоксана
-подавляет хемотаксис и фагоцитарную активность нейтрофилов, снижает высвобождение лизосомальных ферментов нейтрофилов
-подавляет высвобождение медиаторов (в том числе гистамина) из базофилов
-угнетает Т-киллерную активность лимфоцитов и выработку лимфокинов.
Действуя через оба типа рецепторов, гистамин в очаге воспаления вызывает вазодилятадию (расширение прекапиллярных артериол, в легких гистамин вызывает вазоконстрикторный эффект) и повышение проницаемости стенки сосудов (округление эндотелиальных стенок, ослабление межклеточных контактов) кожи и некоторых органов.
2. Серотонин (основное депо – гранулы тромбоцитов, тучные клетки кожи, энтерохромаффинные клетки слизистой пищевого канала, некоторые нервные клетки). Реализует свое действие через серотонинергические рецепторы и вызывает:
-возбуждение гладкой мускулатуры бронхов, кишечника и матки
-мобилизует адреналин из надпочечников, вызывает спазм венул
-расширяет капилляры, повышает их проницаемость и, таким образом, способствует развитию отека (в этом плане в 200 раз активнее гистамина)
-вызывает тромбообразование.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
