Лечение при воспалении вилочковой железы у ребенка
Тимомегалия – гиперплазия тимуса и его гипофункция, сопровождающие ряд заболеваний детского возраста. Незначительная тимомегалия протекает бессимптомно; выраженное увеличение тимуса может проявляться синдром сдавления жизненно важных органов, синдромом лимфопролиферации, иммунными и эндокрино-обменными нарушениями. Диагностика тимомегалии требует участия детского иммунолога, проведения УЗИ вилочковой железы, рентгенографии грудной клетки, исследования показателей Т-звена иммунной системы и гормонального статуса. Детям с тимомегалией рекомендуются общеоздоровительные мероприятия, прием поливитаминов, биостимуляторов; по показаниям – глюкокортикостероидов.
Общие сведения
Тимомегалия – превышение массы и объема вилочковой железы у детей предельных возрастных норм с сохранением нормальной гистологической структуры органа. Тимомегалия обнаруживается примерно у 13-34% детей раннего возраста и 3-12% детей старше 3-х лет. После 5-6 лет количество детей с тимомегалией существенно уменьшается. У мальчиков тимомегалия диагностируется в 1,5-2 раза чаще, чем у девочек. Дети, страдающие тимомегалией, составляют в педиатрии группу риска по развитию аллергических, эндокринных, аутоиммунных и онкологических заболеваний, синдрома внезапной детской смерти, потому нуждаются в особом уходе и дополнительном наблюдении со стороны педиатра и детского аллерголога-иммунолога.

Тимомегалия
Причины тимомегалии
Вилочковая железа или тимус представляет собой центральный орган иммунной системы и железу внутренней секреции. В тимусе происходит трансформация клеток-предшественников (претимоцитов) в Т-лимфоциты, участвующие в регуляции клеточного и гуморального иммунитета. Кроме этого, вилочковая железа секретирует свыше 20 биологически активных веществ, среди которых гормоны и гормоноподобные вещества, регулирующие обмен веществ, гемопоэз, уровень кальция и сахара в крови, фосфора в скелетных мышцах, рост и половое созревание. Максимальную массу тимус имеет к моменту рождения ребенка (4,4% массы тела); его рост продолжается до 15 лет, после чего орган подвергается постепенной возрастной инволюции – замещению железистой ткани жировой и соединительной.
К развитию тимомегалии могут приводить различные эндогенные и экзогенные факторы, а также их сочетание. Доказана генетическая детерминированность тимомегалии и ее связь с HLA-антигенами B15, B18, В27. Определенную роль в формировании тимомегалии у ребенка играет отягощенный акушерский анамнез матери (аборты и выкидыши в анамнезе, токсикозы беременности, резус-конфликт, поздняя беременность и др.); вредное влияние на плод лекарств, алкоголя, рентгеновского облучения; патология периода новорожденности и раннего возраста (асфиксия, недоношенность, родовые травмы, синдром дыхательных расстройств, конъюгационная желтуха, сепсис новорожденных) и др. Тимомегалия является характерным проявлением лимфатико-гипопластического диатеза.
Классификация тимомегалии
Исследователи выделяют врожденную (первичную) и приобретенную (вторичную) тимомегалию. При врожденной тимомегалии вилочковая железа сформирована правильно, однако увеличена в размерах, что сопровождается снижением ее секреторной функции, гиперплазией лимфоидной ткани и дисфункцией нейро-эндокринной системы.
Приобретенная тимомегалия развивается вследствие первичного поражения других эндокринных желез: гипокортицизма, обусловленного аддисоновой болезнью, травмами, воспалительным или опухолевым поражением коры надпочечников; гипоталамического синдрома при окклюзионной гидроцефалии, васкулитах, опухолях головного мозга и пр.
Кроме этого, увеличение вилочковой железы может носить функциональный характер (например, при ОРВИ, пневмонии и др. заболеваниях); в этих случаях после выздоровления размеры тимуса и иммуногормональные показатели приходят в норму. Органическая тимомегалия связана с непосредственным поражением вилочковой железы.
Симптомы тимомегалии
Незначительное увеличение вилочковой железы может протекать без каких-либо выраженных клинических проявлений. Иногда для обозначения небольшой гиперплазии используется понятие «синдром увеличенной вилочковой железы» (СУВЖ), а термином «тимомегалия» обозначается значительное увеличение органа, сопровождающееся развернутой клинической симптоматикой.
Дети с тимомегалией отличаются характерными фенотипическими чертами: округлыми мягкими формами тела, крупными чертами лица и увеличенными поперечными размерами тела (широким лицом, плечами, грудной клеткой, ладонями и стопами), бледной, слабо пигментированной кожей, светлыми волосами и глазами, слабо развитой мускулатурой, повышенным аппетитом. Чаще чем в популяции у них отмечается нарушение темпов и последовательности прорезывания зубов, позднее начало ходьбы, задержка речевого развития и дислалия.
Из сопутствующих заболеваний при тимомегалии могут встречаться паховые и пупочные грыжи, ВПС (септальные дефекты), перинатальная энцефалопатия, рахит, врожденный вывих бедра, синдактилия, крипторхизм, фимоз, гипоплазия матки и влагалища и др. Дети с тимомегалией склонны к артериальной гипотонии, аритмиям, повышенной потливости, необъяснимому длительному субфебрилитету. Клинически значимая тимомегалии может сопровождаться сдавлением жизненно важных органов (трахеи, сосудистого пучка, ВПВ, блуждающего нерва), развитием синдромов иммунодефицита и лимфопролиферации, эндокрино-обменных нарушений.
При компрессии увеличенным тимусом жизненно важных органов может развиваться синдром верхней полой вены: набухание шейных вен, расширение венозной сети на верхней части туловища, одышка, цианоз. В случае сдавления трахеи возникает кашель, одышка, шумное храпящее дыхание, возбужденное состояние. Раздражение блуждающего нерва сопровождается брадикардией, дисфонией, срыгиваниями или рвотой, коллапсами.
Тимомегалия обычно сочетается с гиперплазией лимфоидной ткани (лимфаденопатией, увеличением аденоидов и миндалин, спленомегалией). В раннем и дошкольном возрасте дети с тимомегалией относятся к группе часто болеющих; у них отмечаются частые эпизоды ОРВИ с сильным коклюшеподобным кашлем и ложным крупом, отиты, пневмонии, выраженные поствакцинальные реакции. Эндокринные сдвиги проявляются ожирением, гипокортицизмом, гипопаратиреозом, сахарным диабетом, дисфункцией щитовидной железы, гиперпигментацией кожных покровов.
Диагностика тимомегалии
Обследование детей с тимомегалией проводится педиатром, детским иммунологом, детским эндокринологом и включает несколько этапов (клинико-анамнестический, инструментальный и лабораторный). При оценке объективного статуса ребенка с тимомегалией обращается внимание на перинатальный анамнез, конституционные данные, перенесенные заболевания.
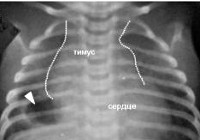
Основная роль в выявлении тимомегалии принадлежит инструментальному обследованию – рентгенографии грудной клетки, УЗИ вилочковой железы, УЗИ органов брюшной полости и надпочечников. Рентгенодиагностика позволяет определить степень тимомегалии на основании исчисления кардио-тимико-торакального индекса (КТТИ) и вазокардиального индекса (ВКИ). В норме на рентгенограммах в прямой проекции тень вилочковой железы располагается за тенью сердца и сосудистого пучка. При тимомегалии I степени тень тимуса занимает 1/2 половину грудной клетки, II степени – 1/2 – 3/4 грудной клетки, III степени – более 3/4 грудной клетки. УЗИ тимуса позволяет оценить объем и массу органа и составить более четкое представление о степени тимомегалии.
Лабораторные показатели при тимомегалии характеризуются снижением субпопуляции Т-лимфоцитов (CD3, CD4, CD8); резким уменьшением количества зрелых В-клеток, низким уровнем IgG и IgА, повышенным – IgM и IgE; снижением концентрации АКТГ, кортизола, повышением уровня СТГ и ТТГ, некоторым увеличением концентрации паратиреоидного гормона.
Лечение тимомегалии
Вопросы ведения детей с тимомегалией и необходимости проведения корригирующей терапии разработаны недостаточно. Общепринято считать, что при незначительном увеличении тимуса специальных лечебных мероприятий не требуется. Рекомендуется грудное вскармливание, рациональное питание, ограничение стрессов и контактов с инфекционными больными.
Объем медикаментозной терапии определяет иммунолог, наблюдающий ребенка с тимомегалией. Часто болеющим детям каждые 3-4 месяца показан прием адаптогенов и биостимуляторов (женьшеня, пантокрина, элеутерококка, лимонника китайского). С целью иммунокоррекции используется экстракт тимуса крупного рогатого скота. Дважды в год до достижения 5-6-летнего возраста ребенку назначаются курсы индукторов синтеза глюкокортикоидов (аммония глицирризината, этимизола).
При тяжелых заболеваниях, стрессах, а также перед оперативными вмешательствами детям с тимомегалией назначаются глюкокортикоиды (преднизолон, гидрокортизон). В случае развития синдрома тимусо-надпочечниковой недостаточности (апатии, сильной слабости, брадикардии, рвоты, диспепсии, артериальной гипотонии, признаков почечной недостаточности) показано введение преднизолона, инфузионных растворов, сердечных гликозидов, препаратов калия.
При тимомегалии I-II степени профилактическая вакцинация не противопоказана, но проводится на фоне гипосенсибилизирующей терапии и гипоаллергенной диеты. Детям с тимомегалией III степени при благоприятной эпидобстановке дается отвод от прививок на 6 месяцев (за исключением вакцинации против полиомиелита).
Прогноз и профилактика тимомегалии
Обычно тимомегалия у детей сохраняется до 3-6 лет, после чего размеры вилочковой железы приходят норму. Тем не менее, дети с тимомегалией более подвержены инфекционно-воспалительным и аллергическим заболеваниям, риску внезапной смерти от гипофункции коры надпочечников, сдавления увеличенным тимусом органов средостения.
Дети с тимомегалией должны состоять на диспансерном учете у педиатра, детского аллерголога-иммунолога, эндокринолога; проходить ежегодное лабораторно-инструментальное обследование. К возможным мерам по предупреждению тимомегалии можно отнести исключение перинатальных вредностей. Детям с увеличенной вилочковой железой следует избегать стрессов, контактов с инфекционными больными, своевременно проходить профилактические курсы лечения.
Источник
В. Л. Маневич, В. Д. Стоногин, Т. Н. Ширшова, И. В. Шуплов, С. В. Момотюк
II кафедра клинической хирургии (заведующий – профессор Тимофей Павлович Макаренко) Центрального института усовершенствования врачей на базе Центральной клинической больницы № 1МПС.
Публикация посвящается памяти Василия Дмитриевича Стоногина (1933-2005)
Заболевания вилочковой железы изучаются врачами различных специальностей: невропатологами, эндокринологами, иммунологами, гемато¬логами, хирургами, патогистологами и др. Проблема миастении является относительно изученной; в последние годы установлено участие вилочковой железы в таком жизненно важном процессе, как выработка (регулировка) иммунитета.
Опухоли и кисты вилочковой железы, миастения и некоторые аутоиммунные заболевания требуют хирургического лечения. Значительный вклад в этот сложный раздел внесли отечественные и зарубежные хирурги (А. Н. Бакулев и Р. С. Колесникова; В. Р. Брайцев; Б. К. Осипов; Б. В. Петровский; М. И. Кузин и соавт.; С. А. Гаджиев и В. Васильев; Viets, и др.).
С 1966 по 1973 год мы наблюдали 105 больных с различными заболеваниями переднего средостения, из них 66 с различными заболеваниями вилочковой железы. Эти больные были разделены на следующие клинические группы: 1-я – 30 больных с гиперплазией вилочковой железы и явлениями миастении; 2-я – 23 больных с опухолями вилочковой железы (тимомами), из них с доброкачественными 15, в том числе с явлениями миастении 9; со злокачественными 8, в том числе с явлениями миастении 5; 3-я – 4 больных с кистами вилочковой железы, все без миастении; 4-я – 3 больных с тератоидными образованиями; 13-я – 2 больных – лимфогранулематоз с изолированным поражением вилочковой железы; 6-я – 4 больных с апластической анемией на фоне аутоиммунной агрессии вилочковой железы.
Из 66 больных 65 были оперированы: 62 произведена радикальная и 3 эксплоративная операция.
С явлениями миастении под нашим наблюдением было 44 больных, из которых 43 (13 мужчин и 30 женщин) оперированы; возраст оперированных был от 14 до 55 лет, причем возраст большинства (25 больных) – от 15 до 30 лет. Среди больных с опухолями вилочковой железы преобладали 30-40-летние (13 больных).
Миастения – сложное нейроэндокринное заболевание, основным проявлением которого является слабость и особенно быстрая, патологическая мышечная утомляемость после физической нагрузки. Наряду с этим, согласно исследованиям ряда авторов (М. И. Кузин и соавт., и др.), при ми¬астении нарушается функция многих органов и систем (сердечно-сосудистой, дыхательной, пищеварительной, обмена веществ и т. д.).
Клиника миастении хорошо известна, однако правильный диагноз больному с миастенией нередко ставят после продолжительного наблюдения. У 32 из 44 наших больных правильный диагноз был поставлен только через 6-8 месяцев после появления первых признаков заболевания. Это объяс¬няется малой выраженностью клинической картины миастении в начальной стадии и плохой осведомленностью практических врачей, к которым впервые обращаются за помощью больные миастенией (невропатологи, окулисты, отоларингологи, терапевты).
При выраженной генерализованной форме миастении диагноз не труден. В начальной стадии и в случаях, когда миастения носит локализован¬ный характер (бульбарная, глазная, скелетно-мышечная, глоточно-лицевая), у наших больных предполагались самые разнообразные диагнозы, вплоть до подозрения на симуляцию. Считаем необходимым подчеркнуть особую важность прозериновой пробы, имеющей дифференциально-диагностическое значение. У больных миастенией внутримышечная инъекция 1-2 мл 0,05% раствора прозерина устраняет мышечную слабость и быструю утомляемость, в то время как при миопатиях и мышечной слабости, вызванных другими причинами, инъекция прозерина не дает эффекта. Имеют значение динамометрия, эргометрия и электромиография.
Общепризнано, что лечение миастении должно проводиться комплексно с участием 3-4 специалистов: невропатолога, терапевта-эндокринолога, анестезиолога-реаниматолога и хирурга. На основании большого клинического материала (сотни оперированных и наблюдаемых в отдаленном периоде) авторы подчеркивают преимущество оперативного лечения миастении перед консервативным (М. И. Кузин; А. С. Гаджиев и соавт., и др.). Результаты оперативного лечения лучше, если операцию производят впервые 2-2,5 года от начала заболевания. В более поздние сроки операция оказывается менее эффективной. Отсюда вытекает особая важность ранней диагностики миастении.
Из 43 оперированных нами больных в первый год заболевания миастенией поступили лишь 12, в сроки от 1 года до 3 лет – 23 и после 3 лет – 8 больных. Следовательно, больные поступали в клинику для оперативного лечения поздно.
Специальным методом исследования вилочковой железы является рентгеноконтрастный – пневмомедиастинография, которая позволяет судить о степени увеличения вилочковой железы, её структуре – отдель¬ный узел с четко ограниченными контурами или опухоль с инфильтрирую¬щим ростом и т. д.
Наличие у больного выраженной клинической картины прогрессирующей миастении является показанием к операции, так как все консервативные методы лечения, включая и рентгенотерапию, дают лишь временное улучшение.
У больных миастенией необходима специальная предоперационная подготовка, цель которой – снижение проявлений миастении путем индивидуального подбора дозы лекарственных препаратов. Дозировки препаратов подбирают строго индивидуально, с таким расчетом, чтобы в течение суток не наблюдалось периодов миастенического истощения, не наступало миастенического криза. Предоперационная подготовка, являясь симптоматической терапией, оказывает некоторое лечебное действие, что имеет положительное значение для предстоящей операции. Однако не у всех больных предоперационная подготовка, несмотря на ее комплексность и интенсивность, оказывается эффективной.
Вопрос о необходимости предоперационной рентгенотерапии нельзя считать окончательно решенным. Только 5 из наших больных перед операцией получали рентгеновское облучение, причем каких-либо улучшений в течении послеоперационного периода мы у них не отметили. У больных, оперированных по поводу злокачественной тимомы с явлениями миастении, предоперационное облучение играет важную роль в ближайшем исходе операции и в какой-то степени влияет на сроки наступления рецидива заболевания (М. И. Кузин и соавт.).
Большинство операций по поводу миастении нами выполнено из переднего доступа путем полной срединной продольной стернотомии. Наиболее ответственным моментом операции является отделение железы от левой плечеголовной вены. Ранение этого сосуда опасно из-за массивного кровотечения и возможной воздушной эмболии. В одном случае произошло ранение этой вены, закончившееся благополучно (был наложен боковой сосудистый шов). При операции следует избегать наложения зажимов на железистую ткань, раздавливания её.
У 3 наших больных было сочетание миастении и загрудинного зоба. Произведены тимэктомия и субтотальная струмэктомия.
У 26 больных во время операции была повреждена медиастинальная плевра, в том числе у 8 больных с обеих сторон. Осложнений, связанных с операционным пневмотораксом, не было. Если во время операции плевра не повреждена, переднее средостение дренируется одной резиновой трубкой, конец которой выводят в нижний угол раны или через отдельный прокол ниже мечевидного отростка и соединяют с отсосом. Вслед за тимэктомией трахеостома (превентивно) была наложена 5 больным.
Если сама операция тимэктомии по сравнению с другими торакальными операциями не представляет особой сложности, то течение послеоперационного периода у ряда больных сопровождается осложнениями, на 1-м месте среди которых стоит миастенический криз. Поэтому операции по поводу миастении возможны только в тех учреждениях, где можно обеспечить круглосуточное наблюдение анестезиолога-реаниматолога, а также многодневную аппаратную вентиляцию лёгких.
Вопрос о назначении антихолинэстеразных препаратов в послеоперационном периоде окончательно не решен. С целью уменьшения гиперсекреции бронхов лучше назначать прозерин с небольшими дозами атропина.
Тяжелый миастенический криз с расстройством дыхания, сердечной деятельности, глотания и т. д. наблюдали в первые дни после операции у 26 больных. Вывести из криза консервативными мероприятиями удалось 7 больных; 19 больным была наложена трахеостома с переводом их на аппаратное дыхание, длительность которого составляла от 3 до 40 суток. Через трахеостому систематически круглосуточно аспирируют слизь из трахеобронхиального дерева. Питание больных, находящихся на аппаратном дыхании, осуществляется через зонд. Помимо медикаментозного лече¬ния, применения кислорода, использования дыхательной гимнастики, в последние годы всем больным миастенией в послеоперационном периоде проводится лечебный массаж всего тела, повторяемый несколько раз в день.
Трахеостомическую трубку удаляют после того, как у больного стойко восстанавливается самостоятельное дыхание.
Из 43 оперированных по поводу миастении в первые дни после операции умерли 3 больных. Это относится к периоду, когда в клинике только осваивались эти операции. Все больные оперированы в тяжелом состоянии. Отдаленные результаты прослежены у 26 больных: выздоровление наступило у 17 и улучшение (больные принимают антихолинэстеразные препараты) – у 8 больных; состояние осталось без изменений у 3 больных. Двое оперированных умерли от рецидива злокачественной тимомы (один – с явлениями миастении через 3 года, другой – с инфарктом миокарда).
Доброкачественные опухоли вилочковой железы (тимомы) представля¬ют собой узлы округленной формы с плотной капсулой. При гистологическом исследовании в этих опухолях наряду с соединительнотканными клетками обнаруживаются фибробласты и концентрически расположенные вытянутые эпителиальные клетки, напоминающие тельца Гассаля. Эти опухоли по строению напоминают склерозирующую ангиому, еще их называют ретикулярной перителиомой (Pope и Osgood). Особое место занимают липотимомы. Одни авторы относят их к доброкачественным опухолям, другие – к злокачественным (Andrus и Foot). Опухоли эти нередко достигают боль¬ших размеров и состоят из жировой дольчатой ткани, содержащей скопления тимоцитов и гассалевых телец. Если в опухоли преобладает жировая ткань, её рекомендуют называть липотимомой, если преобладают элементы вилочковой железы – тимолипомой.
Среди наших больных мы наблюдали 3 (2 мужчин и 1 женщину, все старше 40 лет) с липотимомой. У них опухоль была небольших размеров, с ровными четкими границами; опухоль была расценена нами как доброкачественная. Заболевание сопровождалось умеренно выраженными явлениями миастении. Один из этих больных поступил с жалобами на слабость и быструю утомляемость; при дальнейшем обследовании у него была выявлена тяжелая гипопластическая анемия. Больной оперирован; в ближайшем послеоперационном периоде отмечены благоприятные результаты.
Из 15 наших больных с доброкачественными тимомами у 9 (4 мужчин и 5 женщин) были явления миастении, у остальных опухоль ничем себя не проявляла и была выявлена случайно.
Злокачественные тимомы – плотные, различных размеров бугристые опухоли, нередко прорастающие капсулу. У больных с этими новообразованиями из-за быстрого роста опухоли, прорастания соседних органов или сдавления их рано развивается синдром медиастинальной компрессии. Больные жалуются на боли за грудиной, чувство давления в грудной клетке и др. Нередко злокачественные тимомы протекают с явлениями миастении, отмеченной нами у 5 из 8 больных. Злокачественная тимома может протекать и совершенно бессимптомно. Приводим пример.
Больной М., 19 лет, поступил 17.III.1966 года. Жалоб нет. После окончания средней школы при прохождении медицинского обследования для поступления в учебное заведение у него рентгенологически было выявлено опухолевое образование в переднем средостении. Признаков миастении нет. Пневмомедиастинография: в переднем средостении со всех сторон окутанное газом образование продолговатой формы размером 15*5 см, с участками просветления в центре; заключение: опухоль вилочковой железы, возможно, с участками распада. Произведена тимэктомия. Гистологически: злокачественная тимома ретинулоклеточного типа. Проведена послеоперационная рентгенотерапия. Осмотрен через 4 года после операции:, жалоб нет, состояние хорошее, признаков рецидива нет.
Дифференциальный диагноз доброкачественных и злокачественных тимом нередко бывает трудным. Злокачественная тимома по рентгенологическим признакам напоминает лимфогранулематоз и лимфосаркому. В отличие от этих образований тимома располагается непосредственно за грудиной, обычно бывает овально-сплющенной или конусовидной формы. Всякая тимома, протекает она с явлениями миастении или без них, подлежит удалению, В литературе имеются указания, что каждую тимому следует рассматривать как потенциально злокачественную опухоль (Б. В. Петровский; Seybold и соавт., и др.).
Кисты вилочковой железы встречаются довольно редко. Обычно это тонкостенные образования различных размеров, расположенные в толще железы, выполненные желтоватой или коричневатой жидкостью. Из-за эла¬стичности этих образований признаков сдавления окружающих органов не наблюдается. Клиническая картина кист, если они протекают без миастении, бедна. Как правило их обнаруживают случайно, при профилактическом осмотре. Все наши 4 больных (3 женщины и 1 мужчина) были старше 40 лет (41 год – 48 лет). Ни у одного больного не было признаков миастении, хотя описаны сочетания кисты вилочковой железы и миастении. Все были оперированы (тимэктомия) с благоприятным результатом.
У 3 оперированных нами больных опухоль переднего средостения по гистологическому строению была тератомой. Учитывая тесную связь образования с остатками вилочковой железы и наличие в самом образовании ткани вилочковой железы, мы расценили опухоль как тератому вилочковой железы. У 2 больных на основании признаков (появление в мокроте сальных масс, волос у одной больной, а также обнаружение органоидных включений на рентгенограмме у другой) диагноз был поставлен до операции, у третьей больной – лишь во время операции. Из 3 оперированных больных у 2 при¬шлось удалить не только тератоидное образование, но и долю лёгкого из-за вовлечения последнего в процесс (прорыв нагноившейся тератомы в верхнедолевой бронх). Высокая степень злокачественного превращения тератоидных образований, возможность нагноения и другие осложнения убеждают в необходимости раннего и радикального хирургического удаления этих новообразований.
Вопрос о возможности изолированного поражения вилочковой железы лимфогранулематозом представляется спорным. Мы наблюдали 2 больных, у которых до операции был установлен диагноз “опухоль вилочковой железы”. После операции, при гистологическом исследовании препаратов, диагноз был изменен: изолированное поражение лимфогранулематозом вилочковой железы. Принимая во внимание указания о возможности изолированного поражения вилочковой железы на ранних стадиях заболевания (С. А. Гаджиев и В. В. Васильев), оба эти наблюдения мы отнесли к патологии вилочковой железы. После операции за больными ведётся наблюдение в течение 5 лет. Признаков рецидива и генерализации процесса нет.
Заболевание, заключающееся в сочетании патологии вилочковой желе¬зы и гипопластической анемии, которая возникает вследствие избирательного поражения костного мозга без изменения продукции лейкоцитов и тромбоцитов, впервые описано Кацнельсоном в 1922 году. Позже было предположено, что вилочковая железа влияет на гемопоэтическую функцию костного мозга, регуляцию состава белковых фракций, состояние лимфоидной системы и т. д. (Soutter и соавт.). С тех пор опубликованы данные некоторых авторов об отдельных операциях на вилочковой железе при различных болезнях крови (А. Н. Бакулев, 1958; Chaemers и Boheimer, и др.). К настоящему времени нами произведены 4 операции тимэктомии у больных гипопластической анемией. О результатах этих операций говорить пока рано, так как после них прошел небольшой срок. Ближайшие результаты удовлетворительные у 3 больных.
Выводы
- В вилочковой железе возникает ряд патологических процессов, которые требуют оперативного лечения.
- Оперативное лечение по поводу миастении оправдано как при наличии рентгенологически и клинически определяемой опухоли, так и лишь при гиперплазии вилочковой железы.
- Операцию рекомендуется производить в ближайшее время после установления диагноза. Лучевое лечение целесообразно проводить после удаления злокачественной опухоли или если произвести радикальную операцию невозможно.
ЛИТЕРАТУРА.
1) Бакулев А. Н., Колесникова Р. С. Хирургическое лечение опухолей и кист средостения. М., 1967.
2) Брайцев В. Р. Врожденные дизонтогенетические образования средостения и легких. М., 1960.
3) Гаджиев С. А., Догель Л. В., Ваневский В. Л. Диагностика и хирургическое лечение миастении. Л., 1971.
4) Гаджиев С. А., Васильев В. Мед газета, 1973, №15.
5) Кузин М. И. Клин мед, 1969, № 11, с. 6.
6) Кузин М. И., Успенский Л. В., Волков Б. П. Вести, хир., 1972, №7, с.48.
7) Осипов Б. К. Хирургические заболевания легких и средостения. М., 1961.
8) Петровский Б. В. Хирургия средостения. М., 1960.
9) Andгus W., Fооt N., J. thorac. Surg., 1937, v. 6. p. 648.
10) Chaemers G., Boheimer K., Brit. med. J., 1954, v.2, p.1514.
11) Pope R., О s g о о d R., Am. J. Path., 1953, v. 20, p. 85.
12) S е у b о 1 d W., D о n a 1 d М. С., J. thorac. Surg. Clagett C. et al., 1950, v. 20, p.195.
13) Soutter G., Sommers Sh. R e 1 m о n Ch. et al. Ann. Surg., 1957, v. 146, p. 426.
14) Viets H., Brit. med. J., 1950, v. 1, p.139.
Данные об авторах:
Восстановление текста, компьютерная графика – Сергей Васильевич Стоногин.
Любое копирование материала запрещено без письменного разрешения авторов и редактора.
Работа защищена Федеральным законом о защите авторских прав РФ.
Источник
