Лихорадка при асептическом воспалении
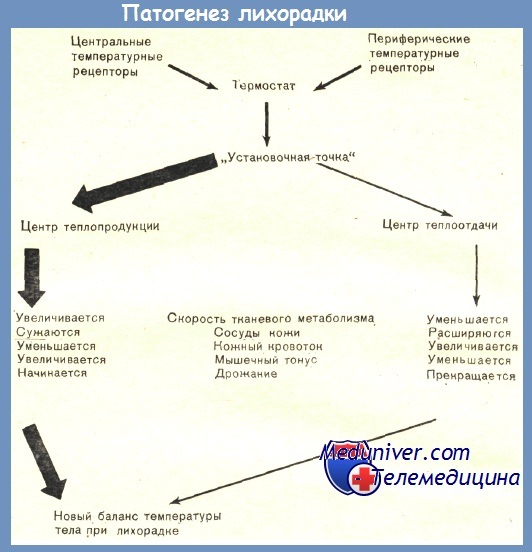
Механизм развития лихорадки – патогенезПовышение температуры тела является распространенным клиническим симптомом, отмечается при самых различных заболеваниях и возникает разными путями. Понимание основ патофизиологии важно для рационального лечения детей с высокой температурой тела. Различают два типа повышения температуры тела — лихорадку и тепловые заболевания. Лихорадка — это состояние, при котором центр терморегуляции стремится к увеличению температуры тела. Тепловые заболевания — это такие состояния, при которых температура тела повышается в результате действия внутренних или внешних факторов вопреки попыткам центра терморегуляции удержать нормальную температуру. Лихорадка как терморегуляторая реакция организмаВ клинической практике наиболее распространенным механизмом повышения температуры тела является увеличение референтной температуры «установочной точки», локализованной в преоптической области передней части гипоталамуса (ПОПГ). В этих условиях «установочная точка» настраивается на более высокую, чем в норме, температуру и воспринимает сущствующую температуру «ядра» как очень низкую, хотя на самом деле она является нормальной. «Установочная точка» дает команды на увеличение температуры тела путем повышения активности центра теплопродукции и снижения активности центра теплоотдачи. Строго говоря, только такое состояние, при котором центр терморегуляции сам активно стремится к более высокой, чем в норме, температуре тела, имеет право называться лихорадкой. Все другие состояния, протекающие с повышением температуры, правильно именовать как повышенная температура тела (также правомерно использовать термины: пирексия, гиперпирекоия, гипертермия, или тепловая болезнь). Хотя в настоящее время все типы повышения температуры тела, часто весьма неточно, обозначаются термином лихорадка, в этой книге мы проведем различие между лихорадкой и другими типами гипертермии. При лихорадке неверно программированная «установочная точка» заставляет препотическую область гипоталамуса функционировать таким образом, как если бы фебрильная температура была нормальной. При этом достигается новое равновесие между теплопродукцией и теплоотдачей уже на фоне повышенной температуры тела. Терморегуляторный контроль остается эффективным, но при более высоком, чем в норме, уровне. У собак при лихорадке отмечается избыточный термогенный ответ на холод и уменьшенный тер’молитический ответ на тепло. Животные реагируют на изменения окружающей температуры таким образом, чтобы удержать организм в равновесии с новой температурой «установочной точки». Cooper описал несколько интересных больных с исходной гипотермией, вызванной различными заболеваниями ЦНС или неизвестными причинами. Возможно, что у этих больных механизм терморегуляции не был поврежден, но была более низкая, чем в норме, температура «установочной точки». При введении пирогена у них отмечалось повышение температуры тела. Степень этого повышения была такой же, как у больных с нормальным исходным уровнем, однако температура, естественно, не достигала таких же абсолютных величин. Lipton сообщил о больном с саркоидозом ЦНС и глубокой гипотермией. У этого больного сохранялась способность к развитию лихорадки, что указывает на независимость механизма контроля температуры тела от механизма возникновения лихорадки. Stitt подчеркнул, что повышение температуры тела при лихорадке представляет собой центрально регулируемый ее подъем, который полностью направляется, контролируется и защищается функциональными терморегуляторными механизмами.
Механизм (патогенез) развития лихорадкиУвеличение температуры «установочной точки» преоптической области гипоталамуса. Повышение температуры «установочной точки» преоптической области гипоталамуса почти всегда возникает под влиянием эндогенного пирогена — вещества, выделяемого фагоцитирующими лейкоцитами и макрофагами. Эндогенный пироген является конечным общим звеном при подавляющем большинстве фебрильных заболеваний. Исключением является действие облучения ЦНС, яда скорпиона и ДДТ, которые прямым путем увеличивают температуру «установочной точки». Было предложено, что адреналин и норадреналин при передозировке могут прямым образом повышать температуру «установочной точки» преоптической области гипоталамуса. Некоторые виды опухолей выделяют эндогенные пирогены или эндогенные пирогеноподобные вещества. Повреждение мозга способно повлиять на «установочную точку», как и на другие области преоптической области гипоталамуса. Эндогенный пироген при развитии лихорадкиБактериальный эндотоксин при внутривенном введении вызывает лихорадку только после латентного периода, продолжающегося около 90 мин. Эндогенный же пироген при том же способе введения вызывает лихорадку в течение нескольких минут. Человеческая кровь после инкубации с бактериальным эндотоксином при ее введении добровольцам также быстро вызывает лихорадку, что подтверждает мнение о выделении эндогенного пирогенного вещества лейкоцитами. Большинство исследований показало, что введение эндотоксина непосредственно в преоптической области гипоталамуса неэффективно, в то время как инъекция даже минимальной дозы эндогенного пирогена в ту же область немедленно вызывает лихорадку. Однако в одной из работ описана лихорадка при прямом введении эндотоксина в желудочки или переднюю часть гипоталамуса мозга крыс. Первоначально предполагали, что только циркулирующие полиморфноядерные лейкоциты могут выделять эндогенный пироген. Поэтому развитие лихорадки у больных с гранулоцитопенией казалось загадкой. Однако впоследствии было доказано, что большинство, если не все, фагоцитирующих клеток, развивающихся из костномозговых предшественников, выделяют эндогенный пироген. Некоторые клетки, не происходящие из костного мозга, например фибробласты, фагоцитируют частицы латекса в культуре тканей, но они не выделяют эндогенный пироген. Продуцировать эндогенный пироген могут альвеолярные и перитонеальные макрофаги, а также ретикулоэндотелиальные клетки печени и селезенки. Эндотоксин, который быстро связывается с циркулирующими гранулоцитами, вызывает лихорадку прежде всего путем стимуляции выработки этими клетками эндогенного пирогена. С другой стороны, живые бактерии и вирусы элиминируются из крови главным образом ретикулоэндотелиальной системой и вызывают лихорадку путем стимуляции образования и освобождения эндогенного пирогена клетками этой системы в печени и селезенке. Хотя лимфоциты не образуют эндогенный пироген, они выделяют лимфокинин, который стимулирует продукцию и выделение эндогенного пирогена гранулоцитами и моноцитами. Освобождение эндогенного пирогена отмечается не только при инфекционных заболеваниях. Основным пусковым механизмом образования и выделения эндогенного пирогена является фагоцитоз микроорганизмов, комплексов антиген—антитело, погибших или поврежденных клеток, клеточных фрагментов. Например, при введении эритроцитов группы D больным с антителами против антигена D отмечаются озноб и лихорадка после латентного периода продолжительностью 90 мин, что подтверждает наличие промежуточного этапа в продукции эндогенного пирогена. Эндогенный пироген образуется при аллергических заболеваниях, болезнях соединительной ткани и воспалительных реакциях в ответ на опухоли. По-видимому, существует особый механизм развития лихорадки при травме и тканевой деструкции. Эндогенный пироген — это белок с низкой молекулярной массой. После того как он выделился фагоцитирующими клетками, он покидает кровоток и быстро проникает в преоптическую область гипоталамуса. Эндогенный пироген является чрезвычайно мощным веществом и способен вызвать лихорадку у лабораторных животных при внутривенном введении в нанограммовых количествах. В настоящее время считается, что эндогенный пироген не содержится как таковой в фагоцитирующих клетках, а образуется в них под воздействием соответствующих стимулов. Этот этап требует определенного времени, так как включает синтез новой информационной РНК. Секреция эндогенного пирогена не ведет к лизису или гибели фагоцитов. Нейромедиаторы, действующие в установочной точке при лихорадкеЕсть серьезные основания предполагать, что нейрохимическим медиатором, повышающим температуру «установочной точки» преоптической области гипоталамуса при воздействии эндогенного пирогена, является простагландин. Минимальные дозы простагландинов E1 и Е2 при инъекции их в мозг лабораторных животных быстро вызывают лихорадку. Парентерально введенные простагландины, как правило, являются пирогенными только в больших дозах, возможно, из-за их инактивации в легких. Однако лихорадочные реакции были отмечены у больных после инъекций простагландина Е2; описана выраженная пирексия после его внутривлагалищного введения. Увеличение концентрации простагландинов обнаружено в мозге лабораторных животных во время лихорадки. Ингибирование простагландинсинтетазы ЦНС (ацетилсалициловой кислотой или парацетамолом) ведет к снижению температуры тела при лихорадке, но не влияет на нормальную температуру. Это наблюдение подтверждает мнение о том, что значение простагландинов в преоптической области гипоталамуса ограничено повышением температуры «установочной точки» при лихорадке, а в нормальных условиях они не играют роли. Значение таких медиаторов, как циклический АМФ и моноамины, неясно . Развитие лихорадкиПроцесс развития лихорадки при повышении температуры «установочной точки» преоптической области гипоталамуса включает сложную серию эффекторных шагов. Нарастает метаболическая активность и повышается напряжение кислорода, вызванные в первую очередь увеличением мышечного тонуса, которое иногда может переходить в дрожание. Также отмечается общее увеличение скорости метаболизма, независимо от возрастания активности скелетной мускулатуры. После введения бактериального эндотоксина усиление метаболической активности является самым ранним термогенным эффектом . Вскоре после этого развивается вазоконстрикция сосудов кожи, что ведет к снижению ее температуры и уменьшению потерь тепла путем радиации, кон-дукции и конвекции. Это особенно заметно в конечностях. Замедление кожного кровотока также способствует снижению потоотделения. Пилоэрекция, служащая у современного человека больше символом, чем способом сохранения тепла, является рудиментарным отголоском далеко прошлого, когда волосяной покров был для человека эффективной теплозащитой. Снижение температуры кожи субъективно воспринимается как ощущение холода, и больной старается согреться, несмотря на рост внутренней температуры тела. Ребенок сворачивается калачиком, что ведет к уменьшению площади открытой поверхности тела, и плотно натягивает на себя одеяло. Охлаждение кожи также включает сенсорную обратную связь с преоптической областью гипоталамуса, что еще больше вызывает усиление теплопродукции. Нередко начало лихорадки, особенно внезапное, сопровождается ознобом — сильным ощущением холода в сочетании с интенсивным дрожанием. Хотя озноб считается типичным для гнойных инфекций и бактериемии, его диагностическое значение оказалось меньшим, чем ранее предполагалось. Озноб может наблюдаться при вирусных и бактериальных инфекциях, а также при неинфекционных заболеваниях, таких, как лимфома. Важно помнить, что жаропонижающие средства могут вызывать озноб при снижении температуры тела до нормального уровня. Такое побочное действие этих препаратов не следует путать с ознобом, обусловленным основным заболеванием. Температура тела нарастает до тех пор, пока она не достигнет референтной температуры «установочной точки». При этом теплопродукция снова приходит в равновесие с теплоотдачей, хотя и при более высокой, чем в норме, температуре. Больной ощущает прилив тепла или по крайней мере больше не страдает от холода. Кожная температура при этом повышается, что отражает высокую температуру «ядра» и возросшую скорость метаболизма. Дальнейшему росту температуры кожи также способствует резко усиленная теплопродукция скелетной мускулатуры, расположенной под кожей. В одном из исследований при клиническом осмотре было обнаружено, что кожа была горячей у 60% детей с лихорадкой. – Также рекомендуем “Каков верхний предел повышения температуры тела? Предел лихорадки” Оглавление темы “Повышение температуры тела у ребенка – лихорадка”:
|
Источник
Острым инфекционно-воспалительным заболеваниям глотки свойственны высокий уровень распространенности, не имеющий социально-значимой тенденции к снижению, полиэтиологичность, сложность диагностики, обусловленная разнообразием клинических проявлений. Сезонность, проявляющаяся ростом уровня заболеваемости в холодное время года, напрямую связана с периодичностью, присущей острым респираторным вирусным заболеваниям, которые сопровождаются воспалительными изменениями в верхних отделах дыхательных путей, как правило, затрагивающими глотку [3, 6]. Высокий уровень заболеваемости, в т. ч. среди людей молодого, трудоспособного возраста и детей, обосновывает актуальность проблемы поиска оптимальных средств и методов лечения данной категории больных. Эффективность терапевтических мероприятий определяется их этиопатогенетической обоснованностью, а также тем, насколько подробно проведен анализ клинической картины заболевания, насколько полно учтены индивидуальные особенности организма пациента.
Защитные свойства глотки определяются рядом факторов: целостностью слизистой оболочки, состоянием лимфоидной ткани, уровнем содержания секреторных иммуноглобулинов (в первую очередь иммуноглобулина А) в ротоглоточном секрете, активностью неспецифических защитных факторов: лизоцима, эндогенного интерферона, фагоцитарной активностью [1, 4]. В этиологии острого тонзиллофарингита важную роль играет инфекционный фактор, причем вирусы составляют до 15–40% у детей и 30–65% – у взрослых, бактерии (в первую очередь стрептостафилококковая флора и гемофильная палочка) – 30–40% у взрослых и 5–10% – у детей [6, 7].
Ответной реакцией организма на внедрение инфекционного агента является развитие воспалительного процесса, включающего ряд защитных механизмов: усиление кровотока, изменение проницаемости сосудистой стенки, повышение активности макрофагов и полиморфонуклеарных клеточных элементов, выделение медиаторов воспаления, свободных кислородных радикалов. Активную роль в защитном механизме воспалительного процесса играют макрофагальные клетки. Макрофаги, выделяя цитокины, вызывают через ряд промежуточных реакций повышение уровня Т-лимфоцитов. Установлено, что в возникновении неспецифических инфекционно-воспалительных заболеваний глотки и верхних отделов дыхательных путей существенная роль принадлежит дисбалансу факторов локального и системного иммунитета. Упорное, затяжное течение заболевания, выраженность гомотоксикоза, проявляющаяся развитием сопряженных заболеваний, хронизация патологического процесса – эти и подобные клинические проявления напрямую связаны с формированием иммунного дисбаланса [8].
В связи с упоминанием понятия иммунного дисбаланса целесообразно подчеркнуть практическую значимость четкой формулировки основных понятий иммунологической недостаточности и способов лабораторной диагностики, используемых в современной широкой медицинской практике. Первичная (врожденная) иммунологическая недостаточность – неспособность организма реализовать то или иное звено иммунного ответа вследствие генетически обусловленного дефекта или нарушения развития лимфоидной системы в онтогенезе. Существенно чаще встречается вторичная (приобретенная) иммунологическая недостаточность – различных экзогенных факторов (инфекции, опухоли, почечная недостаточность, длительное применение глюкокортикостероидов, цитостатиков, салицилатов). Иммунологическая лабораторная диагностика включает тесты двух уровней. К тестам 1-го уровня относятся: определение абсолютного и относительного числа лимфоцитов; T- и В-лимфоцитов; уровня сывороточных lg (IgM, IgG, IgA); фагоцитарной активности лейкоцитов. Группа тестов 2-го уровня включает: определение регуляторных субпопуляций (Т-хелперов, Т-супрессоров); интерлейкин-продуцирующей активности клеток; оценку пролиферативной активности Т- и В-лимфоцитов в реакции бласттрансформации; киллерной активности лимфоцитов; выявление иммунных комплексов и др. [8].
Клиническая картина острых инфекционно-воспалительных процессов в глотке включает как общие, так и местные – фарингеальные проявления. Классические признаки воспаления сформулировал Авл Корнелий Цельс и дополнил Клавдий Гален: rubor («краснота», покраснение, эритема), tumor («опухоль», припухлость, отек), calor («жар», гипертермия), dolor («боль»), functio laesa (нарушение функции). Наиболее распространенные заболевания глотки (тонзиллофарингиты) относятся к острому и подострому экссудативному типу воспаления и проявляются диффузным покраснением (гиперемия), местным повышением температуры (гипертермия), тканевым отеком (следствие гиперосмии), затруднением глотания (нарушение функции), болью (гипералгия).
Интенсивность болевых ощущений при острых инфекционно-воспалительных процессах в глотке достаточно вариабельна и определяется не только тяжестью заболевания, но и индивидуальными особенностями пациента [2]. Важное практическое значение имеет использование стандартизованных аналоговых шкал и анкет по оценке интенсивности болевых ощущений. В настоящее время распространены оценочные шкалы и анкеты, к составлению которых существуют два основных подхода: оценка интенсивности боли по критерию «насколько пациент страдает» и оценка влияния боли на самочувствие в целом, «психологическое состояние, качество жизни». Удобны и информативны шкалы для субъективной оценки пациентом выраженности боли в момент исследования: визуальная аналоговая шкала боли (ВАШ, visual analog scale – VAS) и цифровая рейтинговая шкала (ЦРШ, numerical rating scale – NRS) [13, 17].
Особую настороженность должны вызывать у практикующего врача симптомы, позволяющие заподозрить потенциально опасные состояния: затруднение дыхания, тризм жевательной мускулатуры, острые нагноительные процессы в глотке, изъязвления и распространенные налеты в ротоглотке, кожная сыпь, полилимфаденопатия, пиретическое и гиперпиретическое повышение температуры тела, интенсивная головная, абдоминальная боль.
Острые инфекционно-воспалительные заболевания глотки, как правило, сопровождаются повышением температуры тела – одним из признаков неспецифического патологического процесса – лихорадки. Лихорадка (лат. febris) рассматривается как защитно-приспособительный механизм организма, возникающий в ответ на действие патогенных раздражителей, обладающих пирогенными свойствами. Лихорадочное состояние чаще всего развивается при инфекционных болезнях, но может возникать и в ответ на воздействие эндотоксинов и эндогенных пирогенов, источником которых служат нейтрофильные лейкоциты и патологически измененные тканевые элементы при септическом воспалении, аутоиммунных и обменных нарушениях. В патогенезе лихорадочных состояний выделяют следующие основные элементы: бактериальные пирогены (липополисахариды), фагоцитоз с образованием эндогенных пирогенов (нейтрофилы, моноциты, эозинофилы и макрофаги), иммунореактивные процессы, вовлекаемые в воспалительную реакцию, и спонтанное выделение эндогенных пирогенов патологически измененными клетками (к примеру, при остром лейкозе) [9].
В клинической практике используется выделение нескольких основных видов лихорадки: в зависимости от причины возникновения – инфекционная и неинфекционная лихорадка; по степени повышения температуры тела – субфебрильная (37–37,9°С), фебрильная (38–38,9°С), пиретическая, или высокая (39–40,9°С), гиперпиретическая, или чрезмерная (≥41°С); по длительности – острая (≤15 дней), подострая (16–45 дней), хроническая (≥46 дней).
В течении лихорадки различают период нарастания температуры (stadium incrementi), разгара лихорадки (fastigium, или acme) и снижения температуры (stadium decrementi). Снижение температуры происходит по-разному. Постепенное снижение температуры в течение 2–4 сут с незначительными вечерними подъемами называют лизисом. Внезапное, быстрое окончание лихорадки с падением температуры до нормы в течение суток – кризисом.
По характеру температурной кривой выделяют следующие типы лихорадки:
1. Постоянная лихорадка (febris continua) – температура тела обычно высокая, держится в течение нескольких дней с суточными колебаниями в пределах 1°С (при крупозной пневмонии).
2. Послабляющая, или ремитирующая, лихорадка (febris remittens) – суточные колебания температуры составляют 1–2°С, без достижения нормального уровня (при нагноительных процессах).
3. Перемежающаяся, или интермитирующая, лихорадка (febris intermittens) – чередование нормальной и повышенной температуры через 1–3 дня (при малярии).
4. Гектическая, или истощающая, лихорадка (febris hectica) – суточные или с интервалами в несколько часов колебания температуры свыше 3°С с резким падением и подъемом (при септических состояниях).
5. Возвратная, или рекуррентная, лихорадка (febris recurrens) – периоды повышения температуры до 39–40°С сменяются периодами нормальной или субфебрильной температуры (при возвратном тифе, малярии).
6. Волнообразная лихорадка (febris undulans) – постепенное в течение нескольких дней повышение и последующее постепенное снижение температуры тела (при лимфогранулематозе).
7. Неправильная, или нерегулярная, лихорадка (febris irregularis) – суточное колебание температуры тела без определенной закономерности (при пневмонии, гриппе, онкологических заболеваниях).
8. Обратная, или извращенная, лихорадка (febris inversus) – утренняя температура тела выше вечерней (при сепсисе, бруцеллезе).
9. Извращенная лихорадка – утренняя температура выше вечерней (при туберкулезе, вирусных болезнях, сепсисе).
Важные сведения для постановки правильного диагноза дает анализ сочетания лихорадки с другими клиническими проявлениями болезни: неспецифическими симптомами (слабость, потливость, утомляемость), органными (абдоминальная боль, гепатомегалия, артралгия) и гемостатическими (ускоренная СОЭ, лейкоцитоз, повышение уровня фибриногена, изменения в структуре глобулиновых фракций) изменениями [9].
В плане дифференциальной диагностики лихорадочных состояний следует принимать во внимание возможные причины так называемой лихорадки неясного генеза, в первую очередь инфекции, новообразования, диффузные заболевания соединительной ткани, исключить возможную лекарственную лихорадку. Помимо лихорадки повышение температуры тела может наблюдаться в результате нарушения теплового баланса в экстремальных термических условиях (перегревание); при патологии периферических механизмов терморегуляции (эндокринные нарушения, приводящие к избыточной теплопродукции; мышечные гиперкинезы, судороги, нарушение теплоотдачи при спазмах сосудов, ангидрозе), при центральных нарушениях механизмов терморегуляции (наркоз, коматозные состояния, интоксикации). Принципиально отличается механизм повышения температуры тела при лихорадке и гипертермии. Причиной гипертермии (перегревание, накопление избыточного тепла в организме) могут стать такие внешние факторы, как не по сезону теплая одежда, пребывание в жарком и душном помещении, что сопровождается увеличением поступления тепла извне и затруднением теплоотдачи во внешнюю среду. Предрасполагающие к гипертермии факторы – избыточная физическая нагрузка, алкогольное опьянение, детский возраст (особенно в течение первых 3 мес. жизни). При перенапряжении физиологических механизмов терморегуляции, при гиперпиретической температуре тела развивается тепловой удар [9].
Лечебная тактика при инфекционно-воспалительных заболеваниях глотки предполагает рациональное использование лекарственных препаратов, обладающих противовоспалительным, анальгезирующим, противомикробным, иммунокорригирующим действием: топических иммунокорригирующих вакцинных препаратов, локальных антисептиков, противоотечных и гипосенсибилизирующих препаратов. При стрептококковом тонзиллофарингите рекомендована системная антибактериальная терапия. Антибактериальные препараты следует назначать исключительно при наличии строгих показаний, соблюдать адекватный режим дозирования и продолжительность терапии [1, 7].
Клинический опыт показывает, что вполне обоснованным при острой инфекционно-воспалительной патологии глотки, сопровождающейся лихорадкой и болевыми ощущениями, является использование препаратов, обладающих симптоматическим терапевтическим действием. Симптоматическая терапия, которая направлена на нормализацию температуры тела, купирование боли и воспаления, восстановление общего состояния больного, его работоспособности, бытовой и социальной активности, должна рассматриваться как важное звено в комплексе лечебных мероприятий. В этой связи представляется важным, что нестероидные противовоспалительные препараты (НПВП) являются активным компонентом комплексной терапии многих инфекционно-воспалительных заболеваний и остаются одним из наиболее широко используемых в клинической практике классов лекарственных средств [5]. НПВП обладают анальгетическим, антипиретическим и противовоспалительным действием. Известно, что появление болевых ощущений при воспалительных процессах связано с образованием в месте воспаления простагландинов, которые раздражают болевые рецепторы и вызывают появление субъективного ощущения боли.
Принцип обезболивающего действия НПВП основан на подавлении активности циклооксигеназы 1-го типа (ЦОГ-1) и циклооксигеназы 2-го типа (ЦОГ-2) – основных ферментов, необходимых для образования простагландинов [16]. Представителем этой группы является препарат ОКИ (лизиновая соль кетопрофена). Препарат обладает антибрадикининовой активностью, стабилизирует лизосомальные мембраны и задерживает высвобождение из них ферментов, способствующих разрушению тканей при хроническом воспалении, снижает выделение цитокинов, тормозит активность нейтрофилов. Лизиновая соль кетопрофена оказывает противовоспалительное, обезболивающее и жаропонижающее действие. Препарат обладает выраженным противовоспалительным действием [11, 12]. Быстрое начало действия объясняется более высокой растворимостью лизиновой соли кетопрофена по сравнению с неизмененным кетопрофеном, более быстрым и полным всасыванием действующего вещества, что приводит к достижению пика его концентрации в плазме крови при пероральном приеме уже через 15 мин. Эффект препарата проявляется через 15–20 мин и сохраняется в течение нескольких часов, тогда как неизмененный кетопрофен достигает максимума только через 60 мин после приема. Жаропонижающий эффект ОКИ наступает быстрее и длится дольше по сравнению с ибупрофеном и парацетамолом [10, 16]. Сравнительные исследования показали, что анальгетическая эффективность ОКИ выше и проявляется быстрее, чем у ибупрофена и парацетамола [14, 15].
Препарат ОКИ удобен в применении, поскольку имеет различные формы выпуска: гранулы для приготовления раствора для приема внутрь, суппозитории ректальные (для симптоматического лечения воспалительных процессов, сопровождающихся лихорадкой и болевыми ощущениями), а также раствор для местного применения (для симптоматического лечения воспалительных орофарингеальных заболеваний). Для приема внутрь взрослым и детям старше 14 лет следует использовать разовую дозу 80 мг 3 р./сут. Детям 6–14 лет и пожилым пациентам рекомендовано использовать половину дозы – 40 мг. Ректально детям 6–12 лет назначают по одному суппозиторию ОКИ 60 мг 1–2 р./сут; детям старше 12 лет – до 3 р./сут, взрослым – по одному суппозиторию ОКИ 160 мг 2–3 р./сут (пожилым пациентам – не более 2 суппозиториев в сутки). Местно препарат используют в форме раствора для полосканий 2 раза в течение суток.
Важный аспект использования лекарственных препаратов для симптоматической терапии – их безопасность и переносимость. При назначении терапии НПВП особое внимание уделяется, прежде всего, нежелательным явлениям со стороны ЖКТ и кроветворной системы. В данном аспекте лизиновая соль кетопрофена имеет преимущества по сравнению с кетопрофеном, поскольку гораздо реже вызывает побочные явления. Благодаря своему химическому составу ОКИ быстро растворяется с нейтральной рН и за счет этого почти не оказывает раздражающего воздействия на слизистую оболочку ЖКТ. Клиническими исследованиями установлено, что при 10-дневном курсе приема препарата ОКИ общая переносимость терапии пациентами и данные гастроскопии были сравнимы с плацебо [11]. ОКИ относится к НПВП, обладающим коротким периодом полувыведения (1,6–1,9 ч), что снижает вероятность кумуляции препарата и развития побочных эффектов.
Для повышения эффективности медикаментозной терапии пациенты с острыми инфекционно-воспалительными заболеваниями глотки должны строго следовать следующим поведенческим рекомендациям: соблюдать рекомендованный врачом режим (постельный, домашний), исключить курение (в т. ч. пассивное) и употребление алкоголя, соблюдать механически щадящую диету, исключить из пищевого рациона горячие, холодные, острые, соленые продукты и напитки, использовать обильное теплое (37–39°С) питье.
Таким образом, клинический эффект при острой фарингеальной патологии обеспечивает совокупность своевременной точной диагностики, дифференциальной диагностики состояний, сопровождающихся повышением температуры тела, и рациональный комплекс лечебных мероприятий с дифференцированным выбором лекарственной терапии.
Литература
1. Балабанова Р.М., Гришаева Т.П. Диагностика и антибактериальная терапия острого стрептококкового тонзиллита // Consilium Medicum. Справочник поликлинического врача. Оториноларингология. 2005. № 3. С. 2–4.
2. Бабияк В.И., Говорухин М.И., Митрофанов В.В. Некоторые психологические аспекты проблемы «качества жизни человека» // Российская оториноларингология. 2004. №1 (8). С. 3–6.
3. Колобухина Л.В. Вирусные инфекции дыхательных путей // РМЖ. 2000. Т. 8, № 13–14 (114–115). С. 559–564.
4. Морозова С.В. Иммуномодуляторы в лечении хронического тонзиллита: проблемы и перспективы. Проблема реабилитации в оториноларингологии. Труды всероссийской конференции с международным участием. Самара, 2003. С. 379–380.
5. Насонов Е.Л., Каратеев Д.Е. Применение нестероидных противовоспалительных препаратов // РМЖ. 2006. Т.14, № 25. С. 1769–1777.
6. Рязанцев С.В. Этиопатогенетическая терапия острых фарингитов: Метод. рекомендации. СПб: СПБ НИИ уха, горла, носа и речи, 2008. 40 с.
7. Свистушкин В.М. Эмпирическая антибактериальная терапия при острых воспалительных заболеваниях верхних отделов дыхательных путей // Русский медицинский журнал. 2005. Т. 13 (4). С. 216–219.
8. Хаитов Р.М., Пинегин Б.В., Ярилин А.А. Руководство по клинической иммунологии. Диагностика заболеваний иммунной системы. Руководство для врачей. М.: ГЭОТАР-Медиа, 2009. 345 с.
9. Черкасов В.Л., Старшинова В.С., Сухорослова Л.И. и др. Дифференциальная диагностика лихорадочных состояний в клинике инфекционных болезней. М.: ММА им. И.М. Сеченова, 1997. 76 с.
10. D’Arienzo M. Summary of product characteristics // Drugs Exptl. Clin. Res. 1984 Vol. X(12). P. 863–866.
11. Bellussi L. et al. Antiphlogistic therapy with ketoprofen lysine salt vs nimesulide in secretory otitis media, rhinitis/rhinosinusitis, pharyngitis/tonsillitis/tracheitis // Note di Terapia Otorinolaringol. 1996. Vol. 46. P. 49–57.
12. Carrabba M., Chevallard M., Mele G. et al. Ketoprofene in treatment of rheumatoid arthritis: efficacy and tolerability of two therapeutic schedules with evaluation of synovial prostaglandin levels // Curr. Ther. Res. 1987. Vol. 42(1). P. 70–76.
13. Haefeli M., Elfering A., Aebi M. et al. What comprises a good outcome in spinal surgery? A preliminary survey among spine surgeons of the SSE and European spine patients // Eur. Spine J. 2008. Vol. 17. P. 104–116.
14. Ligniere G.C. et al. Ricenti Progressi in Medicina, II Pensiero Scientifico Editore.1996. Vol. 87 (Suppl. al № 3).
15. Messeri A., Busoni P., Noccioli B. et al. Analgesic efficacy and tolerability of ketoprofen lysine salt vs paracetamol in common paediatriс surgery. A randomized, single-blind, parallel, multicenter trial // Pediatric. Anaesthesia. 2003. Vol. 13. P. 5.
16. Principi N. Guidelines for the therapeutic use of NSAIDs in pediatrics // Min. Pediatr.1997. Vol. 49(9). P. 379–386.
17. Wewers M.E., Lowe N.K. A critical review of visual analogue scales in the measurement of clinical phenomena // Res. Nurs. Health. 1990. Vol. 13. P. 227–236.
Источник
