Лучший антибиотик при воспалении костей
Уточнить
Фармацевтические препараты, применяемые по показанию инфекции костей и суставов
Аугментин – п/с пенициллин амоксициллин широкого спектра + клавулановая к-та с активностью против м/о, устойчивых к пенициллинам и цефалоспоринам. Суспензия для приема внутрь детям с 3-х месяцев. Оригинальный препарат от производителя СмитКл
Аугментин – п/с пенициллин амоксициллин широкого спектра + клавулановая к-та с активностью против микроорганизмов, устойчивых к пенициллинам и цефалоспоринам. Оригинальный препарат от производителя СмитКляйн Бичем (Великобритания). Таблетки.
Ванкомицин (ванкомицин): Антибиотик гликопептид. Порошок для приготовления раствора.
Клиндамицин Дж (клиндамицин, р-р для в/в и в/м введения). Антибиотик-линкозамид широкого спектра действия для парентерального лечения тяжелых инфекций. Производитель: «Джодас Экспоим» (Индия).
Цефоперазон+[Сульбактам]: антибиотик-цефалоспорин + бета-лактамаз ингибитор. Порошок для приготовления раствора для внутривенного и внутримышечного введения.
Цефоперазон-Виал (цефоперазон, для в/м и в/м введения). Цефалоспориновый антибиотик III поколения с широким спектром действия только для парентерального введения. Устойчив к действию многих бета-лактамаз. Производитель: «Северо-Китайская ФК» (Китай).
Цефтриаксон (цефтриаксон): Антибиотик цефалоспорин III поколения. Порошок для приготовления раствора.
Противомикробное средство комбинированное. Таблетки, покрытые пленочной оболочкой.
Ципролет таблетки (ципрофлоксацин): Антибактериальный, фторхинолон. Таблетки.
Цефтриаксон: антибиотик-цефалоспорин. Порошок для приготовления раствора для инфузий.
Цефокситин: антибиотик – цефалоспорин. Порошок для приготовления раствора для внутривенного внутримышечного введения.
Ампициллин + [Сульбактам]: антибиотик – пенициллин полусинтетический + бета-лактамаз ингибитор. Порошок для приготовления раствора для внутривенного и внутримышечного введения.
Имипенем+[Циластатин]: антибиотик-карбапенем + дегидропептидазы ингибитор. Порошок для приготовления раствора для инфузий.
Зинацеф (оригинальный цефуроксим, для в/в и в/м введения). Цефалоспориновый антибиотикам, активный в отношении широкого спектра возбудителей, включая штаммы, продуцирующие бета-лактамазы. Производитель: ГлаксоСмитКляйн (Великобритания).
Медоцеф (цефоперазон, для в/м и в/м введения). Цефалоспориновый антибиотик III поколения с широким спектром действия только для парентерального введения. Устойчив к действию многих бета-лактамаз. Производитель: «Медокеми» (Кипр).
Пилактам – п/с пенициллин пиперациллин широкого спектра и тазобактам с активностью против м/о, устойчивых к пенициллинам. Порошок для приготовления раствора для инфузий от ФК Фармасинтез (РФ).
Протозидим (цефтазидим, для в/м и в/в введения) – цефалоспорин III поколения широкого спектра действия. Производитель: “Фармасинтез” (Россия).
Цефотаксим: антибиотик-цефалоспорин. Порошок для приготовления раствора для инъекций.
Ампициллин + [Сульбактам]: антибиотик-пенициллин полусинтетический + бета-лактамаз ингибитор. Порошок для приготовления раствора для внутривенного и внутримышечного введения.
Антибиотик – пенициллин полусинтетический + бета-лактамаз ингибитор. Лиофилизат для приготовления раствора для внутривенного введения.
Фосфомицин: антибиотик. Порошок для приготовления раствора для внутривенного введения.
Цефоперазон+[Сульбактам]: антибиотик-цефалоспорин + бета-лактамаз ингибитор. Порошок для приготовления раствора для внутривенного и внутримышечного введения.
Церафазон (цефоперазон, для в/м и в/м введения). Цефалоспориновый антибиотик III поколения с широким спектром действия только для парентерального введения. Устойчив к действию многих бета-лактамаз. Производитель: «Фармасинтез» (Россия).
Регистрационный номер:ЛП-005082Торговое наименование: Цефокситин Международное непатентованное наименование: цефокситин Лекарственная форма. Порошок для приготовления раствора для внутривенного и…
Цефоперабол (цефоперазон, для в/м и в/м введения). Цефалоспориновый антибиотик III поколения с широким спектром действия только для парентерального введения. Устойчив к действию многих бета-лактамаз. Производитель: «АБОЛмед» (Россия).
Цефтриаксон + [сульбактам]: антибиотик-цефалоспорин + бета-лактамаз ингибитор. Порошок для приготовления раствора для внутривенного и внутримышечного введения.

Источник
Возбудители
- S.aureus
- Коагулазо-негативные стафилококки
- Streptococci
- Entorococcus
- Pseudomonas aeruginosa
- E. coli
- Salmonella spp.
- Serratia spp.
- Другие грамм-отрицательные энтеробактерии
- Гораздо реже: анаэробы, грибы, микобактерия, бруцелла
- Различие между острым и хроническим остеомиелитом нечеткое: «острый» включает 1 ст манифестации остеомиелита, острую симптоматику (
- Острые симптомы и признаки:
§ лихорадка/озноб/ночной пот,
§ локализованная боль/болезненность, или припухлость/покраснение (больше общего с гематогенной инфекцией)
- Лабораторная диагностика:
§ подъем СОЭ, СРБ;
§ подъем уровня лейкоцитов и тромбоцитов
- Rg:
§ переостальная элевация, фокальная остеопения, истончение коркового или гребешкового слоя на обзорной рентгенограмме или КТ;
§ отек костного мозга на МРТ;
§ трассирующие поглощения на радионуклидном сканировании
- Микробиологическое исследование: изоляция патогенна из костного поражения (аспирация или биопсия) или посев крови при наличии костных изменений.
- Острый гематогенный остеомиелит: наиболее распространен у детей (обычно S.aureus) или у взрослых в возрасте >50 лет, на гемодиализе, с сахарным диабетом, других факторов риска бактериемии
- Типичные локализации:
§ позвоночник (взрослые > дети),
§ длинные кости (дети > взрослые),
§ аксиальные суставы (грудинно-ключичный, крестцово-подвздошный особенно у в/в наркоманов)
- Острый гематогенный остеомиелит обычно мономикробный; в то время как прилегающий фокус воспаления полимикробный
- Сообщество связанных VRSA штаммов может привести к гематогенному остеомиелиту и патологическим переломам после инфекции мягких тканей
Диагностика
- Подозрение основывается на анамнезе, физикальном исследовании и вспомогательными лабораторными данными
- Визуализация имеет важное значение для диагностики, постановке стадии и заключительного диагноза
- Обзорной Rg достаточно, если имеются типичные показатели, но она не очень чувствительна при раннем остеомиелите.
- МРТ и радионуклидное сканирование более чувствительно в раннем или сомнительном случае.
- МРТ предпочтительно при подозрении на вертебральный остеомиелит за исключением паравертебрального абсцесса.
- В эру MRSA особенно важно установить микробиологическую этиологию (в идеале перед антибиотикотерапией)
- Показания для оперативного лечения:
§ отсутствие эффекта на антибиотикотерапию,
§ абсцесс мягких тканей,
§ инфекция суставов;
§ нестабильность позвоночника.
Лечение
Нематогенный остеомиелит (патогенетическое)
- Общая рекомендация – 2 – 6 недель парентеральной терапии +/- для завершения последующей пероральной терапией в течение 4 – 8 недель
- Используйте информацию по чувствительности, которая послужит руководством к выбору препарата и способа его введения (парентеральная или пероральная)
- Стафилококк (MSSA): нафциллин или оксациллин 2 г в/в каждые 4 часа или цефазолин 2 г в/в каждые 6 – 8 часов
- Стафилококк (MSSA): цефтриаксон 2,0 в/в каждые 24 часа (амбулаторный вариант)
- Стафилококк (MSSA или MRSA): клиндамицин 600 мг в/в каждые 6 часов или 900 мг в/в каждые 8 часов
- MRSA: ванкомицин 15 мг/кг в/в каждые 12 часов (+/- рифампицин 600 мг РО ежедневно).
- MRSA: линезолид 600 мг в/в или РО каждые 12 ч или даптомицин 6 – 8 мг/кг/день в/в (меньше опыта)
- Стрептококк: пенициллин G 2 – 4 млн ЕД в/в через 4 – 6 часов или ампициллин 2 г в/в каждые 6 часов (+/- гентамицин 1,0 мг/кг в/в каждые 8 часов для Streptococcus agalactiae, другие стрептококки с высокой МПК для пенициллина или Enterococcus spp)
- Грам-отрицательные бактерии: ампициллин/сульбактам 3 г (2 г/1 г соответственно) в/в каждые 6 часов или тикарциллин/клавуланат 3,1 г в/в каждые 4 – 6 часов или пиперациллин/тазобактам 3,375 г в/в каждые 4 – 6 часов
- Грам-отрицательные бактерии: ципрофлоксацин 400 мг в/в каждые 12 часов (можно сделать ранний перевод на пероральную терапию: 750 мг РО каждые 12 часов) или левофлоксацин 750 мг в/в или РО 1 р/д. Другие фторхинолоны возможно также адекватны.
- Грам-отрицательные бактерии: цефтриаксон 2 г в/в каждые 24 часа или цефотаксим 2 г в/в каждые 6 – 8 часов или цефтазидим 2 г в/в каждые 8 часов или цефепим 2 г в/в каждые 8 часов.
Контактирующий фокус или поствакцинальный остеомиелит
- Язва стопы/ноги: консультация ортопеда, учитывать сосудистую оценку если имеется недостаточность.
- Пролежень: консультация пластического хирурга
- Остеомиелит под хронической язвой чаще всего имеет полимиккробную этиологию. Если имеется сосудистая недостаточность, возможна анаэробная флора
- Общие рекомендации – 6 – 8 недель антибактериальной терапии (по крайней мере 2 недели первоначальной в/в терапии или до клинического улучшения/стабилизации) после хирургической обработки раны.
- Использовать режимы для гематогенного остеомиелита, если возбудитель известен. Эмпирические режимы расписаны ниже. Добавлять ванкомицин, если имеются факторы риска MRSA
- Клиндамицин 600 мг в/в каждые 6 часов или 900 мг в/в каждые 8 часов + ципрофлоксацин 400 мг в/в или 750 мг РО каждые 12 часов или левофлоксацин 750 мг в/в или РО 1 р/д
- Ампициллин/сульбактам 3 г в/в каждые 6 часов или тикарциллин/клавуланат 3.1 г в/в каждые 4 – 6 часов или пиперациллин/тазобактам 3,375 г в/в каждые 4 – 6 часов
- Эртапенем 1 г в/в каждые 24 часа или имипенем 500 мг в/в каждые 6 часов или меропенем 1 г в/в каждые 8 часов
- Цефтриаксон 2 г в/в каждые 24 часа или цефотаксим 2 ш в/в каждые 6 – 8 часов или цефтазидим 2 г в/в каждые 8 часов или цефепим 2 г в/в каждые 8 часов + метронидазол 500 мг в/в каждые 6 часов
- Человеческие укусы или укусы животных: ампициллин/сульбактам 3 г в/в каждые 6 часов
Пероральные режимы (следующие за парентеральной терапией)
- Неустойчивая биодоступность пероральных форм пенициллинов и цефалоспоринов, плюс низкая сосудистая пенетрация в кости, делает эти препараты менее желательными в применении. Однако стрептококки часто высоко чувствительны именно к ним. Необходимо использовать патогенетическую терапию
- Стафилококк (MSSA, MRSA) или анаэробы: клиндамицин 300 – 450 мг РО каждые 6 часов
- Стафилококк (MSSA, MRSA): миноциклин 100 мг РО дважды в день (+/- рифампин 600 мг РО 1 р/д)
- Стафилококк (MSSA)фторхинолоны (если есть чувствительность) + рифампин 600 мг РО 1 р/д
- Стафилококк (MSSA, MRSA) или грамотрицательные бактерии: триметоприм/сульфаметоксазол DS (бактрим форте) 2 таб РО каждые 8 – 12 часов(+/- рифампин 600 мг РО 1 р/д для стафилококка)
- Грамотрицательные бактерии: ципрофлоксацин 750 мг РО каждые 12 часов или левофлоксацин 750 мг РО дважды в день
- Анаэробы: метронидазол 500 мг РО каждые 6 – 8 часов
- Смешанная инфекция: клиндамицин + фторхинолоны
- MRSA или VRE: линезолид 600 мг РО каждые 12 часов
- Укусы человека или животных: амоксициллин/клавуланат 875 – 1000 мг Ро дважды в день
Заключение
- Некоторых пациентов можно переводить на пероральную терапию через 2 недели от начала внутривенной, если имеются хорошие варианты переоральных препаратов с хорошей биодоступностью и антимикробной чувствительностью
- СРБ возвращается к норме до прекращения терапии
- Заключительную визуализацию нужно интерпретировать с осторожностью так как костные изменения происходят медленно (особенно МРТ) и может произойти первоначальное ухудшение, несмотря на проводимое лечение.
От себя отмечу, что терапия ванкомицином, имеющимся на российском рынке, должно проводиться строго под контролем клиренса креатинина, так как у нас преобладают плохо очищенные формы, использование которых приводит к высокой нефротоксичности. Кроме того, введение данного препарата должно быть максимально медленным из-за угрозы побочных реакций.
Также хотелось бы отметить, что амбулаторный режим лечения цефтриаксоном не очень желателен, так как у препарата очень низкая активность в отношении стафилококков.
Используемые сокращения:
РО – per os
MSSA – мицитиллин-чувствительный S.aureus
MRSA – мицитиллин резистентный S.aureus
Источник
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Волошин В.П. 1 Еремин А.В. 1 Ошкуков С.А. 1 Литвинов В.В. 1 Дементьев И.М. 1
1 ГБУЗ МО МОНИКИ им. М.Ф. Владимирского
Инфекция костей и суставов с наличием имплантатов – грозное осложнение. При неадекватном лечении, воспалительный процесс может привести к нарушению функции суставов, снижению качества жизни пациента, деструкции костей и даже летальному исходу. С целью воздействия на микрофлору в очаге инфекции применяется хирургическая санация воспаления, удаление имплантов, тщательный дебриджемент и замещение костных полостей, дренирование раны. В последующем проводится длительная антибиотикосупрессия. Несмотря на проводимое лечение, рецидив инфекции остается высоким. Для купирования воспаления применяются местные способы доставки антибиотика. При лечении перипротезной инфекции крупных суставов применяется двухэтапный метод с установкой временного цементного спейсера с антибиотиком для замещения остаточной полости после удаления компонентов эндопротеза для последующего ревизионного эндопротезирования.
методы хирургического лечения
инфекция костей и суставов
профилактика воспаления
1. Волошин В.П., Еремин А.В., Зубиков В.С., Шатохина С.Н., Мартыненко Д.В., Захарова Н.М., Ошкуков С.А. Место цитологического исследования в диагностике и мониторинге периимплантного воспаления крупных суставов // Вестник травматологии и ортопедии им. Н.Н. Приорова. – 2013. – №1.- 58-62.
2. Волошин В.П., Еремин А.В., Оноприенко Г.А., Савицкая К.И., Зубиков В.С., Нестерова М.В., Русанова Е.В. Хирургическое лечение перипротезной инфекции после тотальной замены тазобедренного сустава // Альманах клинической медицины. – 2005. – №8-5. – С.5-12.
3. Захарова Н.М., Шатохина И.С., Волошин В.П., Еремин А.В., Зубиков В.С. Ошкуков С.А., Цыбин А.А. Особенности местной воспалительной реакции в области хирургического вмешательства при эндопротезировании крупных суставов // Альманах клинической медицины. – 2012. – №27. – С. 14-18.
4. Кривихин В.Т., Кривихин Д.В., Чернобай А.В., Лобаков А.И., Бакунов М.Ю. Лечение обширных гнойно-некротических процессов на голени у больных с нейропатической формой синдрома диабетической стопы // Альманах клинической медицины. – 2014. – №32. – С.8-11.
5. Привольнев В.В., Родин А.В., Каракулина Е.В. Местное применение антибиотиков в лечении инфекций костной ткани // Клиническая Микробиология и Антимикробная Химиотерапия. – 2012. – Том 14 (№2). – С. 118-131.
6. Чеканов А.С., Волошин В.П., Лекишвили М.В., Очкуренко А.А., Мартыненко Д.В. Реконструкция тазобедренного сустава деминерализованными аллоимплантатами при ревизионном эндопротезировании // Вестник травматологии и ортопедии им. Н.Н. Приорова. – 2015. – №1. – С.43-46.
7. Шехтер А.Б., Зар В.В., Волошин В.П., Лопатин В.В. Тканевая и клеточная реакция синовиальной среды на внутрисуставное введение полимерного вископротеза «Нолтрекс» в условиях эксперимента // Альманах клинической медицины. – 2013. – №28. – С.20-24
8. El-Husseini, M., Patel, S., MacFarlane, R.J., Haddad, F.S. / Biodegradable antibiotic delivery systems // J Bone Joint Surgery. – 2011. 93 (Part 2). – Р.151-7.
9. Gitelis S., Brebach G.T. / The treatment of chronic osteomyelitis with a biodegradable antibiotic-impregnated implant. // J OrthopaedSurg (Hong-Kong). – 2002. 10 – Р. 53-60.
10. Hou, T., Xu, J., Li, Q., Feng, J., Zen, L. / In vitro evaluation of a fibrin gel antibiotic delivery system containing mesenchymal stem cells and vancomycin alginate beads for treating bone infections and facilitating bone formation. // Tissue Engineer. – 2008. 14 (Part 1). – Р.1173-1182.
Лечение инфекции костей и суставов является одной из сложных проблем в травматологии и ортопедии. Имплант-ассоциированная инфекция костей и суставов приводит к неэффективности антибактериальной терапии в связи с наличием биопленок [8]. С целью купирования воспаления проводятся неоднократные хирургические вмешательства с использованием материалов, способных доставлять и создавать локальную концентрацию антибиотика непосредственно в очаге инфекции [9].
В современной клинической медицине достигнуты значительные успехи в лечении периимплантной костной и суставной инфекции с применением различных материалов [4,6,7].
Остается много вопросов, которые необходимо решить при лечении данной патологии: как доставить антибиотик к месту назначения в необходимой концентрации для купирования воспаления; какой группы антибиотик использовать; какова его фармакокинетика; есть ли возможность использовать антибиотик совместно со средствами, усиливающими остеообразование и/или ослабляющими остеолиз; как удалить местную форму препарата из тканей, если это будет необходимо [5].
Все системы транспорта антибиотика к очагу инфекции можно разделить на нерассасывающиеся и рассасывающиеся (биодеградируемые)[10].
Цель исследования: улучшение результатов хирургического лечения периимплантной инфекции костей и суставов.
Материалы и методы исследования: в ОТО МОНИКИ с 2004 г. – по сентябрь 2015 г., при сочетании инфицирования с дестабилизацией компонентов эндопротеза у пациентов с перипротезным воспалением тазобедренного сустава в 34 случаях и с глубоким перипротезным нагноением коленного сустава в 8 случаях использован нерассасывающийся метод. Применяются временные спейсеры, импрегнированные антибиотиками с целью заполнения остаточной полости, воздействия на микрофлору очага воспаления и создание благоприятных условий для выполнения повторного тотального эндопротезирования на фоне стойкого купирования воспалительного процесса. Мужчин среди них – 24, женщин – 18, в возрасте от 31 до 75 лет.
При лечении имплант-ассоциированной костной инфекции с наличием костной деструкции в ОТО МОНИКИ с января 2015 г. – по сентябрь 2015 г. применен рассасывающий метод с использованием аутотрансплантата без фиксации и с фиксацией его биодеградируемым винтом с антибиотиком у 7-и пациентов, в возрасте от 36 до 60 лет. Мужчин – 6, женщин – 1.
Результаты и обсуждение:
Критерии для проведения двухэтапного эндопротезирования:
- Наличие местных проявлений перипротезного инфицирования;
- Стабильные компоненты эндопротеза при наличии положительной полирезистентной микрофлоры;
- Хроническое продуктивное воспаление с преобладанием сегментоядерных нейтрофилов [3].
- Гистопатологическое исследование: отсутствие при цитологическом исследовании остеокластов, наличие более 5 нейтрофилов в поле зрения при гистологическом исследовании свежезамороженных параартикулярных тканях;
- Неэффективность проведенных ранее хирургических санаций;
- Возможность проведения супрессивной антибиотикотерапии;
- Согласие больного на проведение двухэтапного метода лечения;
- Отсутствие тяжелых соматических заболеваний;
- Отсутствие критической потери костной ткани;
Первым этапом осуществляется хирургическая санация с широкой ревизией возможных путей распространения инфекции и удалением вертлужного, бедренного компонентов эндопротеза и фиксирующих материалов.
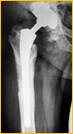
После завершения санации проводится интраоперационное формирование цементного спейсера в соответствии с формой и размерами вертлужной впадины с последующим укреплением его к проксимальному отделу бедренной кости (рис. 1)
а)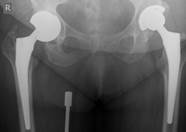 б)в)
б)в)
Рис. 1. Рентгенограмма таза больной К-ой, 1951 г.р., и/б 21813/18278
Нестабильность вертлужного компонента эндопротеза справа с комбинированным дефектом тазовой кости и повреждением бедренного компонента. а) – при поступлении в клинику; б) – удаленные компоненты эндопротеза с повреждением бедренного компонента; в) – рентгенограмма после первого этапа хирургического лечения – удаление компонентов эндопротеза справа, установка цементного спейсера, остеосинтез бедренной кости.
Фиксированный к бедренной кости цементный спейсер погружается в вертлужную впадину, заполняя пространство для последующего установления вертлужного компонента ревизионного эндопротеза (2-й этап).
Для изготовления цементного спейсера используется рентгеноконтрастный цементоподобный материал, обеспечивающий установку и крепление протезов к костям. Варианты антибиотиков, которые добавляют в спейсер: аминогликозиды (тобрамицин, гентамицин); Цефалоспорины 1-ого поколения (цефазолин), 2-ого поколения (цефуроксим), 3-его поколения (цефтазидим), 4-ого поколения (цефотаксим), 5-ого поколения (цефтаролин); фторхинолоны (ципрофлоксацин); гликопептиды (ванкомицин); оксазолидиноны (линезолид); противогрипковые (вориконазол).
Для формирования цементного спейсера достаточно полутора – двух доз, хотя требуемое количество зависит от характера хирургического вмешательства и применяемого метода. После окончания полимеризации приготовленный спейсер фиксируется к проксимальному отделу бедренной кости с помощью дополнительной дозы цемента. Перед установкой спейсера следует обеспечить тщательную санацию и высушивание проксимальной части костномозгового канала бедренной кости непосредственно перед погружением временного имплантата.
В случаях, когда нестабильность обоих компонентов эндопротеза сочетается с глубокой перипротезной инфекцией возможно применение преформированных (фабричных) спейсеров.
После тщательной хирургической санации очага воспаления выполняется удаление обоих компонентов эндопротеза тазобедренного сустава и фиксирующего материала. В канал бедренной кости устанавливается артикулирующий преформированный спейсер, импрегнированный антибиотиками (гентамицин, ванкомицин), а затем вправляются в вертлужную впадину, рана дренируется в течение двух дней (рис. 2).
а)б)в)
г)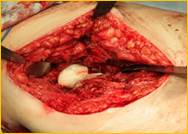 д) е)
д) е)
Рис. 2. Рентгенограмма правого тазобедренного сустава больного Г-на, 1963 г.р., и/б 16697/8454
Глубокое перипротезное инфицирование правого тазобедренного сустава. Комбинированный дефект правой вертлужной впадины и проксимального отдела бедренной кости. а) – при поступлении в клинику фистулограмма правого тазобедренного сустава; б) – внешний вид мягких тканей после удаления компонентов эндопротеза; в) – первый этап – санирующая операция на правом тазобедренном суставе с установкой спейсера в канал бедренной кости; г) – вправление спейсера; д) – рентгенограмма правого тазобедренного сустава после установки спейсера; е) – рентгенограмма правого тазобедренного сустава после второго этапа – удаление спейсера, повторное тотальное эндопротезирование правого тазобедренного сустава с установкой ревизионной конструкции и костной аутопластикой дефекта бедренной кости.
Среди 34 пациентов с перипротезным инфицированием тазобедренного сустава рецидив воспаления отмечен у 2 пациентов, что составило – 5,8%, которым выполнено удаление спейсера, формированием опорного неоартроза тазобедренного сустава. Три пациента отказываются от реэндопротезирования, что составляет – 8,8%. Купирование воспаления достигнуто в 94,2% случаев.
Среди 8 пациентов с глубоким нагноением эндопротеза коленного сустава рецидивов воспаления не отмечено. Двум пациентам планируется выполнить повторное эндопротезирование коленного сустава.
Необходимость проводить повторную операцию по замене спейсера на ревизионный эндопротез остается главным недостатком нерассасывающихся материалов [1].
С целью профилактики рецидивов перипротезного инфицирования суставов применен рассасывающийся биополимерный биодеградируемый материал на основе коллагеновой губки, содержащий антибиотик гентамицин. При имплантации 1 губки в полостях и тканях создается высокая локальная концентрация (666,66 мг/мл) гентамицина. Перед применением коллагеновой губки с гентамицином необходимо максимально просушить область аппликации.
Для обеспечения прочной фиксации пластину «Коллатамп ИГ» следует в течение 3-х минут плотно прижимать к раневой поверхности. Интраоперационно при первичном или ревизионном эндопротезировании коленного и тазобедренного суставов укладывают биополимерный биодеградируемый материал на основе коллагеновой губки с гентамицином на поверхность эндопротеза для профилактики ранних и поздних инфекционных осложнений у пациентов из группы риска. Быстрая и полная рассасываемость коллагеновой губки с гентамицином устраняет необходимость его удаления в ходе операции после достижения устойчивого гемостаза (рис. 3).
а)  б)
б) 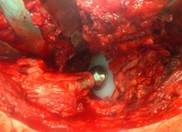
Рис. 3. а) – биополимерный биодеградируемый материал на основе коллагеной губки с гентамицином (collatampEG); б) – коллагеновая губка с гентамицином покрывает металлические участки эндопротеза тазобедренного сустава
Преимущества биополимерного биодеградируемого материала на основе коллагеновой губки с антибиотиком: создает высокую концентрацию антибиотика в областях с низкой перфузией крови в тканях; профилактики ранних и поздних инфекционных осложнений у пациентов из группы риска благодаря высокой концентрации антибиотика; обладает местным гемостатическим действием; является биодеградируемым материалом (не требует дальнейших манипуляций по удалению).
Критерии для лечения имплант-ассоциированной инфекции рассасывающимся методом с использованием аутотрансплантата без фиксации и с фиксацией его биодеградируемым винтом с антибиотиком.
- Наличие местных проявлений перииплантной костной и суставной инфекции;
- Возможность использовать аутотрансплантат для замещения костных дефектов;
- Отсутствие аллергической реакции на компоненты биодеградируемого винта;
- Чувствительность микрофлоры к антибиотику[2].
У 4-х пациентов с наличием дестрекции костей и суставов проводилась тщательная хирургическая санация очага воспаления, секвестрэктомия, замещение костного дефекта аутотрансплантатом из гребня подвздошной кости, дренирование послеоперационной раны (рис.4)
а) б)в)
г)
Рис. 4. Пациент К-н, 1957 г.р., и/б 14426
Глубокое перипротезное инфицирование левого тазобедренного сустава с наличием дефекта большого вертела, без дестабилизации комопнентовэндопротеза. а) – рентгенограмма левого тазобедренного сустава при поступлении в клинику; б) – внешний вид костного дефекта большого вертела после хирургической санации; в) – замещение костного дефекта трансплантатом из гребня подвздошной кости; г) – рентгенограмма левого тазобедренного сустава после оперативного лечения.
У одного пациента через четыре месяца после операции замещения костного дефекта большеберцовой кости по данным рентгенограмм отмечено рассасывания аутотрансплантата. У одного пациента после костной пластики костей стопы рецидив воспаления с формированием свищевого хода.
Трем пациентам с длительным вялотекущим процессом с наличием костной деструкции костей и суставов проведена хирургическая санация с замещением костного дефекта аутотрансплантатом и фиксация его биодеградируемым винтом с антибиотиком.
Всем пациентам проведена хирургическая санация очага воспаления, секвестрэктомия. С помощью насадки «бур» выполнено удаление грануляций, склерозированной кости до появления «кровавой росы». Полость дефекта промывалась ультразвуковой кавитацией с использованием антисептиков. В очищенный дефект укладывался костный трансплантат. Для заполнения небольшого костного дефекта в 1-ом случае использован местный кортикальный слой. В 2-х случаях, для замещения полостей, размером 9х2 см и 3,5х4 см использован трансплантат из гребня подвздошной кости. Затем проводилась фиксация трансплантата биодеградируемыми винтами с антибиотиком (ципрофлоксацин) (рис. 5).
а)б)в) г)
Рис. 5. Пациент Г., и/б 2485. Хронический остеомиелит большеберцовой кости справа с наличием секвестра, состояние после удаления погружного металлофиксатора большеберцовой кости, свищевая форма. а) – рентгенограмма правой голени с наличием очага деструкции большеберцовой кости, размером 9х2 см, б) – аутотрансплантат из гребня подвздошной кости, в) – фиксация аутотрансплантата винтами с антибиотиком,
г) – рентгенограмма правой голени после оперативного лечения
Послеоперационное ведение проводилось в соответствии со стандартным ведением пациентов с высоким риском инфекции.
У одного пациента в послеоперационном периоде отмечено длительное заживление послеоперационной раны. На контрольных рентгенограммах – рассасывания трансплантата ни в одном случае не произошло. Рецидива воспаления не отмечено ни в одном случае.
Заключение: использование спейсера с антибиотиком является золотым стандартом при лечении перипротезной инфекции крупных суставов и позволяет добиться стойкого купирования воспалительного процесса в 95,3% случаях. С целью профилактики перипротезного инфицирования у пациентов с высоким риском послеоперационного нагноения рекомендовано использовать биополимерный биодеградируемый материал на основе коллагеновой губки, содержащий антибиотик гентамицин.
При лечении имплант-ассоциированной костной инфекции с наличием костной деструкции использование биодеградируемого винта с антибиотиком позволяет воздействовать на микрофлору непосредственной в очаге инфекции, фиксация аутотрансплантата способствует его остеоинтеграции, повторной операции для удаления винта не требуется.
Рецензенты:
Оноприенко Г.А., д.м.н., профессор, ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, г. Москва;
Дорожко И.Г., д.м.н., профессор, ГБУЗ МО МОНИКИ им. М.Ф. Владимирского, г. Москва.
Библиографическая ссылка
Волошин В.П., Еремин А.В., Ошкуков С.А., Литвинов В.В., Дементьев И.М. МЕСТНОЕ ДЕЙСТВИЕ АНТИБИОТИКА ПРИ ЛЕЧЕНИИ ИНФЕКЦИИ КОСТЕЙ И СУСТАВОВ // Современные проблемы науки и образования. – 2015. – № 5.;
URL: https://science-education.ru/ru/article/view?id=22405 (дата обращения: 11.05.2021).

Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
