Маркеры воспаления и сахарный диабет 2 типа
- Авторы
- Резюме
- Файлы
- Ключевые слова
- Литература
Князева Л.И. 1 Окрачкова И.В. 1 Бондырева А.В. 1 Маслова Т.А. 1
1 ГБОУ ВПО «КГМУ» Минздравсоцразвития России
В данной статье представлены результаты исследования сывороточного содержания провоспалительных цитокинов (ИЛ-1b, ИЛ-6, ФНО-α, р ФНО-α р1), лептина, растворимой изоформы лиганда 40 (р CD40L), моноцитарного хемоаттрактантного протеина (МСР-1) у 60 больных сахарным диабетом (СД) 2 типа. Установлены более выраженные изменения изучаемых показателей иммунного статуса у больных СД 2 типа с ожирением в сравнении с показателями у больных СД 2 типа и ИМТ
провоспалительные цитокины
лептин
растворимая изоформа лиганда 40L
моноцитарный хемоаттрактантный протеин
сахарный диабет
ожирение
1. Алгоритмы специализированной медицинской помощи больным сахарным диабетом / под. ред. И.И. Дедова, М.В. Шестаковой. – М., 2009. – Вып. 4. – 103 с.
2. Бондарь И.А. Роль мозгового натрий-уремического пептида и его N-концевого предшественника в диагностике хронической сердечной недостаточности и бессимптомной дисфункции левого желудочка при сахарном диабете 2 типа / И.А. Бондарь, Д.В. Гражданкина // Сах. диабет. – 2011. – № 3. – С. 31-35.
3. Дедов И.И. Сахарный диабет в России: проблемы и решения / И.И. Дедов, М.В. Шестакова, Ю.И. Сунцов. – М., 2008. – С. 3-6.
4. Кетлинский С.А., Симбирцев А.С. Цитокины. – СПб., 2008. – 552 с.
5. Клебанова Е.М. Гормоны жировой ткани и их роль в патогенезе сахарного диабета 2 типа / Е.М. Клебанова, М.И. Балаболкина // Леч. врач. – 2010. – № 11. – С. 12-16.
6. Маслова О.В. Эпидемиология сахарного диабета и микрососудистых осложнений / О.В. Маслова, Ю.И. Суянцов // Сах. диабет. – 2011. – № 3. – С. 6-11.
7. Прасолов А.В. Влияние бисопролола на иммунные маркеры кардиоваскулярного риска, эластические свойства сосудистой стенки и вариабельности ритма сердца у больных стабильной стенокардией напряжения // Курский научно-практический вестник «Человек и его здоровье». – 2010. – № 1. – С. 53-59.
8. Association of soluble CD40 ligand with carotid atherosclerosis in Japanese type with diabetic patients / N. Katakami, H. Kaneto, M. Matsuhisa et al. // Diabetologia. – 2006. – № 49 (7). – Р. 1670-1676.
9. Beitowski J. Leptin and atherosclerosis // Atherosclerosis. – 2006. – № 189. – P. 47-60.
10. Wilkinson I.B. Nitric oxide regulates local arterial destensibility in vivo / I.B. Wilkinson, A. Quasem // Circulation. – 2009. – Vol. 105 (2). – P. 213-217.
Сахарный диабет (СД) 2 типа – одно из наиболее распространенных заболеваний в мире, поражающее население как экономически развитых, так и развивающихся стран. В настоящее время около 285 млн человек в мире страдает СД [6]. Следует отметить, что у больных СД 2 типа частота артериальной гипертензии и ИБС значительно выше, чем у людей без диабета, что позволяет объяснить раннее развитие ХСН [2]. При этом к числу независимых факторов сердечно-сосудистого риска при СД 2 типа относятся увеличение индекса массы тела (ИМТ), гипергликемия, дислипидемия и др. [2; 3]. Получены убедительные данные о том, что провоспалительные цитокины рассматриваются в качестве маркеров атеросклеротического риска [4; 5; 7]. Повышение уровня р CD40L дискутируется в качестве фактора риска сердечно-сосудистых заболеваний и связано с неблагоприятным прогнозом у больных ИБС.
Исследованиями последних лет установлено, что независимым предиктором инфаркта миокарда у мужчин и женщин с артериальной гипертензией является лептин. Наряду с влиянием на метаболизм липидов в сосудистой стенке, окислительной модификацией липопротеинов плазмы крови, снижением параоксаназной активности и холестерина ЛПВП, лептин оказывает и другие проатерогенные эффекты, участвуя в процессах гемостаза, воспалении, эндотелиальной дисфункции [9]. Надо отметить, что прогностическая функция лептина и р CD40L при сердечно-сосудистых заболеваниях, в том числе при СД 2 типа, окончательно не определена.
Известно, что большое значение в инициации воспаления в эндотелии сосудистой стенки играют моноциты, макрофаги, адгезия и миграция моноцитов в сосудистую стенку, превращение их в макрофаги с последующей активацией липидов. МСР-1 является одним из цитокинов, ответственных за миграцию моноцитов в интиму в местах формирования атеросклеротических бляшек. Уровень МСР-1 в сыворотке крови рассматривается в качестве маркера субишемического атеросклероза [10]. Изучение связи между показателями цитокинового статуса и липидного спектра крови представляет интерес с позиции их вклада в прогрессирование жесткости артериального русла.
Прогностическая ценность этих исследований заключается не только в определении механизмов прогрессирования структурно-функциональных нарушений сосудистого русла у больных СД 2 типа с ожирением, но и дает новые направления для терапевтического вмешательства.
Поэтому целью настоящего исследования явилось изучение динамики показателей иммунного статуса, липидного профиля у больных СД 2 типа с ожирением на фоне терапии фенофибратом.
Материалы и методы
Под наблюдением находилось 60 больных СД 2 типа, среди них 25 мужчин (58%) и 35 женщин (42%). Средний возраст составил 41±6,5 лет. Длительность СД 2 типа у обследованного контингента колебалась от 1 года до 5 лет. Степень тяжести течения и фазы компенсации сахарного диабета определялись согласно алгоритмам специализированной медицинской помощи больным сахарным диабетом [1] с учетом клинико-лабораторных признаков (контроль базальной и суточной гликемии и глюкозурии, уровня гликозилированного гемоглобина), данных осмотров окулиста и невролога.
Критериями включения в исследование являлись следующие: СД 2 типа средней тяжести, удовлетворительный контроль СД (гликемия натощак<7,0 ммоль/л; гликемия постпрандиальная<19,0 ммоль/л; HbA1<7%); АГ не выше 1 степени; индекс массы тела свыше 30 кг/м2, соотношение окружности талии к окружности бедер (ОТ/ОБ) более 0,85 у женщин и более 0,9 у мужчин; информированное согласие пациента о включении в исследование.
Критериями исключения являлись: АГ выше 1 степени, тяжелое течение СД 2 типа; нестабильная компенсация СД (HbA1>10%); хроническая сердечная недостаточность более II ФК по NYHA; диабетическая нефропатия; хроническая почечная недостаточность.
Группу сравнения составили 32 больных СД 2 типа с ИМТ менее 25 кг/м2 в возрасте 36-49 лет, 18 мужчин и 12 женщин.
Группу контроля составили 24 лица без нарушений углеводного обмена и сердечно-сосудистых заболеваний: 10 мужчин и 14 женщин в возрасте от 35 до 50 лет, средний возраст составил 40,2±6,3 лет.
Исследования показателей иммунного статуса проводились дважды: до начала лечения и после 6 месяцев терапии.
Оценка липидного спектра крови проводилась с помощью реактивов Ольвекс Диагностикум, Россия.
Содержание в сыворотке крови ФНО-a, ИЛ-1b, ИЛ-6 исследовали иммуноферментным методом согласно инструкциям к тест-системам («Протеиновый контур», г. Санкт-Петербург). Уровень р ФНО-a р1 в сыворотке крови исследовали иммуноферментным методом (Biosource, Бельгия). Количественное содержание МСР-1 изучали иммуноферментным методом с использованием тест-систем (ОМБ, г. Москва). Содержание лептина оценивали иммуноферментным методом – DRV (Германия), р CD40L – BenderMedSystems (Австрия).
Лечение больных включало: диету – диетотерапию; пероральные сахароснижающие препараты, производные сульфанилмочевины второй генерации глибенкламид (манинил – 5,0) – 32 пациента, гликлазид (диабетон) – 28 человек, комбинированную терапию (манинил 5,0 + сиофор 850) – 30 больных. После определения исходных параметров терапия больных СД 2 типа была дополнена производным фиброевой кислоты – фенофибратом в дозе 145 мг 1 раз в сутки.
Статистический анализ полученных данных проводился с использованием парного и непарного критерия Стьюдента, коэффициента корреляции Спирмена с применением программного комплекса istica 6,0 for Windows.
Результаты и их обсуждение
С учетом роли дислипидемии в качестве ведущего фактора сердечно-сосудистого риска проведено исследование липидного спектра у больных СД 2 типа, установившее, что у больных с СД 2 типа с ИМТ < 25 кг/м2 уровень холестерина составил 4,7±0,2 ммоль/л, триглицеридов (ТГ) – 3,7±0,12 ммоль/л, коэффициент атерогенности (КА) был равен 3,9±0,5. Содержание холестерина и ТГ у больных с ИМТ>35 кг/м2 превосходило аналогичные показатели у больных СД 2 типа без ожирения соответственно на 18,3±1,1% и 26,0±2,1%. Уровень холестерина липопротеидов высокой плотности был на 9,1±0,9% (р<0,05) выше, чем у больных СД с ИМТ>35 кг/м2. Коэффициент атерогенности у больных СД 2 типа с ожирением был достоверно выше показателя в группе сравнения и составлял 5,4±0,6.
Определение исходного уровня провоспалительных цитокинов показало достоверно более высокий их уровень у больных СД 2 типа с ожирением (табл. 1). У больных этой группы содержание ФНО-α – в 2,5±1,1 раза, ИЛ-1β – в 2,4±0,2 раза, ИЛ-6 -в 4,1±1,2 раза превосходило значения контроля и соответственно в 1,2±0,4 (р<0,05), 1,3±0,1 (р<0,05) и 1,3±0,2 (р<0,05) раза содержание исследуемых цитокинов у больных СД 2 типа без ожирения.
Следует отметить, что в проведенных к настоящему времени клинических исследованиях показано, что увеличение концентрации р ФНО-α р1 коррелирует с развитием атеросклероза и его осложнений в основной популяции. Считают, что р ФНО-α р1 обеспечивает большинство биологических активностей ФНО-α [4].
Оценка его содержания у больных СД 2 типа установила увеличение его концентрации в 1,6±0,3 раза у больных с ИМТ<25 кг/м2 в сравнении с контролем (табл. 1). При наличии у больных СД 2 типа ожирения уровень р ФНО-α р1 был в 1,9±0,1 раза выше контроля и в 1,17±0,4 раза превышал значение в группе больных СД 2 типа без ожирения.
Таблица 1 – Уровень провоспалительных цитокинов в сыворотке крови больных СД 2 типа (M±m)
Параметры | Контроль (n=24) | Больные СД 2 типа | |
ИМТ>5кг/м2 (n=32) | ИМТ>35кг/м2 (n=60) | ||
ФНО-α (пг/мл) | 30,1±3,6 | 61,2±3,4*1 | 76,2±5,2*1,2 |
р ФНО-α р1 (пг/мл) | 2,2±0,4 | 3,6±0,3*1 | 4,2±0,2*1,2 |
ИЛ-1β (пг/мл) | 34,2±3,9 | 54,1±2,9*1 | 69,9±3,6*1,2 |
ИЛ-6 (пг/мл) | 15,2±3,9 | 48,3±4,1*1 | 62,3±6,7*1,2 |
* отмечены достоверные отличия средних арифметических (р<0,05), цифры рядом со звездочкой указывают по отношению к показателям какой группы эти различия достоверны.
Изучение содержания МСР-1 в сыворотке крови больных СД 2 типа показало его увеличение при СД 2 типа с ожирением в сравнении с контролем (110,4±3,2 пг/мл) в 1,6±0,3 раза (p<0,05) и в 1,3±0,2 раза (p<0,05) выше показателя у больных СД 2 типа с ИМТ<25 кг/м2. Наибольшая концентрация имела место в группе больных СД 2 типа с ожирением и гиперлипидемией (198,4±7,4 пг/мл, p<0,05).
Лептин рассматривается в настоящее время как один из маркеров сердечно-сосудистого риска [9]. Проведенные исследования показали, что у всех больных СД 2 типа имеет место повышение уровня лептина в сыворотке крови 13,7±1,4 нг/мл (р<0,05) в сравнении с контрольной группой (4,9±0,54 нг/мл). Следует отметить, что концентрация лептина у больных СД 2 типа с ожирением на 33,1±2,1% превышала его уровень у больных СД 2 типа с ИМТ<25 кг/м2. Максимальная концентрация лептина (18,1±0,9 нг/мл, p<0,01) была отмечена у больных с ожирением и дислипидемией. Выявлены прямые корреляционные связи между уровнем лептина, ОХ и ТГ (r=0,58, p<0,05; r=0,62, p<0,05 соответственно).
В настоящее время р CD40L рассматривается как важный маркер воспаления и тромбообразования, повышение его уровня является фактором риска сердечно-сосудистых заболеваний [8].
Определение содержания р CD40L у больных СД 2 типа с ожирением и ИМТ<25 кг/м2 установило достоверное увеличение его концентрации в сравнении с контрольной группой. Уровень р CD40L у больных СД 2 типа с ожирением превышал значения контроля (5,1±1,2 нг/мл) в 2,6±0,3 раза (p<0,05) и в 1,4±0,2 раза (p<0,05) – его содержание у больных СД 2 типа без ожирения. Наибольший уровень р CD40L определен в сыворотке крови больных СД 2 типа с ожирением и гиперлипидемией (15,2±0,8 нг/мл).
Известно, что провоспалительные цитокины (ФНО-a, ИЛ-1b, ИЛ-6) обладают свойствами индуцировать развитие эндотелиальной дисфункции, так ФНО-a активирует лейкоциты, участвующие в воспалительных реакциях, вызывает экспрессию молекул адгезии на поверхности эндотелиоцитов. Следствием чего является адгезия нейтрофилов, моноцитов, лимфоцитов с развитием воспалительной инфильтрации сосудистой стенки. Данный цитокин является мощным фактором активации перекисного окисления липидов, активирует систему свертывания крови, усиливает тромбогенную и вазоконстриктивную активность эндотелия, снижает синтез NO, что потенцирует повышение жесткости артериального русла. ИЛ-1b оказывает провоспалительное действие на эндотелиоциты, гладкомышечные клетки сосудов, макрофаги, усиливает инфильтрацию сосудистой стенки воспалительными клетками, атерогенез [4; 7]. При хронических заболеваниях ФНО-α также способен индуцировать инсулинорезистентность и дислипидемию [4]. Увеличение концентрации р ФНО-α р1 коррелирует с развитием и прогрессированием атеросклероза. ИЛ-6 действует через ФНО-a и ИЛ-1b, вызывает дисфункцию эндотелия, потенциально являясь триггером острых коронарных событий [4].
По разнообразию клеточных источников продукции и мишеней биологического действия ИЛ-6 является одним из наиболее активных цитокинов, который принимает участие в реализации иммунного ответа и воспалительных реакций, проявляя свою активность не только в жировой ткани, но и системно [4]. Особенно важно, что ИЛ-6 повышает кардиоваскулярный риск, нарушая соотношение атерогенных и антиатерогенных липидов, липопротеидов и их белковых компонентов (апо В/апо А1, ХС/ХС ЛПВП и ХС ЛПВП/ХС ЛПНП) [10]. Проведенный корреляционный анализ выявил наличие высокой достоверной взаимосвязи между уровнем лептина и ИЛ-6 (r=0,68, р<0,01), уровнем лептина и индексом массы тела (r=0,62, р<0,05), содержанием ИЛ-6 и ИМТ (r=0,59, p<0,05) и ОХ, ТГ (r=0,52, p<0,05; r=0,54, p<0,05 соответственно).
Согласно литературным данным, МСР-1 рассматривается в качестве субклинического маркера атеросклеротического поражения сосудистого русла, отражает также активность иммунного воспаления и активацию моноцитарно-макрофагального звена иммунитета [10].
Лептин, наряду с влиянием на метаболизм липидов в сосудистой стенке, оказывает и другие проатерогенные эффекты, участвуя в процессах гемостаза, активации функции тромбоцитов, гипертрофии гладкомышечных клеток. Высокий уровень лептина в плазме крови нередко сопровождается эндотелиальной дисфункцией, оксидативным стрессом, провоспалительной и противовоспалительной цитокинемией. Лептин структурно гомологичен с ФНО-α, ИЛ-6 и др. семействами цитокинов и вследствие этого считается цитокиноподобной субстанцией [5; 9]. Воспаление и тромбоз играют важную роль в патогенезе сердечно-сосудистых заболеваний. Одним из механизмов, связывающих воспаление и тромбообразование, является активация сигнальной системы CD40/CD40L, CD40 и CD40 лиганд-трансмембранные гликопротеиды, относящиеся к семейству рецепторов ФНО и семейству ФНО соответственно. CD40 и CD40L экспрессируются различными клетками атеросклеротической бляшки: В-лимфоцитами, макрофагами/моноцитами, эндотелиальными и гладкомышечными клетками [8].
Результаты исследований показали, что на фоне приема фенофибрата в течение шести месяцев уровень холестерина и триглицеридов у больных СД 2 типа с ожирением снизился соответственно на 10,5±0,6% и 11,3±0,7% (р<0,05), индекс атерогенности плазмы уменьшился на 15,4±0,4% (р<0,05), уровень холестерина липопротеидов высокой плотности увеличился на 8,9±0,6% (р<0,05).
После 6 месяцев терапии фенофибратом определено снижение провоспалительной цитокинемии, уровень ФНО-a уменьшился на 16,2±0,3% (р<0,05), ИЛ-1b – на 12,3±0,2% (р<0,05), ИЛ-6 – на 15,4±0,4% (р<0,05), р ФНО-α р1 на 15,6±0,2% (p<0,05). Установлено достоверное снижение концентрации лептина на 9,5±0,4%, р CD40L на 14,4±0,2% (p<0,05), МСР-1 на 13,6±0,3% (p<0,05) у больных СД 2 типа с ожирением.
Полученные результаты свидетельствуют о корригирующем влиянии фенофибрата на показатели липидного спектра и активность иммунного воспаления, что потенциально связано с уменьшением риска развития сердечно-сосудистых осложнений у этой категории больных.
Выводы
- У больных СД 2 установлено достоверное повышение в сыворотке крови уровня цитокинов провоспалительного действия (ИЛ-1b, ИЛ-6, ФНО-a, р ФНО-α р1), лептина, р CD40L, МСР-1 в большей степени при наличии ожирения.
- Терапия фенофибратом оказывает корригирующее влияние на нарушения иммунного статуса у больных СД 2 типа с ожирением.
Рецензенты:
- Снимщикова И.А., д.м.н., профессор, зав. кафедрой иммунологии и специализированных клинических дисциплин медицинского института ГОУ ВПО «Орловский государственный университет», г. Орел.
- Якунченко Т.И., д.м.н., профессор, зав. кафедрой пропедевтики внутренних болезней Белгородского государственного университета, г. Белгород.
Библиографическая ссылка
Князева Л.И., Окрачкова И.В., Бондырева А.В., Маслова Т.А. ДИНАМИКА ПОКАЗАТЕЛЕЙ АКТИВНОСТИ ИММУННОГО ВОСПАЛЕНИЯ У БОЛЬНЫХ САХАРНЫМ ДИАБЕТОМ 2 ТИПА ПОД ВЛИЯНИЕМ ТЕРАПИИ // Современные проблемы науки и образования. – 2012. – № 5.;
URL: https://science-education.ru/ru/article/view?id=7002 (дата обращения: 08.05.2021).
Предлагаем вашему вниманию журналы, издающиеся в издательстве «Академия Естествознания»
(Высокий импакт-фактор РИНЦ, тематика журналов охватывает все научные направления)
Источник
Введение
Рост заболеваемости сахарным диабетом (СД) является глобальной проблемой здравоохранения. Согласно отчетам Международной диабетической федерации (IDF) 2017 г. общее количество взрослого населения с СД составляет около 425 млн человек во всем мире, и это число увеличится примерно до 629 млн к 2049 г. [1]. Основной причиной смерти пациентов с СД 2 типа (СД2) служит развитие сердечно-сосудистых заболеваний. Развитие воспаления и фиброза – неотъемлемый компонент неблагоприятного структурного ремоделирования сердечной мышцы у пациентов с СД2. В связи с этим возникает вопрос об оценке фиброзных изменений при СД2 и контроле за их динамикой на фоне терапии. Существуют как инвазивные, так и неинвазивные методики, которые позволяют оценивать накопление фиброзной ткани в миокарде. Кроме того, большое внимание уделяется поиску биомаркеров в крови, которые бы позволяли отслеживать раннюю динамику фиброзных изменений. Среди таких потенциальных маркеров активно изучается роль галектина-3, матриксных металлопротеиназ (MMP), ингибиторов MMP и различных молекул проколлагенов. Галектин-3 относится к семейству бета-галактозидсвязывающих лектинов, он участвует в регуляции процессов пролиферации и дифференцировки клеток, а также клеточной адгезии [2]. В исследованиях было показано, что галектин-3 участвует в патогенезе осложнений диабета и может быть прогностическим маркером при хронической сердечной недостаточности (ХСН) [3]. Мониторинг концентрации коллагена и его пептидов в сыворотке крови и других биологических жидкостях также рассматривается у пациентов с СД2 для оценки процессов фиброза [4]. Так, например, уровень карбокситерминального фрагмента проколлагена I типа (PIСP) ассоциирован с фиброзом миокарда у больных гипертонической болезнью [5] и пациентов с СД2 [6]. Циркулирующие маркеры деградации внеклеточного матрикса, такие как ММР и их тканевые ингибиторы (TIMP), принимают участие в атероматозных изменениях стенки сосудов. Показано, что TIMP-1 и MMP-9 могут быть вовлечены в процессы фиброза [7], а их концентрации значимо повышены у пациентов с СД2 [8]. Кроме того, TIMP-1 играет роль в развитии диастолической дисфункции и гипертрофии левого желудочка путем уменьшения деградации коллагена I типа и увеличения жесткости и массы миокарда [9]. В настоящее время существуют группы сахароснижающих препаратов, которые продемонстрировали положительное влияние на сердечно-сосудистые исходы. Так, представитель группы ингибиторов натрий-глюкозного котранспортера 2 типа (ИНГТ-2) –
эмпаглифлозин снижал сердечно-сосудистую смертность, общую смертность и комбинированную конечную точку MACE (нефатальный инсульт, нефатальный инфаркт, сердечно-сосудистая смертность), по данным исследования EMPAREG-OUTCOME [10]. Однако механизмы снижения сердечно-сосудистой смертности на фоне терапии ИНГТ-2 до сих пор не установлены. В связи с этим представляется актуальной оценка биомаркеров, отражающих патологические процессы в миокарде у пациентов с СД2.
Цель настоящего исследования – оценка динамики биомаркеров фиброза в ходе терапии эмпаглифлозином у пациентов с СД2 и очень высоким риском сердечно-сосудистых событий (ССС).
Материал и методы
В исследование включены 30 пациентов с СД2, которые в течение 24 нед. получали 10 мг/сут эмпаглифлозина. Перед исследованием пациенты подписывали информированное согласие.
Критерии включения
Женщины или мужчины в возрасте от 40 до 70 лет с СД2, гликированным гемоглобином (HbA1c) 7,0-11,0%, стабильной сахароснижающей терапией по крайней мере в течение 12 нед. до включения в исследование, наличием трех сердечно-сосудистых факторов риска (дислипидемия, артериальная гипертензия, ожирение).
Критерии исключения
Ишемическая болезнь сердца, хроническая сердечная недостаточность, уровень NT-proBNP >125 пг/мл, а также наличие другой клинически значимой сердечно-сосудистой патологии, расчетная скорость клубочковой фильтрации (СКФ) в соответствии с CKD-EPI (СКФ<60 мл/мин/1,73 м2), наличие противопоказаний для терапии эмпаглифлозином.
В ходе исследования проводилась оценка таких лабораторных параметров, как гликированный гемоглобин (HbA1c), креатинин с расчетом СКФ, галектин-3, TIMP-1, PICP, MMP-9, ST-2, NT-proBNP, общий холестерин, липопротеины низкой и высокой плотности, триглицериды. Всем пациентам проведена трансторакальная эхокардиография (Эхо-КГ). Лабораторные исследования и Эхо-КГ выполнялись до начала лечения и через 24 нед. терапии эмпаглифлозином. С целью оценки исходных значений биомаркеров фиброза в исследование дополнительно были включены 13 пациентов без СД2, но с наличием трех факторов риска ССС (артериальная гипертензия, ожирение, дислипидемия). Этим пациентам также были выполнены соответствующие лабораторные исследования.
Статистический анализ
Статистический анализ проводился с использованием пакета статистического программного обеспечения SPSS istics. Количественные признаки представлены в виде медианы и квартилей – Me (25% квартиль –
75% квартиль), качественные признаки – в виде числа наблюдений и процента (n (%)). Различия между количественными признаками анализировались с использованием критерия Уилкоксона. Для выявления различий между независимыми выборками использовался критерий Манна – Уитни. Корреляционный анализ проводился с использованием рангового коэффициента корреляции Спирмена. Нулевая гипотеза отвергалась при р<0,05.
Результаты
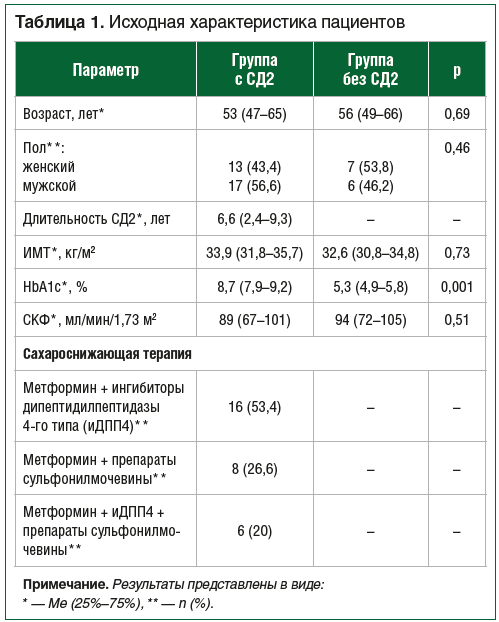
Исходная характеристика пациентов представлена в таблице 1.
Через 24 нед. от начала лечения наблюдалось значимое снижение уровня HbA1c до 7,7% (7,3-8,0), р=0,0001, и ИМТ до 31,5 кг/м2 (29,8-33,2), р=0,002. По данным Эхо-КГ: фракция выброса (ФВ) по Симпсону на начало исследования составила 61% (59-65%) и значимо не отличалась через 24 нед. лечения (60% (59-64%), p=0,7.
Пациенты в группах с СД2 и без СД2 значимо не различались по полу, возрасту и ИМТ. При сравнении исходных значений биомаркеров фиброза в этих группах показано, что средняя концентрация MMP-9 была значимо выше в группе СД2 – 580 нг/мл (390-1100) против 350,0 нг/мл (270,0-720,0) в группе без СД2, p=0,01. Кроме того, уровень галектина-3 – 8,9 нг/мл (7,5-10,3) и 5,2 нг/мл (3,5-6,9), р=0,03 и концентрации P1CP – 130,1 нг/мл (99,3-190,2) и 90,3 нг/мл (70,1-99,8), р=0,009, в среднем были значимо выше в группе СД2. Концентрации TIMP-1, NT-proBNP и ST-2 значимо не различались между группами.
Не было получено значимых различий между концентрациями галектина-3 до начала лечения и через 24 нед. терапии эмпаглифлозином: 8,9 нг/мл (7,5-10,3) и 10,1 нг/мл (6,9-14,1) соответственно (р=0,6), как и между уровнями ST-2: 22,1 нг/мл (16,2-28,6) и 19,4 нг/мл (15,9-23,8) соответственно (p=0,4) и MMP-9: 580 нг/мл (390-1100) и 639,0 нг/мл (330,0-1060,0) соответственно (p=0,5). Наблюдалось значимое снижение концентрации P1CP через 24 нед. лечения по сравнению с исходными значениями – 102,6 нг/мл (87,1-160,2) и 130,1 нг/мл (99,3-190,2) соответственно (р=0,02). Уровень TIMP-1 через 24 нед. лечения значимо не различался по сравнению с исходным: 200 нг/мл (180-220) и 210 нг/мл (175-234) соответственно (р=0,6). Значимых корреляций между биомаркерами фиброза и уровнем HbA1c, длительностью СД2 и возрастом пациентов не получено. Отмечалась значимая положительная корреляция между концентрацией TIMP-1 и ФВ в конце исследования (r=0,699, р=0,008).
Обсуждение
Обширные клинические данные подтверждают наличие фиброза миокарда у пациентов с СД2, развивающегося независимо от артериальной гипертензии и атеросклероза коронарных артерий [11]. Ассоциированный с СД интерстициальный фиброз характеризуется накоплением коллагена I и III типа, затрагивает как левый, так и правый желудочек и описан при обоих типах СД [12]. В нашем исследовании выявлена более высокая концентрация P1CP у пациентов с СД2 по сравнению с контрольной группой. Повышение экспрессии P1CP при гипергликемии было описано в животных моделях [13], а в исследовании у пациентов с СД2 и макроальбуминурией уровень P1CP был значимо выше по сравнению со здоровым контролем [14]. Однако не удалось обнаружить исследований, в которых оценивались бы различия в содержании P1CP у пациентов с СД2 и пациентов без СД2, но с факторами риска сердечно-сосудистых заболеваний. По данным нашего исследования, у пациентов с СД2 также наблюдается значимо более высокий уровень галектина-3. Этот результат соответствует ранее полученным данным в других исследованиях [15]. Например, в проспективном исследовании было показано, что галектин-3 связан с ССС и смертностью от всех причин у пациентов с СД2, и эта взаимосвязь наблюдается у пациентов и без сердечно-сосудистых заболеваний [16]. Повышение MMP-9 у пациентов с СД2 также было описано в предыдущих исследованиях [17], что соотносится с полученными нами результатами. Кроме того, более высокое содержание MMP-9 описано у пациентов с СД2 и диабетической ретинопатией по сравнению с пациентами с СД2, но без ретинопатии в анамнезе, что свидетельствует о вовлечении MMP-9 не только в процессы миокардиального фиброза, но и в патогенез хронических микрососудистых осложнений СД [18]. В настоящем исследовании не было получено значимых различий между группами по уровню NT-proBNP и ST-2, что может отражать отсутствие ХСН в обеих группах, поскольку данные маркеры используются преимущественно в диагностике ХСН. В целом по результатам нашего исследования пациенты с СД2 и факторами риска сердечно-сосудистых заболеваний имеют более высокие концентрации маркеров фиброза. Данная ситуация, в свою очередь, может приводить к снижению желудочковой эластичности и развитию ХСН с сохранной фракцией выброса. Кроме того, связанный с диабетом фиброз предсердий может вызывать фибрилляцию предсердий, ухудшать течение ХСН и увеличивать частоту инсультов. Также фиброзные изменения в желудочках могут быть причиной повышенного риска желудочковых аритмий и внезапной смерти, наблюдаемой у пациентов с СД2 [19-23]. Таким образом, снижение выраженности миокардиального фиброза позволит уменьшить кардиоваскулярную заболеваемость и смертность у пациентов с СД2.
В настоящем исследовании на фоне 24-недельной терапии эмпаглифлозином не было получено значимой динамики биомаркеров фиброза, за исключением снижения уровня P1CP. Хотя в клеточных и животных моделях было продемонстрировано положительное влияние эмпаглифлозина на процессы ремоделирования и фиброзные изменения в миокарде, значимость этих влияний у людей остается малоизученной [24, 25]. Нами не обнаружено исследований, в которых оценивалась бы динамика биомаркеров фиброза у пациентов с СД2 без кардиоваскулярной патологии. Отсутствие значимой динамики биомаркеров фиброза в данной популяции пациентов по результатам нашего исследования может объясняться разными причинами. Во-первых, развитие миокардиального фиброза требует времени, соответственно, и регресс этих изменений представляет собой длительный процесс, а динамика биомаркеров фиброза может отсутствовать за время 24-недельного наблюдения. Во-вторых, небольшое количество пациентов, составивших выборку нашего исследования, может быть недостаточным для выявления значимых изменений в концентрации маркеров. Однако снижение уровня P1CP позволяет предположить, что в дальнейшем стоит ожидать значимых изменений в динамике маркеров фиброза на фоне терапии эмпаглифлозином.
Заключение
Пациенты с СД2 и очень высоким риском ССС имеют значимо более высокие концентрации биомаркеров фиброза по сравнению с пациентами без СД2, но с наличием трех факторов риска ССС (артериальная гипертензия, ожирение, дислипидемия). Терапия эмпаглифлозином в течение 24 нед. не приводит к значимому изменению биомаркеров фиброза, за исключением снижения концентрации PIСP. Требуются дальнейшие исследования с большей длительностью наблюдения для уточнения влияния эмпаглифлозина на процессы фиброза у пациентов с СД2.
Источник
