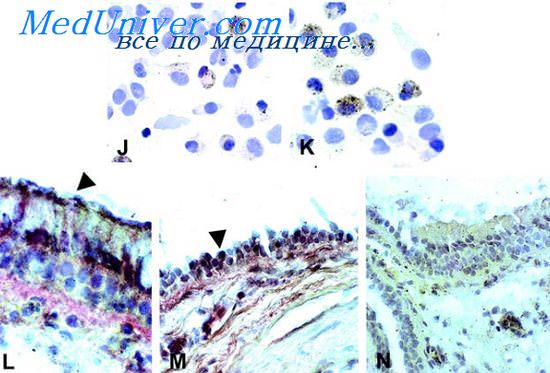
Медиаторы воспаления при бронхиальной астме
Медиаторы бронхиальной астмы. Тучные клетки и ответы типа I при астмеПодробное обсуждение неиммунологических факторов, вызывающих и поддерживающих астму, выходит за рамки наших статей. Однако необходимо остановиться вкратце на фармакологических и неврологических событиях, чтобы не потерять из виду все многочисленные факторы, связанные с индукцией астмы. Значение их особенно велико в настоящее время, когда вся область иммунофармакологии так быстро развивается. Многие исследователи подробно изучали медиаторы, высвобождающиеся из тучных клеток, и было опубликовано несколько интересных обзорных работ на эту тему за последнее время [Orange, 1971; Vane, 1971; Austen, Lichtenstein, 1973; Piper, 1974]. Медиаторы у человека изучались в периферических базофилах, в гомогенатах легочной ткани п в ее разделенных клеточных фракциях, и экспериментально на перфузируемых легких ин-тактных животных. Легочная ткань больных астмой выделяет как гистамин [Schild et al., 1951], так и медленно реагирующую субстанцию анафилаксии (МРС-А) [Brocklehurst, 1960, 1975] при воздействии соответствующих антигенов in vitro. Позднее был открыт фактор хемотаксиса эозинофилов (ФХЭ-А) [Кау, Austen, 1971]. При анафилактическом воздействии на легочную ткань in vitro было обнаружено также несколько типов простагландинов [Piper, Vane, 1969; Riper, Walker, 1973]. Простагландины E1 и Е2 обладают способностью воздействовать на гладкие мышцы, расширяя бронхи. Кроме того, после антигенного воздействия из сенсибилизированных легких человека был выделен фактор, активирующий тромбоциты [Siraganian, Osier, 1971]. При определении количества медиаторов в надосадоч-пой жидкости и в остаточной легочной ткани после антигенного воздействия на сенсибилизированные клетки легких человека или их фрагменты удалось установить, какие медиаторы образуются раньше и какие синтезируются после иммунологической стимуляции.
Гистамин образуется заранее и хранится в гранулах тучных клеток [Ishizaka et al., 1972]. При анафилаксии он высвобождается путем экзоцитоза — на этом биохимическом пути действуют диизопропилфиорофосфат (ДФФ), серинэстераза и ионы кальция [Austen, 1973]. ФХЭ-А также заранее образуется в легких [Wasserman et al., 1973]. Напротив, МРС-А и простагландины не образуются заранее и синтезируются вследствие анафилактической стимуляции. Интересно, что в отличие от образования простагландинов синтез МРС-А может быть заторможен гликатом натрия-хрома [Dawson, Tomlison, 1974]. Особенно важно то, что секреция этих веществ в гомогенатах легочной ткани, видимо, находится под влиянием стимуляции а- и бета-адренергических и холииергических рецепторов [Kaliner et al., 1972; Orange et al., 1971]. Такие адренергические агенты, как изопреналин, увеличивают внутриклеточное содержание циклического аденозин-3,5-монофосфата (циклический АМФ) и подавляют высвобождение гистамина и МРС-А. Такие а-адренергические агенты, как фенилэприн, снижают уровень циклического АМФ и оказывают обратное действие, повышая выделение гистамина и МРС-А [Lichtenstein, Margolis, 1968]. При холинергической стимуляции повышается уровень гуанозина-3,5-монофосфата (циклического ГНФ) и увеличивается высвобождение гистамина и других медиаторов [Orange, 1971]. – Также рекомендуем “Иммунофармакология реакций типа III при астме. Иммунонейрофармакология астмы” Оглавление темы “Виды и формы бронхиальной астмы”: |
Источник
Калликреин-кининовая система при бронхиальной астме.Калликреин-кининовая система играет большую роль в развитии иммунного и неиммунного воспаления и нарушениях микроциркуляции, поскольку в структурном и функциональном отношениях находится в связи со свертывающей и фибринолитическими системами в рамках единой системы фактора Хагемана, а калликреин является основным ферментом, образующим кинины и модулирующим активность общего для этих систем фактора Хагемана. Калликреин-кининовая система состоит из кининов, кининообразующих и кининразру-щающих ферментов, и их дисбаланс приводит к патологии. Существует наследственная предрасположенность к такому дисбалансу: есть люди, обладающие генетически более мощным потенциалом биосинтеза калликреина, а другие – его ингибиторов. При бронхиальной астме обычно увеличено образование и накопление кининов, снижена ингибиторная активность кининазы и двух высокомолекулярных ингибиторов калликреина – медленнодействующего и быстродействующего (МИК и БИК соответственно), что часто сочетается с нарушением микроциркуляции: показано, что лечение тренталом, сопровождаемое улучшением диффузного и локального кровотока в легких, приводит к усилению ингибиторной активности крови по содержанию в ней БИК и МИК. С помощью COMOD-технологии нами выделены группы больных, у которых по совокупности статистически достоверно связанных признаков показана ведущая роль дисбаланса калликреин-кининовой системы в патогенезе бронхиальной обструкции, в частности при преобладающем отечном механизме нарушения бронхиальной проходимости, что встречалось при различных вариантах воспаления бронхов, в том числе при преобладании в бронхиальном смыве неизмененного эпителия бронхов.
Помимо вирусной инфекции, возможной причиной активации калликреин-кининовой системы при легочной патологии является блокирование кининазы II (нейтральной эндопептидазы), которая содержится в специальных микровезикулах легочного эндотелия, повреждаемого лизосомальными ферментами и вазоактивными веществами, в результате чего активируется фактор Хагемана и инициируется гемокоагуляция по внутреннему пути, а выделение тканевого тромбопластина из поврежденных клеток активирует гемокоагуляцию по внешнему пути, что, в итоге, может проявиться ДВС-синдромом. Снижение активности кининаз у больных бронхиальной астмой приводит к относительному дефициту ингибитора протеаз, что способствует воспалительной реакции. Участие брадикинина в воспалительных реакциях при болезнях легких связывают с изначальным повреждением эпителиальных клеток, в которых находятся терминалы “С”-фибрилл, через которые вовлекаются в воспаление не только холинэргические механизмы, но также выделяются нейролептиды – высокоактивные пептиды, образуемые нейросекреторными клетками АПУД-системы. Важнейшие медиаторы нейрогенного воспаления – вещество “Р” и нейрокинины выделяются путем антидромного аксон-рефлекса при возбуждении ирритантных рецепторов, что особенно типично при повышенной десквамации эпителия. Активация аксон-рефлекса приводит к расширению сосудов, увеличению кровотока, отеку и нарушениям микроциркуляции, причем нейропептиды показывают сосудистую реакцию даже в следовых количествах, недостаточных для реакции гладких мышц бронхов, поэтому, возможно, что гиперемия и отек у больных бронхиальной астмой связаны, прежде всего, с выделением нейропептидов. Нейрокины метаболизируются нейтральной эндопептидазой базальных клеток эпителия дыхательных путей, повреждение которого типично для вирусной инфекции, что приводит к снижению активности этого фермента, а также сопровождается дисбалансом калликреин-кининовой системы, поскольку этот же фермент метаболизирует брадикинин. Таким образом, обмен нейропептидов и развитие нейрогенного воспаления, чему способствует брадикинин, тесно связаны с дисбалансом калликреин-кининовой системы, и этот механизм может реализоваться в выделенной нами группе больных бронхиальной астмой. Совершенно иной по своим характеристикам оказалась вторая группа больных с повышенной десквамацией эпителия бронхов, выделенная COMOD-технологией. У всех больных оказались значительные нарушения бронхиальной проходимости, в диагностически значимых титрах определялась патогенная или непатогенная микрофлора в бронхиальном дереве, выявлен “макрофагальный дефицит”, снижение числа Т-лимфоцитов в периферической крови, а также другие иммунные нарушения: увеличение ЦИК, повышение концентрации IgE и активности кислой фосфатазы, что в сочетании со снижением показателя “диффузия легких” (менее 80% должной величины) позволяет предположить развитие микроваскулита легочных сосудов, вызывающего свеобразный сосудистый вариант бронхиальной астмы. Обнаружение большого количества ресничных и бокаловидных клеток среди клеток эпителия бронхов позволило выделить с помощью COMOD-технологии третью группу больных бронхиальной астмой, в состав которой вошли больные как атопического, так и инфекционно-зависимого клинико-патогенетических вариантов бронхиальной астмы, у которых в генезе болезни существенную роль играет бокаловидноклеточная гиперплазия, сопровождаемая гиперсекрецией и дискринией мокроты. У всех больных этой группы определялась НГБ по пробе с ацетилхолином, и выявлена статистически достоверная связь (знак связи отрицательный) между дозой ацетилхолина и количеством бокаловидных клеток в бронхиальном смыве, что подтверждает роль бокаловидноклеточной гиперплазии в развитии НГБ. У больных выявлены также признаки вирусной инфекции (серологически и иммунофлуоресцентными методами, без клинических признаков ОРВИ), которая может способствовать гиперплазии бокаловидных клеток, слущиванию эпителия бронхов и изменениям состава слизи. Возрастание в бронхиальном смыве числа ресничных клеток – показатель выраженного повреждения цилиарного эпителия и возможное свидетельство ослабления его связи с базальными клетками и базальной мембраной, что способствует проникновению в подслизистую аллергенов и других стимуляторов воспаления, и чаще является вторичным, но не исключено, что у некоторых больных бронхиальной астмой нарушение десмосом и ослабление связи эпителия с базальными клетками – первичный дефект. В настоящее время также показано, что бронхиальный эпителий выделяет провоспалительные цитокины, привлекающие в просвет бронхов эозинофилы и нейтрофилы, а также RANTES (Regulated on Activation, Normal T-cell Expressed and Secreted), влияющие на многие клетки воспаления, в том числе на Т-лимфоциты и моноциты. Бронхиальный эпителий выделяет также окись азота (N0) под влиянием различных стимулов, в частности фактора некроза опухолей. Окись азота вызывает бронходилатацию и функционально уравновешивает действие других факторов, в частности эндотелина, выделяемых также эпителием бронхов и осуществляющих бронхоконстрикцию и вазоконстрикцию, а у больных бронхиальной астмой баланс выделения этих веществ при повреждении эпителия нарушается, что может играть роль в генезе бронхоконстрикции.
С другой стороны, вазодилатация, вызванная N0, может быть вредна, т.к. она увеличивает пропотевание плазмы, что поддерживает воспаление, тем более, что у больных бронхиальной астмой обнаружены поры в васкуляр-ном эндотелии, способствующие экссудации плазмы. Все это, а также ряд других феноменов, указывающих на роль эпителия в генезе воспаления бронхов, описанных ранее, подтверждают значимость обнаружения повышенного количества эпителия бронхов в лаважной жидкости БА и позволяют говорить о своеобразном десквамативном бронхите у некоторых больных. Если описание бронхиальной астмы как эозинофильного бронхита относится к 1916 году, то в настоящее время С. Person ставит вопрос: “не назвать ли бронхиальной астму десквамативным бронхитом?”. Краткая характеристика неэозинофильных вариантов воспаления бронхов у больных бронхиальной астмой, выделенных с помощью COMOD-технологии, представлена в таблице. Патогенетические особенности. У всех больных – профессиональные вредности и первичное развитие токсического или пылевого бронхита, колонизация бронхиального дерева микрофлорой и вторичное присоединение бронхиальной астмы. Имеются причинно-значимые неинфекционные аллергены, часто -признаки вирусной инфекции; преимущественно дистальные нарушения бронхиальной проходимости. У некоторых больных – дефицит эндогенных глюкокортикоидов. Имеются причинно-значимые неинфекционные аллергены и признаки вирусной инфекции, особенности изменения активности ККС. Выявляется патогенная или непатогенная микрофлора в диагностически значимых титрах, иммунные нарушения. У некоторых больных возможен иммунный микроваскулит легочных сосудов. Важную роль в развитии гиперчувствительности бронхов играет гиперсекреция и дискриния. Нарушена связь эпителия с базальными клетками, не исключено, что у некоторых больных это – первичный дефект. У некоторых больных выявляются причинно-значимые неинфекционные аллергены, у других – колонизация микрофлорой бронхиального дерева и признаки инфекционно-зависимой бронхиальной астмы. – Также рекомендуем “Разнообразие моделей воспаления при болезнях легких.” Оглавление темы “Роль гормонов и биологически активных веществ в воспалении бронхов.”: |
Источник
Описание
Бронхиальная астма – заболевание, которое характеризуется хроническим аллергическим воспалением дыхательных путей и гиперреактивностью бронхов.
Бронхиальная астма является самым распространенным хроническим заболеванием дыхательных путей в мире: ей болеют более 300 миллионов человек в мире. Летальность достигает 18%, однако этот показатель зависит от уровня жизни населения и доступности медицинской помощи. Распространённость заболевания среди стран мира колеблется от 1% до 18%. Согласно статистике, основанной на данных обращаемости, в Российской Федерации заболеваемость составляет 1,5%. Однако результаты эпидемиологических исследований, проведенных в России, свидетельствуют о другом: распространённость бронхиальной астмы среди детей и подростков составляет 5%, среди взрослого населения – 9%.
Риск развития бронхиальной астмы определяется внутренними и внешними факторами. К внутренним факторам относятся:
- Генетическая предрасположенность к заболеванию.
- Атопия – выработка избыточного количества иммуноглобулинов Е (IgE) в ответ на попадание в дыхательные пути аллергенов из внешней среды.
- Гиперреактивность бронхов.
- Пол, возраст, расовая принадлежность. В возрасте до 10 лет бронхиальная астма развивается чаще всего у мальчиков, а в подростковом и взрослом возрастах впервые с заболеванием часто сталкиваются женщины.
К внешним факторам развития бронхиальной астмы относят гипераллергенные вещества и факторы, способствующие развитию хронического воспаления:
- Домашние аллергены (домашняя пыль, аллергены животных, тараканов, продукты жизнедеятельности грибов).
- Внешние аллергены (пыльца растений).
- Систематическое активное и пассивное курение.
- Воздушные поллютанты. К этим веществам относятся продукты производства, загрязняющие воздух в рабочем помещении.
- Частые респираторные инфекции.
- Паразитарные инфекции.
- Ожирение.
Механизм развития бронхиальной астмы по мнению специалистов базируется на хроническом воспалении дыхательных путей, гиперреактивности бронхов, ремоделировании дыхательных путей. В формировании воспаления принимают участие иммунные (IgE-опосредованные, IgE-неопосредованные) и неиммунные механизмы. IgE-опосредованные механизмы развития бронхиальной астмы в большей степени присущи детям. IgE располагается на эффекторных клетках (тучные клетки, базофилы, эозиофилы), при связывании иммуноглобулина с атигеном происходит дегрануляция этих клеток. Содержимое эффекторных клеток провоцирует развитие воспалительной реакции и активацию других клеток (фибробластов, эпителиоцитов). Хроническое воспаление способствует развитию гиперреактивности бронхов. Это проявляется сокращением гладкой мускулатуры дыхательных путей, гиперсекрецией слизи, отёком дыхательных путей в ответ на действие аллергена, т.е. просвет бронхов и бронхиол сужается.
В долгосрочной перспективе из-за хронического воспаления стенки бронхов и последующие дыхательные структуры подвергаются ремоделированию. При этом гладкая мускулатура становится гипертрофированной, увеличивается отложение коллагена (фиброз), утолщается базальная мембрана бронхов. Ремоделирование дыхательных путей приводит к необратимому сужению их просвета.
По международной классификации болезней (МКБ-10) выделяются следующие формы астмы (в скобках указан международный номер заболевания):
- Астма (J45)
- Аллергическая астма (J45.0)
- Неаллергическая астма (J45.1)
- Смешанная астма (J45.8)
- Неуточнённая астма (J45.9)
- Астматический статус (J46) – жизнеугрожающее состояние, острая дыхательная недостаточность вследствие обострения бронхиальной астмы.
Симптомы
Фото: indianexpress.com
Клинические проявления бронхиальной астмы связаны с дискомфортом дыхания. К основным респираторным симптомам относят: приступы удушья с экспираторной одышкой (затруднение выдоха), ощущение сдавливания груди, сухой или продуктивный кашель с отхождением прозрачной мокроты, свистящее дыхание. Данные симптомы вызваны попаданием аллергенов в дыхательные пути, респираторными инфекциями, физическими нагрузками, психоэмоциональным состоянием. Чаще всего приступы бронхиальной астмы проявляются в утренние либо ночные часы.
Приступу бронхиальной астмы у некоторых пациентов могут предшествовать навязчивый кашель, зуд в носу и носоглотке, першение горла, кожный зуд, ощущение тревожности из-за нехватки воздуха.
При исследовании легких во время перкуссии слышен коробочный звук, отличный от звука здорового дыхательного аппарата. При проведении аускультации можно услышать удлиненный вдох, а при выдохе появляются свистящие хрипы вследствие затрудненного выхода воздуха из легких.
Осложнениями бронхиальной астмы являются:
- Образование ателектазов.
- Эмфизема легких.
- Спонтанный пневмоторакс на фоне образовавшихся ателектазов.
- Легочное сердце. Образуется в результате повышенного давления в легких и легочной артерии.
Диагностика
Фото: agf-clinica.ru
Заподозрить астму можно при повторении клинических проявлений (более 3 эпизодов), описанных выше, отягощении наследственности по аллергической патологии, наличии атопии (увеличенном содержании IgE).
При подозрении на бронхиальную астму в первую очередь проводятся следующие клинические исследования:
- Общий анализ крови. При атопии могут быть повышены эозинофилы, но этот симптом проявляется и при глистных инвазиях.
- Функции внешнего дыхания (пикфлоуметрия, спирография):
- Спирография – методика непрерывной регистрации объемов вдыхаемого и выдыхаемого воздуха. Получаемую при этом графическую кривую называют спирограммой, по ней определяют жизненную емкость легких, дыхательные объемы, частоту дыхания, произвольную максимальную вентиляцию легких. При форсированном выдохе определяют форсированную жизненную емкость легких (ФЖЕЛ) и объем форсированного выдоха за одну секунду (ОФВ1). Отношение ОФВ1 к ФЖЕЛ называется индексом Тиффно. Нормальным значение считается отношение показателей форсированных выдохов 70-85%. При обструктивных нарушениях этот показатель может падать до 40%.
- Пикфлоуметрия – метод определения пиковой объемной скорости выдоха. Пиковая объемная скорость выдоха (ПОС) измеряется при форсированном выдохе и является максимальной объемной скоростью потока выдыхаемого воздуха. При сужении просветов дыхательных путей ПОС будет снижаться. Таким образом, при ежедневном использовании пикфлоуметра возможно предугадать следующий приступ бронхиальной астмы.
- Рентгенография органов грудной клетки. Проводится с целью оценки осложнений, вызванных бронхиальной астмой, а также для исключения наличия другого заболевания.
- Аллергологические обследования. Проводятся для установления формы бронхиальной астмы. Данные исследования являются информативными и доступными для проведения. У детей до 5 лет аллергическая кожная реакция скудная, поэтому им аллергические тесты не проводят.
Лечение
Фото: freseniusmedicalcare.ru
Терапия бронхиальной астмы направленна на предотвращение развития угрожающих жизни состояний, устранение либо смягчение симптомов заболевания, улучшение показателей внешнего дыхания, снижение эпизодов обострения болезни, восстановление переносимости физических нагрузок.
Лечение бронхиальной астмы является многофакторным и направленно как на купирование приступов, так и на предупреждение их развития:
- Гипоаллергенный быт заключается в ежедневной влажной уборке жилого помещения, избавлении от вещей, накапливающих пыль, регулярной стирке постельного белья. Нельзя курить в помещении, где живёт человек с проявлениями бронхиальной астмы. При отягощении аллергоанамнеза высокой чувствительностью к шерсти и слюне животных необходимо исключить нахождение домашних питомцев в доме. Продукты жизнедеятельности тараканов являются гипераллергенными, поэтому необходимо тщательно проводить уборку жилого помещения и по возможности применять инсектициды.
- Диетотерапия при бронхиальной астме. Диета назначается на основании данных аллергоанамнеза. Общими принципами диетотерапии являются ограничение употребления в пищу продуктов, содержащих гистамин (копчёности, колбасы, помидоры и др.), либо веществ, способствующих продукции данного активного биологического вещества. Стимулируют высвобождение гистамина консерванты (сульфаты, нитраты). Пациентам с бронхиальной астмой не стоит также употреблять газированные напитки с красителями.
- Медикаментозная терапия направлена на предотвращение, облегчение приступов бронхиальной астмы. Существуют базисная терапия и терапия, облегчающая состояние (средства неотложной помощи):
- Базисная терапия включает в себя применение ингаляционных глюкокортикостероидов, агонистов b2-адренорецепторов, системных глюкокортикостероидов, нестероидные противовоспалительные средства, теофиллины.
- Для оказания неотложной помощи при приступе бронхиальной астмы применяются три группы лекарственных средств: ингаляционные b2-агонисты короткого действия, метилксантины, антихолинегрические средства.
Лекарства
Фото: meteo-tv.ru
Ингаляционные глюкокортикостероиды: беклометазон, будесонид, флутиказон. Механизм действия глюкокортикостероидов заключается в купировании воспалительного процесса. Это достигается благодаря ингибированию фермента фосфолипазы-А2, способствующего образованию арахидоновой кислоты. Медиаторы воспаления не синтезируются из-за отсутствия начального продукта (арахидоновой кислоты).
Системные глюкокортикостероиды: дексаметазон, метипреднизалон. Механизм действия идентичен ингаляционным глюкокортикостероидам.
Агонисты b2-адренорецепторов короткого (сальбутамол, фенотерол) и длительного действия (формотерол). Механизм действия заключается в активации симпатической нервной системы. При её активации просвет дыхательных путей становится шире за счёт расслабления гладкой мускулатуры, снижения продукции слизи.
Нестероидные противовоспалительные средства: напроксен. Механизм действия направлен на ингибирование фермента циклооксигеназы, который способствует синтезу медиаторов воспаления из арахидоновой кислоты.
Метилксантины: аминофиллин. Является производным теофиллина. Применение направлено на уменьшение гиперреактивности бронхов при попадании в дыхательные пути аллергенов.
Антихолинергические средства: ипратропия бромид. Данный препарат блокирует М-холинорецепторы, тем самым ослабляется действие парасимпатичекой нервной системы и усиливается действие симпатической нервной системы на дыхательные пути легких. Эффект схож с действием агонистов b2-адренорецепторов.
Информация носит справочный характер и не является руководством к действию. Не занимайтесь самолечением. При первых симптомах заболевания обратитесь к врачу.
Народные средства
Фото: besthqwallpapers.com
При первом проявлении приступа бронхиальной астмы следует немедленно обратиться за врачебной помощью. После проведенной экстренной терапии лечащий врач назначит все необходимые исследования и определит дальнейшую тактику лечения.
Существуют народные средства, способные облегчить состояние пациента, но такое лечение не принесет долгосрочного эффекта, т.к. действует исключительно симптоматически, не влияя на патологический процесс.
Для приготовления первого средства необходимо измельчить и перетереть 150 граммов столового хрена, добавить к нему сок двух лимонов, полученную массу перемешать до получения однородного продукта. Для предупреждения развития приступа необходимо принимать 1 раз в день утром.
Приготовление следующего снадобья заключается в следующем: 8 граммов корня сухого алтея измельчают, заливают на 1 час холодной водой, затем процеживают и добавляют несколько ложек мёда для улучшения органолептических свойств полученного средства. Полученное средство принимают по 3 столовые ложки каждые 2 часа.
Информация носит справочный характер и не является руководством к действию. Не занимайтесь самолечением. При первых симптомах заболевания обратитесь к врачу.
Источники
- Клинический протокол диагностики и лечения бронхиальной астмы Республики Беларусь.
- Бронхиальная астма: пособие. / Л.Р. Выхристенко. – Витебск: ВГМУ, 2016. – 67 с
- Бронхиальная астма у детей: клинические рекомендации / Е. А. Баранаева. – Минск: БГМУ, 2017. – 34 с.
- Бронхиальная астма (клиника, диагностика, лечение): А.С. Герасимова; под ред. В.Э. Олейникова. – Пенза : Изд-во ПГУ, 2012. – 80с.
Ваши комментарии о симптомах и лечении
Источник