Межклеточные взаимодействия в воспалении
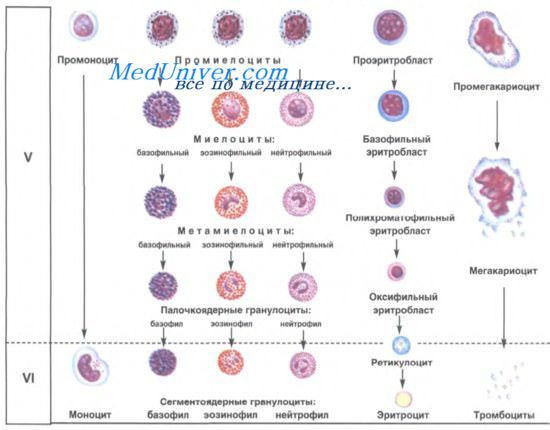
Клеточные и субклеточные механизмы регуляции пролиферативных процессов при воспалении
Заключительная стадия воспаления связана с активированием пролиферации, которая включает взаимодействия, повышающие функциональную активность соединительной ткани. Ее клеточной основой являются фибробласты, а наиболее представленным гликопротеидом – фибронектин – димер с пептидными цепями молекулярной массой 22 кДа, соединенными дисульфидными мостиками.
Фибронектин опсонизирует объекты фагоцитоза, тем самым влияя на фагоцитарную активность макрофагов. Он продуцируется фибробластами и макрофагами. При тяжелых инфекционных процессах, генерализации воспаления, вплоть до возникновения септимеции, при которых практически все стадии воспалительного процесса приобретают исключительно патологический характер, отмечается снижение содержания этого соединения в крови. В этих условиях концентрация фибронектина в плазме может снижаться до 300 мкг/мл. В ходе репаративных процессов он выполняет роль первичной тканевой структуры, вокруг которой определенным образом ориентируются фибробласты и коллагеновые волокна.
При воспалении активированные макрофаги стимулируют пролиферацию фибробластов и способствуют их скоплению в очаге воспаления, активно влияя на ход синтеза ими коллагена. Выделяемый макрофагами фактор роста играет ключевую роль в индукции пролиферативных процессов. Однако следует заметить, что в начале пролиферативной стадии воспаления немаловажное значение имеет фактор пролиферации, синтезируемый тромбоцитами.

В зоне пролиферации паралелльно с фиброгенезом протекают процессы разрушения коллагеновых волокон. Сами фибробласты выделяют факторы, разрушающие коллаген за счет секреции коллагеназы. Фибробласты такого типа принято называть фиброкластами. Оптимальное соотношение различных клеточных элементов способствует нормальному протеканию заживления. Неоправданно высокая пролиферация приводит к образованию грубых рубцов, деформирующих орган.
Основой восстановления функциональных свойств ткани при завершении воспаления является размножение клеток паренхимы. Этот процесс происходит при межклеточном взаимодействии соединительной ткани и делящихся клеток органа [4]. Значительную роль в пространственной ориентации растущих паренхиматозных клеток органа принято отводить коллагену. Следует отметить, что описываемые в литературе механизмы влияния соединительной ткани на морфогенез имеют во многом гипотетический характер. В последнее десятилетие появились работы, в которых изучено влияние макрофагов на рост и дифференцировку паренхимы органа.
При этом показано, что макрофаги выделяют фактор-стимулятор пролиферации как стромальных, так и паренхиматозных элементов. Размножающиеся клетки паренхимы по механизму отрицательной обратной связи влияют на свойства макрофагов. Данное обстоятельство имеет важное значение в регуляции темпов и объема пролиферации. Делящиеся специализированные клетки органа выделяют факторы, разрушающие соединительную ткань, что препятствует рубцовой деформации органа. Благоприятным исходом пролиферативных процессов является восстановление структуры ткани без нарушения ее функции.
Это возможно только в том случае, если воспаление захватывает анатомические образования, специализированные клетки которого способны пролиферировать, и в ходе пролиферативной фазы воспаления наблюдаются процессы оптимального межклеточного взаимодействия. Воспалительный процесс в высокодифференцированной ткани всегда заканчивается ее замещением соединительной тканью с образованием рубца.
– Также рекомендуем “Превращение при воспалении защитных клеточных механизмов в патологические.”
Оглавление темы “Регуляция бронхиальной проходимости.”:
1. Клеточные и субклеточные механизмы регуляции пролиферативных процессов при воспалении
2. Превращение при воспалении защитных клеточных механизмов в патологические.
3. Системные медиаториые воздействия на клетку при воспалении.
4. Метаболиты арахидоновой кислоты в патогенезе воспаления легких и бронхов.
5. Легочный контроль за образованием и инактивацией эйкозаноидов.
6. Участие простагландинов в воспалительном процессе легких.
7. Аспириновая бронхиальная астма. Механизмы развития аспириновой астмы.
8. Кальций как регулятор бронхиальной проходимости.
9. Роль натрия и калия в регуляции бронхиальной проводимости.
10. Магний в регуляции бронхиальной проходимости.
Источник
Клеточные основы кооперации в иммунных реакциях. Взаимодействие клеток при иммунном ответе.Реактивное свойство организма, которое проявляется на клеточном уровне организации живого и заключается в распозновании “своих и чужих” клеток, обеспечивается Т-лимфоцитами. Молекулярные механизмы “узнавания” заключаются в том, что практически все клетки организма позвоночных экспрессируют молекулу гистосовместимости, которая находится на поверхности клетки и доступна для опознавания специализированными клетками иммунной системы. В связи с тем, что молекула в составе клетки одного организма, будучи внесенная в другой, вызывает реакцию отторжения, она получила название антиген гистосовместимости, или главная молекула гистосовместимости. Последняя бывает двух классов — I и II. Молекула гистосовместимости 1-го класса является гликопротеином. Она состоит из трех частей: а) трансмембранного белка (тяжелой цепи), который пронизывает плазмолемму клетки и имеет внутриклеточную, цитоплазматическую и внеклеточную части (домены); б) белка малой молекулярной массы (эпитопа), расположенного между петлями внеклеточной части трансмембранного белка; в) периферического белка. Гены, кодирующие молекулярную организацию трансмембранного белка, расположены на 6-й хромосоме в области, которая получила название главный комплекс гистосовместимости (англ. — МНС — Major Histocompatibility Complex). Основная биологическая роль молекулы гистосовместимости 1-го класса — дать возможность Т-лимфоцитам с помощью своих Т-клеточных рецепторов распознать “свои и чужие” клетки. Информацию об этом несет разнообразный по составу и последовательности расположения аминокислот низкомолекулярный белок — эпитоп. Это фрагмент, возникший из белков, присутствующих внутри клетки. Среди них могут быть: а) фрагменты собственных белков, тогда они не вызывают ответной реакции со стороны специализированных Т-лимфоцитов; б) молекулы белка, кодируемые вирусом; в) молекулы белка, кодируемые мутантным геномом раковой клетки организма. В случае появления двух последних происходит реакция клетки, несущей чужеродный эпитоп, с Т-лимфоцитом, который называется цитотоксическим.
Цитотоксические лимфоциты имеют рецепторы, с помощью которых осуществляется мониторинг практически всех клеток организма (за исключеним тех, которые отделены специальными гематотканевыми гистионами). Они имеют специфические рецепторы — Т-клеточные, с помощью которых взаимодействуют с эпитопом тканевой клетки, и особые рецепторы, представленные поверхностными гликопротеинами, которые выявляются моноклональными антителами CD8 (от англ. cluster of differentiation по номенклатуре, принятой в иммуноцитохимии рецепторов). Если Т-лимфоциты маркируются моноклональным антителом CD8, то они называются CD8+T-лимфоцитами, цитотоксическими, или киллерами. Последние связываются только с молекулой гистосовместимости 1-го класса. В случае обнаружения чужеродного эпитопа происходит молекулярное взаимодействие в области контакта рецепторов, что является сигналом к запуску механизмов разрушения клетки, синтезирующей чужеродный белок. Это проявляется в секреции в межклеточное пространство белков — перфоринов, которые в виде трансмембранных белков встраиваются в плазмолемму чужеродной клетки, формируют поры, приводящие к нарушению гомеостаза, набуханию и распаду клетки. Кроме того, цитотоксические лимфоциты способны активизировать своими биологически активными веществами ферменты апоптоза как при проникновении их в клетку через поры, так и через рецепторы чужеродной клетки к индукторам апоптоза. Существуют и другие механизмы цитотоксического действия данной субпопуляции лимфоцитов на мишени. В отличие от реакций клеточного типа существует другой тип реакции иммунных клеток, выражающийся в выработке антител в жидкие среды организма. Рецепторная система клеток (макрофагов, В- и Т-лимфоцитов), участвующих в иммунных реакциях данного типа, представлена молекулами гистосовместимости II-го класса. Последняя состоит из двух трансмембранных белков, между петлями которых располагается фрагмент антигена — эпитоп, или антигенная детерминанта. В отличие от описанного выше процесса возникновения эпитопа в составе молекулы гистосовместимости 1-го класса, во втором случае эпитоп появляется как результат двух процессов: а) фагоцитоза антигена макрофагом (антигенпредставляющей клеткой), внутриклеточного взаимодействия антигена с лизосомами макрофага и возврата фрагмента антигена в виде эпитопа на клеточную поверхность; б) рецепторно-опосредованного эндоцитоза В-лимфоцитами растворенного антигена, его модификации и возврата в виде эпитопа на клеточную поверхность. Следовательно, принципиальные отличия в организации молекулы гистосовместимости II-го класса заключаются в том, что не все клетки синтезируют данный класс молекул, а эпитоп имеет внеклеточное происхождение. С молекулой II-го класса могут взаимодействовать только те лимфоциты, которые имеют на своей поверхности другой — специальный рецептор класса CD4. К ним относятся СD+4Т-лимфоциты, или Т-хелперы. Последние вместе с антигенп-редставляющими клетками и В-лимфоцитами отвечают за формирования иммунной реакции, которая проявляется в синтезе иммуноглобулинов, или антител, циркулирующих в крови и тканевой жидкости (гуморальный иммунитет). Межклеточные взаимодействия протекают следующим образом. Т-хелпер с помощью двух своих рецепторов — Т-клеточного (молекулы II-го класса) и CD4 связывается с молекулой II-го класса гистосовместимости макрофага (антигенпредставляющей клетки). Если Т-клеточный рецептор с одной стороны и эпитоп молекулы II-го класса макрофага с другой стороны не комплементарны, то происходит активация и пролиферации Т-хелпера. Аналогично происходит взаимодействие хелпера с В-лимфоцитом. Если эпитоп молекулы II-го класса В-лимфоцита не соответствует Т-клеточному рецептору хелпера, то последний вырабатывает лимфокины, которые вызывают пролиферацию и дифференцировку В-лимфоцита в плазматические клетки. Последние специализированы на синтезе в большом количестве клеточных рецепторов к конкретному антигену и секреции рецепторов в виде иммуноглобулинов в кровь, лимфу, тканевую жидкость. В свою очередь рецепторы связывают циркулирующие в жидкостях организма антигены, предупреждают дальнейшее развитие заболевания. Итак, иммуноглобулины — это секретируемые плазматическими клетками клеточные рецепторы к определенным антигенам. СD4+Т-лимфоциты называются помощниками (хелперами), так как без их участия невозможна активация, пролиферация и дифференцировка В-лимфоцитов в плазматические клетки. Таким образом, иммунный комплекс органов действует как целое. Благодаря взаимодействию с эндокринной, нервной системами и местными факторами регуляции, происходит пролиферация и дифференцировка лимфоидных клеток, упорядоченная их миграция, осуществляемая через кровь и лимфу. Медленная миграция клеток характерна для стволовых клеток, Т- и В-лимфоцитов, заселяющих периферические органы иммуногенеза. Быстрая миграция характерна для рециркулирующих долгоживущих лимфоцитов памяти. Количество рециркулирующих клеток составляет 1010. Они мигрируют из крови в периферические органы иммуногенеза и обратно. Рециркуляция Т-лимфоцитов обеспечивает поддержание иммунного гомеостаза. – Также рекомендуем “Эндокринный комплекс органов. Гормоны.” Оглавление темы “Эндокринная патология.”: |
Источник
МЕЖКЛЕ́ТОЧНЫЕ ВЗАИМОДЕ́ЙСТВИЯ, процессы, обеспечивающие формирование тканей и обмен информацией между клетками, необходимый для интеграции их функций. Совр. знания о М. в. основаны гл. обр. на данных, полученных с помощью культуры клеток; наиболее изучены у животных. Различают контактные и гуморально-опосредованные межклеточные взаимодействия.
Контактные М. в. в многоклеточных организмах осуществляются с участием белков поверхности клеток (взаимно комплементарных или идентичных), обеспечивающих их адгезию. К белкам адгезии относят: кадгерины, активность которых проявляется в присутствии ионов Са2+; селектины, взаимодействующие с углеводными структурами клеточной поверхности; интегрины, связывающие рецепторные молекулы поверхности клеток или белки межклеточного матрикса, и ряд др. групп белковых молекул. В наибольшей степени сигнальная функция присуща интегринам. Они способны передавать информацию как с поверхности внутрь клетки, так и в обратном направлении. Часть интегринов цитоплазмы клеток связана с белками цитоскелета и сигнальными ферментами (протеинкиназами). При участии интегринов эти белки концентрируются в зонах контакта клеток с внеклеточным матриксом и др. клетками (фокальные контакты), что обусловливает изменение формы и функциональных свойств клетки и активацию ряда генов. Участие цитоскелета обеспечивает большую прочность межклеточных соединений, что особенно важно для клеточных пластов, подвергающихся механич. нагрузкам (напр., покровного эпителия или эндотелия артерий).
Контактные М. в. играют ключевую роль в процессах эмбрионального гистогенеза; во взрослом организме они важны прежде всего для поддержания тканевого гомеостаза. Присутствие на плазматич. мембране разл. белков адгезии и способность клеток регулировать их количество и активность позволяют им избирательно взаимодействовать с клетками определённых типов, перемещаться на поверхности внеклеточного матрикса или прикрепляться к нему. Интегрины и связанные с ними сигнальные молекулы участвуют в реализации феномена контактного ингибирования – торможения клеточного деления при контактах клеток между собой. В норме этот механизм обеспечивает контроль за численностью клеток в морфологич. структурах и органах. Его нарушение в раковых клетках обусловливает неограниченный рост опухолей. Межклеточная адгезия (слипание) тромбоцитов, обусловленная интегринами, лежит в основе ограничения кровотечения (гемостаза).
Гуморально-опосредованные М. в. обусловлены секрецией клетками химич. веществ – медиаторов, которые действуют на специфич. рецепторы клеток-мишеней, вызывая определённые реакции этих клеток. Медиаторы М. в. разделяют на близкодействующие и дальнодействующие. Близкодействующие медиаторы быстро утилизируются или разрушаются и воздействуют лишь на клетки ближайшего окружения. К ним относят нервные медиаторы, цитокины и ростовые факторы, т. е. медиаторы, обеспечивающие локальный контроль гистогенеза, кроветворения, иммунного ответа, а также нервную регуляцию физиологич. функций. Дальнодействующие медиаторы, гл. обр. гормоны, оказывают действие на клетки-мишени, отдалённые от клеток-продуцентов; они обеспечивают системную регуляцию функций организма и редко рассматриваются в контексте межклеточных взаимодействий.
К числу М. в., в которых сочетаются контактные и гуморальные механизмы, относятся взаимодействия, осуществляемые с помощью межклеточных синапсов. Классич. вариантом последних служат синапсы, которые образуют нервные клетки с клетками-мишенями. Их назначение состоит в обеспечении эффективности химич. сигнализации, в которой участвуют медиаторы, выделяемые нервной клеткой и влияющие на конкретную клетку-мишень. Наряду с нервными синапсами у высших животных образуются т. н. иммунные синапсы – врем. надмолекулярные структуры, формирующиеся при представлении антигена антигенпрезентирующими клетками Т-лимфоцитам. Их функция – оптимизировать распознавание антигена путём сосредоточения в зоне контакта необходимых рецепторных и сигнальных молекул.
Сочетание контактных и гуморально-опосредованных М. в. необходимо для обеспечения миграции клеток в организме, в частности выхода лейкоцитов из сосудистого русла в ткани, который постоянно происходит в норме и резко усиливается при воспалении. При этом контактные М. в., осуществляемые с участием селектинов и интегринов, необходимы для преодоления тканевых и сосудистых барьеров, а также для взаимодействия с внеклеточным матриксом. Направление движения клеток в очаг воспаления определяется разновидностью близкодействующих гуморальных факторов – хемоаттрактантов, которые образуются как патогенными микроорганизмами, так и клетками организма-хозяина. В органах кроветворения и лимфообразования (костный мозг, тимус и др.) межклеточные контакты, а также цитокины и пептидные факторы, выделяемые клетками стромы, поддерживают жизнеспособность, пролиферацию и дифференцировку развивающихся клеток крови. В иммунной системе М. в., осуществляемые с участием молекул адгезии и цитокинов, служат источником вспомогат. стимулов для дифференцировки клеток-эффекторов. Напр., Т-лимфоциты-хелперы оказывают «помощь» В-лимфоцитам, цитотоксич. Т-лимфоцитам и макрофагам в процессе иммунного ответа. Через М. в., как контактные, так и опосредованные гуморальными факторами, реализуется гомеостатич. контроль численности клеток иммунной системы.
Генетич. дефекты, приводящие к ослаблению экспрессии белков адгезии, обычно проявляются в нарушении развития в эмбриональном периоде и приводят к гибели плода. У человека описаны иммунодефициты, связанные с генетически обусловленным недостатком синтеза молекул адгезии. При этих заболеваниях нарушается поступление лейкоцитов в очаги бактериальной инфекции. Одной из причин повышенной кровоточивости у человека является генетич. дефект интегриновых рецепторов тромбоцитов: свёртывание крови замедляется, хотя количество тромбоцитов может оставаться неизменным. См. также Межклеточные соединения.
Источник