Микроциркуляторное русло при воспалении
Нарушение микроциркуляции в очаге воспаления характеризуется изменением тонуса микроциркуляторных сосудов, усиленным током жидкой части крови за пределы сосуда (т.е. экссудацией) и выходом форменных элементов крови (т.е. эмиграцией).
Для сосудистой реакции характерны 4 стадии:
1) кратковременный спазм сосудов,
2) артериальная гиперемия,
3) венозная гиперемия,
4) стаз.
Спазм сосудов возникает при действии повреждающего агента на ткани и связан с тем, что вазоконстрикторы возбуждаются первыми, поскольку они чувствительнее вазодилятаторов. Спазм длится до 40 секунд и быстро сменяется артериальной гиперемией. Артериальная гиперемия формируется следующими тремя путями: а) как результат паралича вазоконстрикторов; б) как результат воздействия медиаторов с сосудорасширяющей активностью; в) как результат реализации аксон-рефлекса.
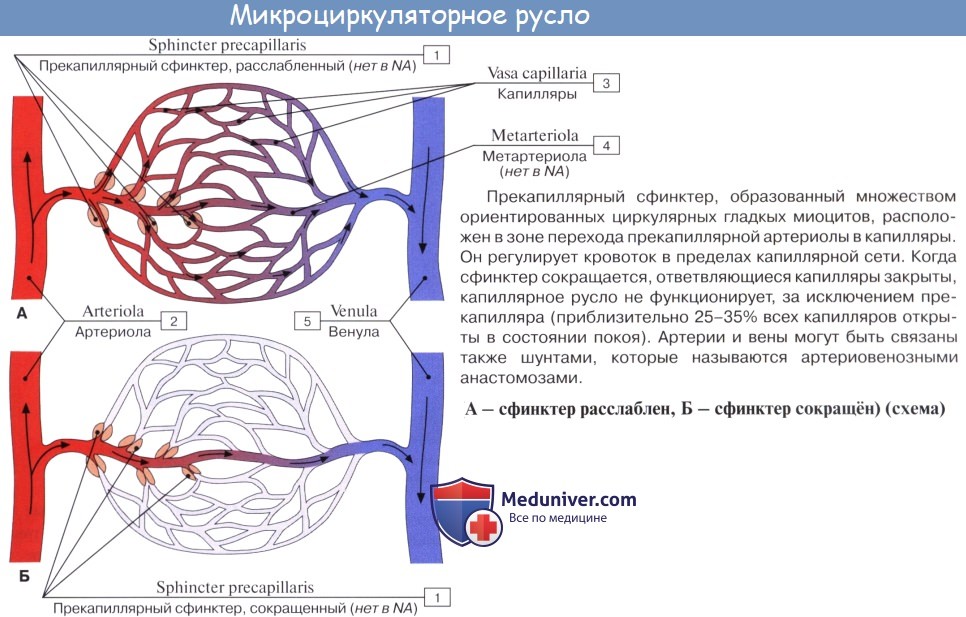
Расслабляются прекапиллярные сфинктеры, увеличивается число функционирующих капилляров и кровоток через сосуды поврежденного участка может в десятки раз превышать таковой неповрежденной ткани.
Расширение микроциркуляторных сосудов, увеличение количества функционирующих капилляров и повышенное кровенаполнение органа определяет первый макроскопический признак воспаления – покраснение. Если воспаление развивается в коже, температура которой ниже температуры притекающей крови, то температура воспаленного участка повышается – возникает жар. Поскольку в первое время после повреждения линейная и объемная скорость кровотока в участке воспаления достаточно велики, то оттекающая из очага воспаления кровь содержит большее количество кислорода и меньшее количество восстановленного гемоглобина и поэтому имеет яркокрасную окраску. Артериальная гиперемия при воспалении сохраняется недолго (от 15 минут до часа) и всегда переходит в венозную гиперемию, при которой увеличенное кровенаполнение органа сочетается с замедлением и даже полным прекращением капиллярного кровотока.
Венозная гиперемия начинается с максимального расширения прекапиллярных сфинктеров, которые становятся нечувствительными к вазоконстрикторным стимулам и венозный отток затрудняется. После этого замедляется ток крови в капиллярах и приносящих артериолах. Главной причиной развития венозной гиперемии является экссудация – выход жидкой части крови из микроциркуляторного русла в окружающую ткань. Экссудация сопровождается повышением вязкости крови, периферическое сопротивление кровотоку возрастает, скорость тока крови падает. Кроме того, экссудат сдавливает венозные сосуды, что затрудняет венозный отток и также усиливает венозную гиперемию. Развитию венозной гиперемии способствует набухание в кислой среде форменных элементов крови, сгущение крови, нарушение десмосом, краевое стояние лейкоцитов, образование микротромбов. Кровоток постепенно замедляется и приобретает новые качественные особенности из-за повышения гидростатического давления в сосудах: кровь начинает двигаться толчкообразно, когда в момент систолы сердца кровь продвигается вперед, а в момент диастолы кровь останавливается. При дальнейшем повышении гидростатического давления кровь в систолу продвигается вперед, а в момент диастолы возвращается обратно – т.е.возникает маятникообразное движение. Толчкообразное и маятникообразное движение крови определяет возникновение пульсирующей боли. Постепенно экссудация вызывает развитие стаза – обычное явление при воспалении. Как правило, стаз возникает в отдельных сосудах венозной части микроциркуляторного русла из-за резкого повышения ее проницаемости. При этом жидкая часть крови быстро переходит во внесосудистое пространство и сосуд остается заполненным массой плотноприлежащих друг к другу форменных элементов крови. Высокая вязкость такой массы делает невозможным продвижение ее по сосудам и возникает стаз. Эритроциты образуют “монетные столбики”, границы между ними постепенно стираются и образуется сплошная масса в просвете сосуда – сладж (от англ. sludge – тина, грязь).
Источник
Оглавление темы “Общая ангиология.”:
1. Общая ангиология. Сосудистая система.
2. Кровеносная система. Артерии. Стенка артерий. Капилляры. Вены.
3. Схема кровообращения. Микроциркуляция. Микроциркуляторное русло.
4. Малый круг кровообращения.
5. Большой (телесный) круг кровообращения. Регионарное кровообращение.
Кровообращение начинается в тканях, где совершается обмен веществ через стенки капилляров (кровеносных и лимфатических).
Капилляры составляют главную часть микроциркуляторного русла, в колюром происходит микроциркуляция крови и лимфы. К микроциркулятор-ному руслу относятся также лимфатические капилляры и интерстициальные пространства.
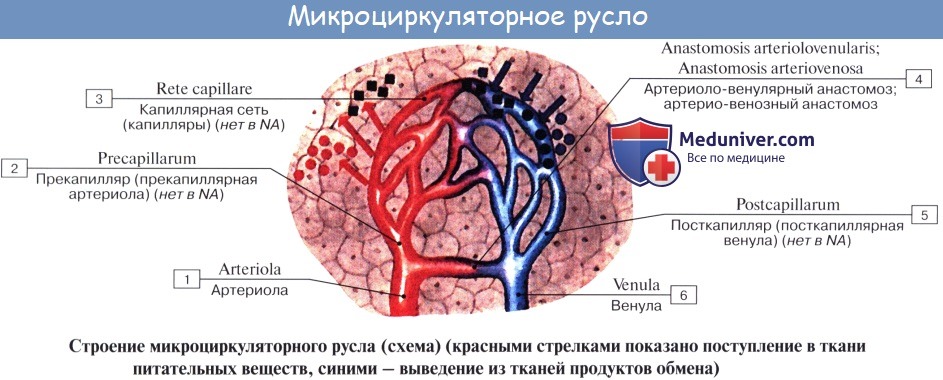
Микроциркуляция — это движение крови и лимфы в микроскопической части сосудистого русла. Микроциркуляторное русло, по В. В. Куприянову, включает 5 звеньев: 1) артериолы как наиболее дистальные звенья артериальной системы, 2) прекапилляры, или прекапиллярные артериолы, являющиеся промежуточным звеном между артериолами и истинными капиллярами; 3) капилляры; 4) посткапилляры, или посткапиллярные венулы, и 5) венулы, являющиеся корнями венозной системы.
Все эти звенья снабжены механизмами, обеспечивающими проницаемость сосудистой стенки и регуляцию кровотока на микроскопическом уровне. Микроциркуляция крови регулируется работой мускулатуры артерий и артериол, а также особых мышечных сфинктеров, существование которых предсказал И. М. Сеченов и назвал их «кранами». Такие сфинктеры находятся в пре- и посткапиллярах. Одни сосуды микроциркуляторного русла (артериолы) выполняют преимущественно распределительную функцию, а остальные (прекапилляры, капилляры, посткапилляры и венулы) — преимущественно трофическую (обменную).
В каждый данный момент функционирует только часть капилляров (открытые капилляры), а другая остается в резерве (закрытые капилляры).
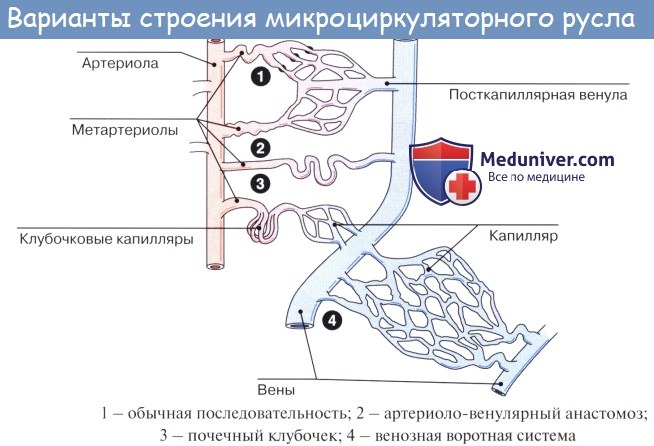
Кроме названных сосудов, советскими анатомами доказана принадлежность к микроциркуляторному руслу артериоловенулярных анастомозов, имеющихся во всех органах и представляющих пути укороченного тока артериальной крови в венозное русло, минуя капилляры. Эти анастомозы подразделяются на истинные анастомозы, или шунты (с запирательными устройствами, способными перекрывать ток крови, и без них), и на межарте-риолы, или полушунты.
Благодаря наличию артериоловенулярных анастомозов терминальный кровоток делится на два пути движения крови: 1) транскапиллярный, служащий для обмена веществ, и 2) необходимый для регуляции гемодинамического равновесия внекапиллярный юкстакапиллярный (от лат. juxta — около, рядом) ток крови; последний совершается благодаря наличию прямых связей (шунтов) между артериями и венами (артериовенозные анастомозы) и артериолами и венулами (артериоловенулярные анастомозы).

Благодаря внекапиллярному кровотоку происходят при необходимости разгрузка капиллярного русла и ускорение транспорта крови в органе или данной области тела. Это как бы особая форма окольного, коллатерального, кровообращения (Куприянов В. В., 1964).
Микроциркуляторное русло представляет не механическую сумму различных сосудов, а сложный анатомо-физиологический комплекс, состоящий из 7 звеньев (5 кровеносных, лимфатического и интерстициального) и обеспечивающий основной жизненно важный процесс организма — обмен веществ. Поэтому В. В. Куприянов рассматривает его как систему микроциркуляции.
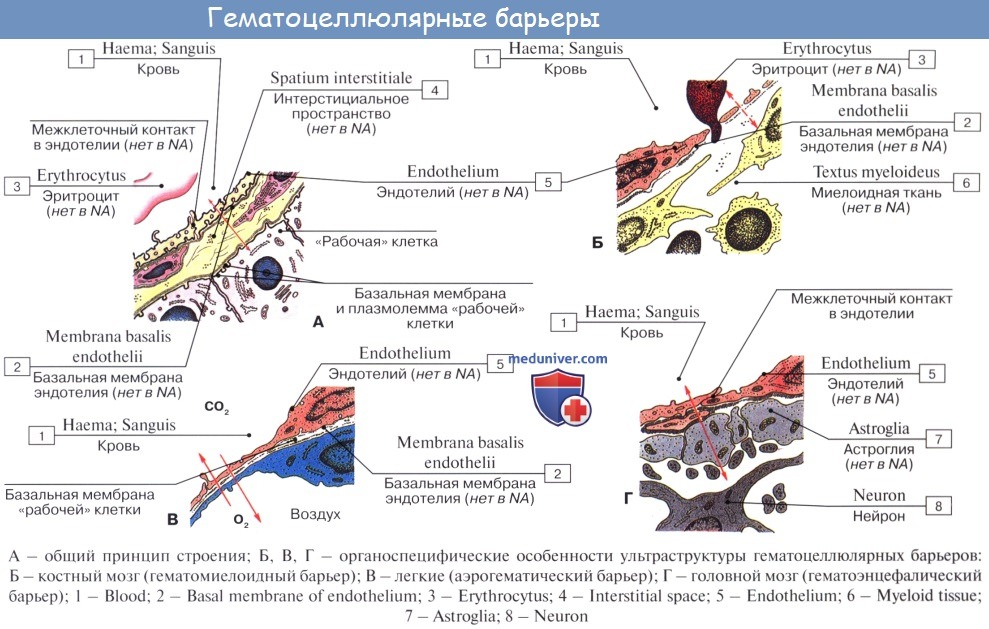
Строение микроциркуляторного русла имеет свои особенности в разных органах, соответствующие их строению и функции. Так, в печени встречаются широкие капилляры — печеночные синусоиды, в которые поступает артериальная и венозная (из воротной вены) кровь. В почках имеются артериальные капиллярные клубочки. Особые синусоиды свойственны костному мозгу и т. п.
Пропесс микроциркуляции жидкости не ограничивается микроскопическими кровеносными сосудами. Организм человека на 70 % состоит из воды, которая содержится в клетках и тканях и составляет основную массу крови и лимфы. Лишь xls всей жидкости находится в сосудах, а остальные 4/5 ее содержатся в плазме клеток и в межклеточной среде. Микроциркуляция жидкости осуществляется, кроме кровеносной системы, также в тканях, в серозных и других полостях и на пути транспорта лимфы.
Из микроциркуляторного русла кровь поступает по венам, а лимфа — по лимфатическим сосудам, которые в конечном счете впадают в присердеч-ные вены. Венозная кровь, содержащая присоединившуюся к ней лимфу, вливается в сердце, сначала в правое предсердие, а из него в правый желудочек. Из последнего венозная кровь поступает в легкие по малому (легочному) кругу кровообращения.
– Также рекомендуем “Малый круг кровообращения.”
Источник
Итак, альтерация тканей и последующее выделение медиаторов являются первой стадией воспаления. Уже на этой стадии очень быстро возникают нарушения местного крово- и лимфообращения, прежде всего со стороны микроциркуляторного русла. Реакция со стороны микроциркуляторного русла играет очень большую роль в патогенезе воспаления. Многие авторы утверждают, что весь «облик воспаления», все его особенности определяются в значительной степени реакцией микроциркуляторного русла, степенью изменения проницаемости сосудов и глубиной их поражения.
Воспаление характеризуется определенной динамикой изменения кровообращения, последовательностью сосудистых реакций (рис. 5.1).
Сначала происходит кратковременный спазм артериол. По данным некоторых авторов, он может длиться от 10—20 с до нескольких минут. Спазм возникает в результате непосредственного воздействия повреждающего агента на сосуды, что приводит к освобождению из поврежденных эндотелиальных клеток и тромбоцитов сосудосуживающих веществ — катехоламинов, лейкотриенов, эндотелинов. В развитии спазма может принимать участие рефлекторное повышение тонуса вазоконстрикторов. Спазм артериол — необязательная реакция, он возникает лишь в тех случаях, когда раздражитель, вызывающий воспаление, действует быстро и сильно.
Рис. 5.1. Изменение кровообращения в очаге воспаления:
1 — спазм сосудов; 2 — артериальная гиперемия (расширение капилляров, увеличение количества функционирующих капилляров); 3 — венозная гиперемия (усиление фильтрации)
Очень быстро спазм сосудов сменяется артериальной гиперемией, когда имеют место расширение артериол и капилляров, увеличение количества функционирующих капилляров, увеличение линейной и объемной скорости кровотока, повышение внутрикапиллярного давления и некоторое усиление процессов фильтрации. В основе развития воспалительной артериальной гиперемии лежат следующие механизмы:
- 1) рефлекторный — активация аксон-рефлекса, местного сосудорасширяющего рефлекса, который реализуется при раздражении чувствительных волокон, участвующих в восприятии боли и высвобождающих при этом сосудорасширяющие пептиды;
- 2) нейропаралитический (в силу пареза вазоконстрикторов в кислой среде происходит инактивация действия катехоламинов);
- 3) миопаралитический (за счет снижения базального тонуса сосудов). Падение базального тонуса обусловлено действием накапливающихся вазоактивных медиаторов воспаления и ионов водорода, которые расслабляют мышечные элементы стенки артериол и прекапилляров. Этот механизм является основным в развитии воспалительной артериальной гиперемии;
- 4) разрушение соединительной ткани вокруг сосудов. Жесткость капилляров в значительной мере (до 93%) определяется окружающей соединительной тканью. Распад соединительной ткани приводит к снижению механического противодействия растягивающему усилию давления крови внутри сосуда.
Активная артериальная гиперемия может продолжаться в течение нескольких часов и суток. Многие внешние признаки воспаления связаны как раз с развитием артериальной гиперемии.
Необходимо отметить одну особенность воспалительной артериальной гиперемии, отличающую ее от гиперемии невоспалительного характера. Эта особенность состоит в том, что капиллярная дилатация при воспалении носит первичный характер, она зависит не столько от притока крови по приносящим артериям, сколько от локальных изменений, происходящих в очаге воспаления. При этом капиллярная дилатация при воспалении более выражена.
По мере нарастания воспалительного процесса артериальная гиперемия сменяется венозной. Венозная гиперемия характеризуется замедлением кровотока, преимущественным расширением капилляров и венул, повышением в них гидростатического давления, резким усилением процессов фильтрации, нарушением реологических свойств крови, феноменом краевого стояния лейкоцитов и их эмиграцией. Факторы, влияющие на переход артериальной гиперемии в венозную, можно разделить на две группы: внутрисосудистые и вне- сосудистые. К внутрисосудистым факторам относятся сгущение крови вследствие перехода части плазмы из крови в воспаленную ткань, набухание эндотелия в кислой среде, пристеночное стояние лейкоцитов, образование микротромбов вследствие агрегации тромбоцитов и увеличения свертываемости крови, снижение сосудистого тонуса. Внесосудистые факторы — это избыточное накопление в очаге воспаления медиаторов воспаления с сосудорасширяющим действием, ионов водорода, сдавление экссудатом стенок вен и лимфатических сосудов, снижение упругости соединительной ткани.
Венозная гиперемия первоначально приводит к развитию престаза — толчкообразному, маятникообразному движению крови «вперед — назад». Во время систолы кровь движется от артерии к венам, во время диастолы — в противоположном направлении, так как кровь встречает препятствие к оттоку по венулам в виде возросшего в них кровяного давления. И наконец, движение крови из-за закупорки сосудов агрегатами клеток или микротромбами полностью прекращается, развивается стаз.
Благодаря венозной гиперемии и стазу в значительной степени ограничивается распространение патогенного агента, и воспаление, таким образом, выполняет свою защитную барьерную функцию.
Источник
Микроциркуляторное русло при болезнях легких.
Исследовав микроциркуляторное русло легких при патологоанатомических вскрытиях умерших больных ХНЗЛ, А.И. Струков и соавт. установили характерные для этой патологии изменения. Отмечены расширенные, извилистые с выбуханием стенок венулы и капилляры, в отдельных местах – стаз крови и рассеянный микротромбоз. Целостность базальной мембраны была нарушена, встречались разрывы сосудов с микрокровоизлияниями. Значительно чаще чем в норме наблюдались артерио-венозные и вено-венозные шунты. Выраженность этих изменений зависела от степени обострения воспалительного процесса в легких и дыхательной недостаточности. На аналогичную количественную связь с воспалительным процессом, гипоксией и гиперкапнией указывают также A.M. Косыгина и Л.Ф. Бриль.
У умерших во время приступа удушья больных бронхиальной астмой наблюдалось полнокровие мелких сосудов, расположенных вблизи от бронхиол, расширение артерио-венозных шунтов, диапедезные кровоизлияния по плевре. Особенности структурной перестройки сосудистой сети легких у этих больных некоторые авторы связывают с аллергическим васкулитом.
Из-за методических трудностей органного исследования микроциркуляции подавляющее большинство работ по изучению больных ХНЗЛ в клинических условиях было выполнено с помощью методики конъюнктивальной бульбомикроскопии, основываясь на том, что имеется достаточно тесное единство основных параметров микроциркуляции для всего организма.
Описываемые с помощью биомикроскопии разными исследователями изменения микрососудистой сети у больных ХНЗЛ во многом повторяют данные, установленные гистологически при патологоанатомических исследованиях.

При воспалительных заболеваниях органов дыхания отмечаются периваскулярный отек, мелкоточечные кровоизлияния, неравномерность калибра сосудов, спазм артериол и расширение венул и капилляров, замедление кровотока, агрегация эритроцитов, снижение кровенаполнения в зоне воспаления. Выраженность этих изменений, в основном количественного характера, отражает у больных ХНЗЛ степень воспалительного процесса, гипоксии и гиперкапнии.
В связи с созданием сцинтилляционной камеры (гамма-камеры) получила распространение методика перфузионной сцинтиграфии с применением макроагрегата альбумина, меченого гамма-излучателем (эмболизирующим радиофармацевтическим препаратом). Внедрение этого метода в практику исследования больных с заболеваниями органов дыхания дало возможность анализировать динамику состояния микрососудистой сети непосредственно в легких и, что было важным, позволило определять регионарные расстройства легочного кровотока. Данный метод был использован для контроля воспалительного процесса в легких, при этом было показано, что он обладает большей информативностью, чем стандартная рентгенография.
Диагностические возможности сцинтиграфии в исследовании легких значительно расширяются при сочетании с рентгенофункциональными методами и, в частности, рентгенопневмополиграфией (РППГ), поскольку такое сочетание позволяет оценить не только регионарный кровоток на уровне капилляров и мелких сосудов легких, но и регионарную вентиляцию. При исследовании указанными методами больных хроническим обструктивным бронхитом (ХОБ) и бронхиальной астмой (БА) В.И. Амосовым были установлены характерные для каждой из нозологических форм особенности изменений. У больных БА выявлена негомогенная гиперинфляция легких: участки с разной степенью вздутия непостоянные, мигрирующие по легким, в которых вследствие выключения альвеолярной вентиляции и микроциркуляции не осуществляется полноценный газообмен.
По мере увеличения тяжести состояния больных на фоне активации воспалительного процесса в бронхиальном дереве нарастала выраженность внутриорганной перестройки легочного кровообращения с возрастанием величины артерио-венозного шунтирования со сбросом крови “справа-налево”. В значительной мере эти измерения носили обратимый характер. Чем быстрее происходила ликвидация регионарных диспропорций вентиляции и кровотока в процессе лечения больных, тем лучшим был общеклинический эффект от выбранной схемы терапии.
При ХОБ (особенно на ранних этапах его развития) были отмечены регионарные зоны эмфизематозной перестройки легочной ткани с превалированием вентиляционных дисфункций, а также зоны “компрессионной ишемии”, где резко преобладали сосудистые нарушения. По мере прогрессирования патологического процесса фактор ишемии приобретал самостоятельное значение в патогенезе заболевания, ускоряя деструктивные изменения альвеолярных перегородок.
Как известно, важнейшим патоморфологическим субстратом при хронической обструктивной болезни легких является формирующаяся эмфизема легких. Экспериментально было установлено, что стойкие микроциркуляторные дисфункции в МКК играют существенную роль в развитии эмфиземы. Уже через 7 дней в ишемизированном участке легочной ткани можно было обнаружить начальные признаки эмфиземы, а к 40-му дню – типичные булезные полости. Несмотря на то, что про-грессирование эмфиземы легких и дыхательной недостаточности при ХОБ зависит от многих факторов (курение, бактериальная и вирусная инфекция, неблагоприятные экологические, наследственные факторы и др.), частота и выраженность обострений хронического воспалительного процесса в легких занимают одно из основных мест в этом процессе.
А если учесть, что в настоящее время имеется достаточно много данных об изменениях в микроциркуляторном кровотоке при обострениях ХОБ, то значение “сосудистого фактора” в патогенезе настоящего заболевания вряд ли может быть переоценено.
– Также рекомендуем “Реологические свойства крови, вязкость крови при болезнях легких.”
Оглавление темы “Сердечно-сосудистая система и рецепторы клеток при воспалении.”:
1. Изменения сердечно-сосудистой системы при пневмонии.
2. Малый круг кровообращения при пневмонии.
3. Микроциркуляторное русло при болезнях легких.
4. Реологические свойства крови, вязкость крови при болезнях легких.
5. Роль сосудистой системы легких в ходе воспаления.
6. Особенности мембрано-рецепторных нарушений при воспалении легких.
7. Изменение активности адренорецепторов при воспалении легких.
8. Снижение адренореактивности при бактериальном воспалении легких.
9. Влияние микроорганизмов на рецепторы клеток при воспалении.
10. Рецепторы клеток в условиях вирусной инфекции.
Источник
