Мононуклеарные клетки при хроническом воспалении
Клетки участвующие в хроническом воспалении – макрофаги и другие клетки
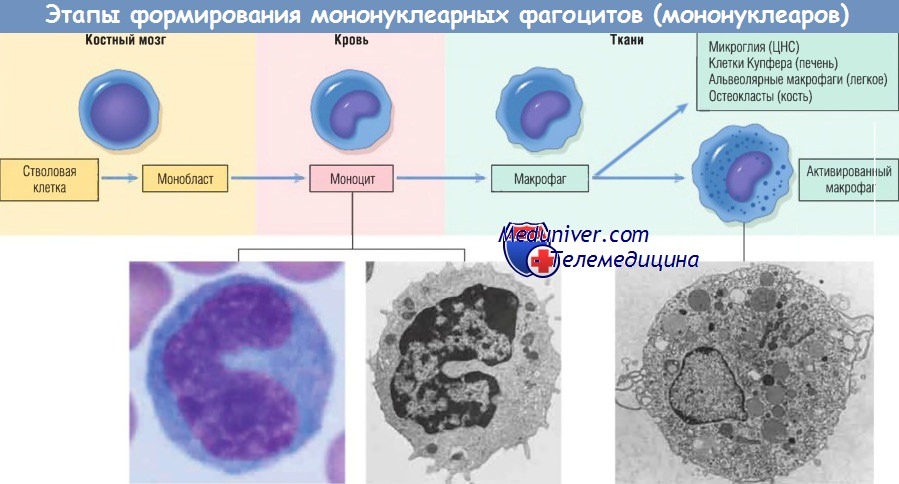
Макрофаг — главная клетка, участвующая в процессе хронического воспаления. Макрофаги являются частью системы мононуклеарных фагоцитов (иногда называемой ретикулоэндотелиальной системой), состоящей из клеток, близкородственных клеткам костного мозга, включая моноциты и тканевые макрофаги.
Тканевые макрофаги диффузно разбросаны по соединительной ткани или расположены в таких органах, как печень (клетки Купфера), селезенка и лимфатические узлы (гистиоциты синусов), легкие (альвеолярные макрофаги), а также в ЦНС (микроглия). Мононуклеарные фагоциты происходят из клеток-предшественников костного мозга, которые дифференцируются в моноциты. Из крови моноциты мигрируют в разные ткани и дифференцируются в макрофаги.
Период полужизни моноцитов длится около 1 дня, когда как период жизни тканевых макрофагов составляет несколько месяцев или лет. Превращение стволовой клетки костного мозга в тканевый макрофаг регулируется различными факторами роста и дифференцировки, цитокинами, молекулами адгезии и клеточными взаимодействиями.
Моноциты начинают мигрировать во внесосудистые ткани на ранних стадиях развития острого воспаления и в течение 48 час могут стать доминирующим типом клеток инфильтрата. Экстравазация моноцитов управляется теми же стимулами, которые участвуют в миграции нейтрофилов и представлены молекулами адгезии и химическими медиаторами с хемотаксическими и активирующими свойствами.
При попадании моноцита во внесосудистую ткань он подвергается трансформации в большую фагоцитарную клетку — макрофаг. Макрофаги активируются различными стимулами, включая микробные продукты, активирующие TLR и другие клеточные рецепторы, цитокины (например, IFN-y), секретированные сенсибилизированными Т-лимфоцитами и естественными клетками-киллерами, и другие химические медиаторы.
В результате активации макрофагов происходят элиминация таких повреждающих агентов, как микробы, и инициация процессов репарации, а также повреждение ткани (при хроническом воспалении).

Активация макрофагов приводит также к повышению уровней лизосомных ферментов и активных форм кислорода и азота, продукции цитокинов, факторов роста и других медиаторов воспаления. Некоторые из этих продуктов токсичны для микробов и организма (например, активные формы кислорода и азота) или ВКМ (протеазы); другие вызывают миграцию клеток (например, цитокины, хемотаксический стимул); третьи влияют на пролиферацию фибробластов, отложение коллагена и ангиогенез (например, факторы роста).
Разные популяции макрофагов выполняют различные функции: некоторые необходимы при киллинге микробов и воспалении, другие очень важны при репарации.
Впечатляющий арсенал медиаторов делает макрофаги мощным союзником организма в защите от непрошеных гостей, но в то же время при неправильной активации макрофаги могут вызывать значительное разрушение ткани, которое является одним из признаков хронического воспаления. Процесс разрушения ткани сам по себе может активировать каскад воспалительной реакции, поэтому одновременно могут присутствовать признаки и острого, и хронического воспаления.
При недолгом процессе воспаления, если стимул удален, макрофаги в итоге либо умирают, либо уходят в лимфатические сосуды и лимфоузлы. При хроническом воспалении происходит накопление макрофагов в результате их мобилизации из кровотока и местной пролиферации в очагах воспаления.
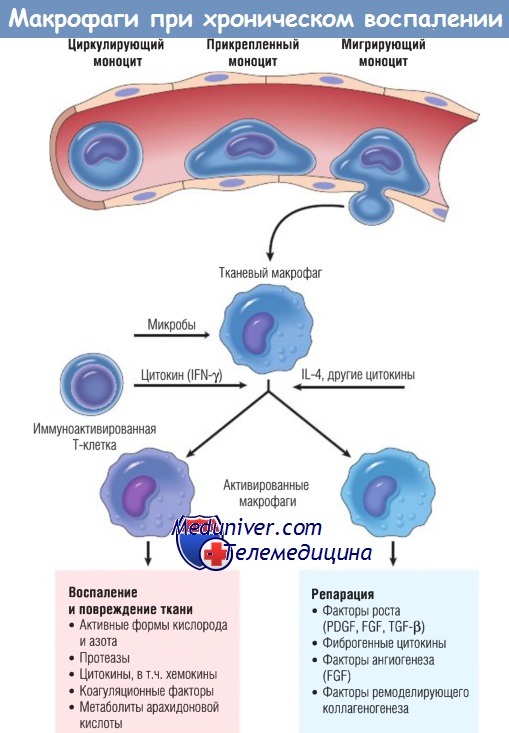
Роль активированных макрофагов при хроническом воспалении.
Макрофаги активируются неиммунными стимулами, например эндотоксином, или цитокинами из иммуноактивированных Т-клеток (особенно IFN-y).
Перечислена продукция активированных макрофагов.
FGF — фактор роста фибробластов; IFN — интерферон; IL — интерлейкин;
PDGF — тромбоцитарный фактор роста; TGF — трансформирующий фактор роста.
В развитии хронического воспаления участвуют и другие типы клеток: лимфоциты, клетки плазмы крови, эозинофилы и тучные клетки:
– лимфоциты мобилизуются в ходе как антителоопосредованных, так и клеточно-опосредованных иммунных реакций. Антиген-стимулированные лимфоциты (эффекторные клетки и клетки памяти) различных типов (Т- и В-клетки) используют разные пары адгезивных молекул (селектинов, интегринов и их лигандов) и хемокины для миграции в очаг воспаления. Цитокины активированных макрофагов, в основном TNF, IL-1 и хемокины, усиливают мобилизацию лейкоцитов, запуская стадию персистенции воспалительной реакции.
Лимфоциты и макрофаги взаимодействуют по реверсивному типу, что играет важную роль в развитии хронического воспаления. Макрофаги презентируют антигены Т-клеткам и продуцируют мембранные молекулы (костимуляторы) и цитокины (например, IL-12), которые стимулируют ответ Т-клеток. Активированные Т-клетки продуцируют цитокины, некоторые из которых мобилизуют моноциты из кровотока, и IFN-y — мощный активатор макрофагов. В результате этих взаимодействий Т-клеток и макрофагов в воспалительную реакцию вовлекается иммунная система, что делает реакцию хронической и тяжелой. Термин «иммунное воспаление» отражает наличие выраженного иммунного компонента в воспалительном процессе, например ответа Т- и В-клеток;
– клетки плазмы крови образуются из активированных В-клеток и продуцируют антитела, направленные либо против персистирующих чужеродных или собственных антигенов в очаге воспаления, либо против компонентов поврежденной ткани. При некоторых сильных воспалительных реакциях скопление лимфоцитов, антигенпрезентирующих клеток и клеток плазмы крови может напоминать морфологическое строение лимфоидного органа, особенно лимфоузла, содержащего хорошо сформированные герминативные центры.
Подобные очаги скопления лимфоцитов называют третичными лимфоидными органами. Такой тип лимфоидного органогенеза часто встречается в синовиальных оболочках у пациентов, длительно страдающих ревматоидным артритом;
– эозинофилами изобилуют иммунные реакции, опосредованные IgE и паразитарными инфекциями. Особо важный хемокин для мобилизации эозинофилов — эотаксин. Эозинофилы содержат гранулы, имеющие главный основной белок (высокоактивный катионный белок), который токсичен для паразитов, но может вызвать лизис эпителиальных клеток млекопитающих. Таким образом, эозинофилы контролируют паразитарные инфекции, но также участвуют в повреждении ткани при иммунных реакциях, например аллергии;
– тучные клетки широко распространены в соединительных тканях по всему телу и могут участвовать как в острых, так и в хронических воспалительных реакциях. Тучные клетки экспрессируют на своей поверхности рецептор FceRI, связывающийся с Fc-фракцией антитела IgE. При реакции гиперчувствительности немедленного типа антитела IgE связываются с клеточными Fc-peцепторами, специфично распознающими антиген, клетка дегранулируется и высвобождает медиаторы — гистамин и простагландины. Этот тип ответа наблюдается при пищевой аллергии, укусах насекомых, лекарственной аллергии, иногда с ужасающими исходами (например, анафилактическим шоком).
Тучные клетки тоже присутствуют при реакциях хронического воспаления и секретируют множество цитокинов, т.е. они способны как усиливать, так и ограничивать воспалительную реакцию в разных ситуациях.
Как правило, присутствие нейтрофилов характерно для острого воспаления, но и при многих формах хронического воспаления, длящегося месяцами, выявляется большое количество нейтрофилов, индуцированных либо персистирующими микробами, либо медиаторами, продуцированными активированными макрофагами и Т-лимфоцитами. При хронических бактериальных инфекциях костей (остеомиелите) нейтрофильный экссудат может сохраняться многие месяцы. Нейтрофилы также важны при хроническом воспалении в легких, индуцированном курением или другим стимулом.
Помимо мононуклеарного характера клеточного инфильтрата при хроническом воспалении часто происходит пролиферация кровеносных и лимфатических сосудов. Этот процесс стимулируют факторы роста, продуцируемые макрофагами и эндотелиальными клетками.
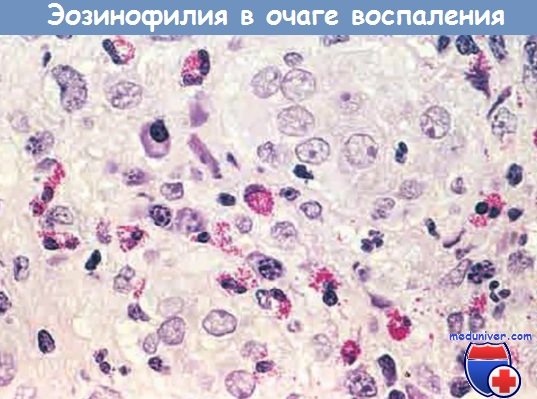
Очаг воспаления с большим количеством эозинофилов (эозинофилия)
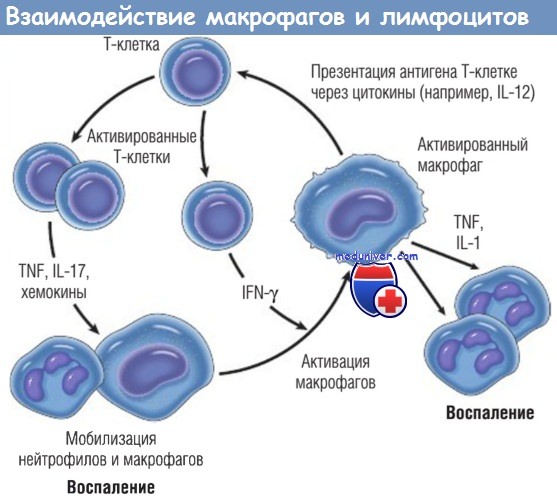
Взаимодействия макрофагов и лимфоцитов при хроническом воспалении.
Активированные Т-клетки продуцируют цитокины, которые мобилизуют макрофаги (TNF, IL-17, хемокины), и IFN-y, который является мощным активатором макрофагов.
Разные типы Т-клеток (Тh1 и Тh17) могут продуцировать различные типы цитокинов.
В свою очередь, активированные макрофаги стимулируют Т-клетки, презентируя им антигены через цитокины (например, IL-12).
IFN — интерферон; IL — интерлейкин; TNF — фактор некроза опухоли.
– Рекомендуем ознакомиться со следующей статьей “Причины и механизмы гранулематозного воспаления. Что такое гранулема?”
Оглавление темы “Патофизиология”:
- Клетки участвующие в хроническом воспалении – макрофаги и другие клетки
- Причины и механизмы гранулематозного воспаления. Что такое гранулема?
- Влияние воспаления на организм в целом (системные симптомы воспаления)
- Варианты воспалительной реакции и ее последствия
- Пути заживления и обновления тканей – репарация, регенерация
- Регуляция деления и пролиферации клеток в тканях
- Виды стволовых клеток и их характеристика
- Эмбриональные стволовые клетки и их характеристика
- Индуцированные плюрипотентные стволовые клетки (ИПСК) и их характеристика
- Где присутствуют стволовые клетки у взрослых?
Источник
Инфекционный мононуклеоз (иначе называемый доброкачественным лимфобластозом, болезнью Филатова) представляет собой острую вирусную инфекцию, характеризующуюся преимущественным поражением ротоглотки и лимфоузлов, селезенки и печени. Специфическим признаком заболевания является появление в крови характерных клеток – атипичных мононуклеаров. Возбудителем инфекционного мононуклеоза является вирус Эпштейна-Барр, относящийся к семейству герпесвирусов. Его передача от больного осуществляется аэрозольным путем. Типичными симптомами инфекционного мононуклеоза выступают общеинфекционные явления, ангина, полиаденопатия, гепатоспленомегалия; возможны пятнисто-папулезные высыпания на различных участках кожи.
Общие сведения
Инфекционный мононуклеоз (иначе называемый доброкачественным лимфобластозом, болезнью Филатова) представляет собой острую вирусную инфекцию, характеризующуюся преимущественным поражением ротоглотки и лимфоузлов, селезенки и печени. Специфическим признаком заболевания является появление в крови характерных клеток – атипичных мононуклеаров. Распространение инфекции – повсеместное, сезонность не выявлена, отмечается повышенная заболеваемость в пубертатный период (девушки 14-16 лет и юноши 16-18 лет). Заболеваемость после 40 лет крайне редка, исключение составляют ВИЧ-инфицированные лица, у которых может развиться манифестация латентно существующей инфекции в любом возрасте. В случае заражения вирусом в раннем детском возрасте заболевание протекает по типу острой респираторной инфекции, в более старшем возрасте – без выраженной симптоматики. У взрослых клиническое течение заболевания практически не отмечается, поскольку у большинства к 30-35 годам сформирован специфический иммунитет.
Причины
Инфекционный мононуклеоз вызывается вирусом Эпштейна-Барр (ДНК-содержащий вирус рода Lymphocryptovirus). Вирус относится к семейству герпесвирусов, но в отличие от них не вызывает гибели клетки-хозяина (вирус преимущественно размножается в В-лимфоцитах), а стимулирует ее рост. Помимо инфекционного мононуклеоза вирус Эпштейна-Барр вызывает лимфому Беркитта и карциному носоглотки.
Резервуаром и источником инфекции является больной человек или носитель инфекции. Выделение вируса больными людьми происходит, начиная с последних дней инкубационного периода, и продолжается 6-18 месяцев. Вирус выделяется со слюной. У 15-25 % здоровых людей с положительным тестом на специфические антитела возбудитель обнаруживается в смывах из ротоглотки.
Механизм передачи вируса Эпштейна-Барр – аэрозольный, преимущественный путь передачи – воздушно-капельный, возможна реализация контактным путем (поцелуи, половые контакты, грязные руки, посуда, предметы быта). Кроме того, вирус может быть передан при переливании крови и интранатально от матери к ребенку. Люди обладают высокой естественной восприимчивостью к инфекции, но при заражении преимущественно развиваются легкие и стертые клинические формы. Незначительная заболеваемость среди детей до года говорит об имеющем место врожденном пассивном иммунитете. Тяжелому течению и генерализации инфекции способствует иммунодефицит.
Патогенез
Вирус Эпштейна-Барр вдыхается человеком и поражает клетки эпителия верхних дыхательных путей, ротоглотки (способствуя развитию умеренного воспаления в слизистой оболочке), оттуда возбудитель с током лимфы попадает в регионарные лимфоузлы, вызывая лимфаденит. При попадании в кровь вирус внедряется в В-лимфоциты, где начинает активную репликацию. Поражение В-лимфоцитов приводит к формированию специфических иммунных реакций, патологической деформации клеток. С током крови возбудитель распространяется по организму. В связи с тем, что внедрение вируса происходит в иммунные клетки и значимую роль в патогенезе играют иммунные процессы, заболевание относят в СПИД-ассоциированным. Вирус Эпштейна-Барр сохраняется в организме человека на всю жизнь, периодически активируясь на фоне общего снижения иммунитета.
Симптомы инфекционного мононуклеоза
Инкубационный период колеблется в широких пределах: от 5 дней до полутора месяцев. Иногда могут отмечаться неспецифические продромальные явления (слабость, недомогание, катаральные симптомы). В таких случаях идет постепенное нарастание симптоматики, недомогание усиливается, температура поднимается до субфебрильных значений, отмечается заложенность носа, першение в горле. При осмотре выявляется гиперемия слизистой ротоглотки, миндалины могут быть увеличены.
В случае острого начала заболевания развивается лихорадка, озноб, повышение потоотделения, отмечается симптоматика интоксикации (ломота в мышцах, головная боль), больные жалуются на боль в горле при глотании. Лихорадка может сохраняться от нескольких дней до месяца, течение (тип лихорадки) может приобретать различное.
Спустя неделю заболевание обычно переходит в фазу разгара: проявляется вся основная клиническая симптоматика (общая интоксикация, ангина, лимфоаденопатия, гепатоспленомегалия). Состояние больного обычно ухудшается (усугубляются симптомы общей интоксикации), в горле характерная картина катаральной, язвенно-некротической, пленчатой или фолликулярной ангины: интенсивная гиперемия слизистой оболочки миндалин, желтоватые, рыхлые налеты (иногда по типу дифтерийных). Гиперемия и зернистость задней стенки глотки, фолликулярная гиперплазия, возможны кровоизлияния слизистой.
В первые же дни заболевания возникает полиаденопатия. Увеличение лимфоузлов возможно обнаружить практически в любой доступной для пальпаторного исследования группе, чаще всего поражаются затылочные, заднешейные и подчелюстные узлы. На ощупь лимфоузлы плотные, подвижные, безболезненные (либо болезненность выражена слабо). Иногда может отмечаться умеренный отек окружающей клетчатки.
В разгар заболевания у большинства больных развивается гепатолиенальный синдром – печень и селезенка увеличены, может проявляться желтушность склер, кожных покровов, диспепсия, потемнение мочи. В некоторых случаях отмечаются пятнисто-папулезные высыпания разнообразной локализации. Сыпь кратковременная, не сопровождается субъективными ощущениями (зуд, жжение) и не оставляет после себя каких-либо остаточных явлений.
Разгар заболевания занимает обычно около 2-3 недель, после чего происходит постепенное стихание клинической симптоматики и наступает период реконвалесценции. Температура тела нормализуется, признаки ангины исчезают, печень и селезенка возвращаются к своему нормальному размеру. В некоторых случаях в течение нескольких недель могут сохраняться признаки аденопатии и субфебрилитет.
Инфекционный мононуклеоз может приобретать хроническое рецидивирующее течение, в результате чего продолжительность заболевания увеличивается до полутора и более лет. Течение мононуклеоза у взрослых обычно постепенное, с продромальным периодом и меньшей выраженностью клинической симптоматики. Лихорадка редко продолжается более 2 недель, лимфоаденопатия и гиперплазия миндалин выражена слабо, однако чаще отмечаются симптомы, связанные с функциональным расстройством работы печени (желтуха, диспепсия).
Осложнения
Осложнения инфекционного мононуклеоза преимущественно связаны с развитием присоединившейся вторичной инфекции (стафилококковые и стрептококковые поражения). Может возникнуть менингоэнцефалит, обструкция верхних дыхательных путей гипертрофированными миндалинами. У детей может отмечаться тяжелый гепатит, иногда (редко) формируется интерстициальная двусторонняя инфильтрация легких. Также к редким осложнениям относят тромбоцитопению, перерастяжка лиенальной капсулы может спровоцировать разрыв селезенки.
Диагностика
Неспецифическая лабораторная диагностика включает тщательное исследование клеточного состава крови. Общий анализ крови показывает умеренный лейкоцитоз с преобладанием лимфоцитов и моноцитов и относительной нейтропенией, сдвиг лейкоцитарной формулы влево. В крови появляются крупные клетки разнообразной формы с широкой базофильной цитоплазмой – атипичные мононуклеары. Для диагностики мононуклеоза значимо увеличение содержания этих клеток в крови до 10-12%, нередко их количество превышает 80% всех элементов белой крови. При исследовании крови в первые дни мононуклеары могут отсутствовать, что, однако, не исключает диагноз. Иногда формирование этих клеток может занимать 2-3 недели. Картина крови обычно постепенно приходит в норму в периоде реконвалесценции, при этом атипичные мононуклеары нередко сохраняются.
Специфическая вирусологическая диагностика не применяется в силу трудоемкости и нерациональности, хотя возможно выделить вирус в смыве из ротоглотки и идентифицировать его ДНК с помощью ПЦР. Существуют серологические методы диагностики: выявляются антитела к VCA- антигенам вируса Эпштейна-Барр. Сывороточные иммуноглобулины типа М нередко определяются еще в период инкубации, а в разгар заболевания отмечаются у всех больных и исчезают не ранее 2-3 дней после выздоровления. Выявление этих антител служит достаточным диагностическим критерием инфекционного мононуклеоза. После перенесения инфекции в крови присутствуют специфические иммуноглобулины G, сохраняющиеся пожизненно.
Больные инфекционным мононуклеозом (или лица с подозрением на эту инфекцию) подвергаются трехкратному (в первый раз – в период острой инфекции, и с интервалом в три месяца – еще дважды) серологическому исследованию на предмет выявления ВИЧ-инфекции, поскольку при ней также может отмечаться наличие мононуклеаров в крови. Для дифференциальной диагностики ангины при инфекционном мононуклеозе от ангин другой этиологии необходима консультация отоларинголога и проведение фарингоскопии.
Лечение инфекционного мононуклеоза
Инфекционный мононуклеоз легкого и среднетяжелого течения лечится амбулаторно, постельный режим рекомендован в случае выраженной интоксикации, тяжелой лихорадки. При имеющих место признаках нарушения функции печени, назначается диета №5 по Певзнеру.
Этиотропное лечение в настоящее время отсутствует, комплекс показанных мероприятий включает дезинтоксикационную, десенсибилизационную, общеукрепляющую терапию и симптоматические средства в зависимости от имеющейся клиники. Тяжелое гипертоксическое течение, угроза асфиксии при пережатии гортани гиперплазированными миндалинами являются показанием к кратковременному назначению преднизолона.
Антибиотикотерапия назначается при некротизирующих процессах в зеве с целью подавления местной бактериальной флоры и профилактики вторичных бактериальных инфекций, а также в случае имеющихся осложнений (вторичные пневмонии и др.). В качестве препаратов выбора назначают пенициллины, ампициллин и оксациллин, антибиотики тетрациклинового ряда. Сульфаниламидные препараты и хлорамфеникол противопоказаны ввиду побочного угнетающего действия на кроветворную систему. Разрыв селезенки является показанием к экстренной спленэктомии.
Прогноз и профилактика
Неосложненный инфекционный мононуклеоз имеет благоприятный прогноз, опасные осложнения, способные его значительно усугубить, при этом заболевании возникают достаточно редко. Имеющие место остаточные явления в крови являются поводом к диспансерному наблюдению в течение 6-12 месяцев.
Профилактические мероприятия, направленные на снижение заболеваемости инфекционным мононуклеозом, сходны с таковыми при острых респираторных инфекционных заболеваниях, индивидуальные меры неспецифической профилактики заключаются в повышении иммунитета, как с помощью общих оздоровительных мероприятий, так и с применением мягких иммунорегуляторов и адаптогенов при отсутствии противопоказаний. Специфическая профилактика (вакцинация) для мононуклеоза не разработана. Меры экстренной профилактики применяются по отношению к детям, общавшимся с больным, заключаются в назначении специфического иммуноглобулина. В очаге заболевания производится тщательная влажная уборка, личные вещи подвергаются дезинфекции.
Источник
