Недоношенный ребенок воспаление кишечника
Некротический энтероколит новорожденных (НЭК) – это неспецифическое заболевание воспалительного характера, которое вызывается инфекционными агентами на фоне повреждения слизистой оболочки кишечника или ее функциональной незрелости. Симптомы включают соматические реакции и абдоминальные проявления. При длительном течении наблюдаются признаки перфорации кишечника и клиника перитонита. Диагностика НЭК сводится к физикальному обследованию, оценке симптомов по шкале Walsh и Kliegman и рентгенографии. Лечение зависит от стадии заболевания, может быть как консервативным, так и хирургическим.
Общие сведения
Некротический энтероколит новорожденных или «болезнь выживших недоношенных» – это гетерогенная патология, которая характеризуется развитием язв и некрозов стенки кишечника с дальнейшей перфорацией. Более 90% больных детей – недоношенные, с массой тела до 1500г. Общая заболеваемость составляет 0,5-3 на 1000 новорожденных. Прогноз, как правило, неясен, т. к. для НЭК характерно резкое ухудшение состояния на фоне мнимого благополучия. Часто требуется хирургическое вмешательство. Летальность в зависимости от формы колеблется от 25 до 55%. Даже после успешного проведения операции показатель смертности составляет свыше 60%. При условии выживания ребенка наблюдается тяжелый период реабилитации, остается высокий риск послеоперационных осложнений.

Некротический энтероколит новорожденных
Причины НЭК новорожденных
Некротический энтероколит новорожденных – полиэтиологическое заболевание. Основными патогенетическими факторами являются гипоксия и ишемия в перинатальном периоде, нерациональное питание новорожденного и заселение кишечника аномальными микроорганизмами. К способствующим факторам относятся преждевременные роды, эклампсия, травмы ЦНС при родах, иммунодефицитные состояния у ребенка, аномалии развития кишечника, отягощенный семейный анамнез.
Ишемия кишечника может быть обусловлена внутриутробной асфиксией плода, при которой наблюдается централизация кровообращения, постановкой катетера в пупочную артерию, влекущей за собой спазм артерий и их тромбоэмболию, явлением «сгущения крови» и артериальной гипотензией, при которых нарушается ток крови и поступление питательных веществ. К алиментарным причинам развития некротического энтероколита новорожденных относят питание ребенка искусственными смесями и их резкую смену, использование гипертонических растворов, повреждающих слизистую оболочку кишечника, врожденную непереносимость молока, непосредственную инвазию патогенных агентов через ЖКТ. Наиболее часто причиной НЭК становятся Kl. pneumonia, E. coli, клостридии, стафилококки, стрептококки и грибы рода Candida.
Классификация НЭК новорожденных
По скорости развития выделяют следующие формы некротического энтероколита новорожденных:
- Молниеносная. Перфорация стенки кишечника возникает на протяжении 36-48 часов после проявления первых симптомов – незначительного нарушения общего состояния ребенка. Характерна для доношенных детей с аномалиями развития ЖКТ (гастрошизис), гемолитической анемией, травмами ЦНС.
- Острая. Дебют характеризуется абдоминальными симптомами. Как правило, спустя 8-16 часов присоединяются соматические проявления, резко ухудшается общее состояние ребенка. Без соответствующего лечения НЭК быстро переходит в 3 стадию. Наблюдается у детей с массой тела при рождении свыше 1500 г.
- Подострая. Первичные абдоминальные проявления имеют перемежающийся характер, возникают поэтапно. Соматические расстройства развиваются медленно. Для этой формы характерно рецидивирующее течение. Обычно возникает у глубоко недоношенных детей с массой тела менее 1500 г.
В зависимости от массивности поражения различают следующие варианты НЭК:
- Локальный. Патологические изменения наблюдаются на ограниченном отрезке кишечника.
- Полисегментарный. Характерно поражение сразу нескольких участков.
- Паннекроз или тотальный. В патологический процесс втягивается весь кишечник.
Симптомы и осложнения НЭК новорожденных
Некротический энтероколит новорожденных может возникать в первые 24 часа после родов (ранняя форма) или после 1 месяца жизни (поздняя форма), средний возраст детей на момент появления симптомов – 1-2 недели. Все проявления данной патологии можно разделить на 3 группы: соматические, абдоминальные, генерализованные. Первыми, как правило, появляются абдоминальные симптомы, которые почти сразу дополняются соматическими. Генерализованные проявления НЭК отмечаются при прогрессировании заболевания и возникновении перфорации кишечника, что, в зависимости от формы, может происходить через 1-3 дня.
В группу соматических симптомов входят патологические реакции организма на развитие НЭК: приступы апноэ, респираторный дистресс, олигурия, ухудшение микроциркуляции (позитивный симптом «белого пятна»). К абдоминальным признакам НЭК относятся симптомы раздражения брюшной полости и дисфункция ЖКТ: потеря аппетита, метеоризм, рвота желчью и кровью, отсутствие перистальтических шумов, мелена, асцит, покраснение кожи, отечность подкожной жировой клетчатки и резкое напряжение мышц передней брюшной стенки. Нарушения в организме ребенка, возникшие в результате прогрессирования некротического энтероколита новорожденных, объединяют в группу генерализованных проявлений. Сюда входят гипертермия, переходящая в гипотермию, артериальная гипотония, бледность и диффузный цианоз, выраженная вялость и сонливость, ДВС-синдром, дыхательная и сердечно-сосудистая недостаточность.
Большинство осложнений некротического энтероколита новорожденных, как правило, развиваются после проведенного хирургического лечения. Наиболее часто после оперативного вмешательства возникает кишечный свищ, синдром «укороченной кишки», хроническая диарея, демпинг-синдром, обезвоживание, синдром мальабсорбции, стриктура толстого кишечника, абсцесс, задержка физического развития. Также при НЭК могут встречаться патологические состояния, вызванные полным парентеральным питанием: дефицит витамина D (рахит), поражение печени (гепатит) и костей (деминерализация).
Диагностика НЭК новорожденных
Диагностика некротического энтероколита новорожденных включает в себя сбор анамнеза, клиническое, лабораторное и инструментальное обследование. Анамнестические данные могут помочь педиатру и детскому хирургу установить возможную этиологию, проследить за динамикой заболевания. При объективном осмотре выявляются присутствующие на данный момент клинические симптомы – абдоминальные, соматические и генерализованные проявления. Специфических лабораторных тестов для подтверждения НЭК не существует. Информативными являются следующие данные, полученные при проведении лабораторных исследований: лейкоцитоз со сдвигом формулы влево, лейкопения и тромбоцитопения в ОАК, ацидоз и гипоксемия при определении газового состава крови, гиперкалиемия и гипонатриемия в электролитном спектре, диспротеинемия и выявления С-реактивного протеина в белковом спектре, обнаружение крови в кале при пробе Грегерсена. С целью выявления инфекционного возбудителя проводится бактериальный посев, ИФА и ПЦР.
Ведущую роль в диагностике некротического энтероколита новорожденных играют инструментальные методы: рентгенография, УЗИ, КТ и МРТ. Они дают возможность визуализировать отек стенок кишечного тракта, плюс-ткань, наличие воздуха в брюшной полости, в просвете портальной или печеночной вен, а также отсутствие перистальтики на серии последовательных снимков. В педиатрии для подтверждения диагноза «некротический энтероколит новорожденных» и определения стадии заболевания применяется шкала Walsh и Kliegman. При использовании данной шкалы учитываются присутствующие у ребенка соматические симптомы, проявления со стороны желудочно-кишечного тракта и рентгенологические признаки. В зависимости от количества и выраженности проявлений выделяют подозреваемый НЭК (1а и 2а ст.), явный НЭК (2а и 2б ст.), прогрессирующий НЭК (3а и 3б ст.). Это имеет существенное значение при выборе тактики лечения.
Дифференциальная диагностика некротического энтероколита новорожденных проводится с такими патологиями как неонатальный сепсис, пневмония, пневмоперитонеум, кишечная непроходимость различного генеза, аппендицит новорожденного, бактериальный перитонит и спонтанная перфорация кишечника.
Лечение НЭК новорожденных
Тактика лечения некротического энтероколита новорожденных зависит от тяжести состояния ребенка и стадии заболевания. Детям с 1а, 1б и 2а стадиями показана консервативная терапия. С момента постановки диагноза отменяется энтеральное питание и проводится постановка назо- или орогастрального зонда с целью декомпрессии. Ребенок переводится на полное парентеральное питание (TPN) в соответствии с клиническими протоколами. Параллельно назначаются антибактериальные препараты из групп пенициллинов (ампициллин) и аминогликозидов II поколения (гентамицин) в комбинации с медикаментами, действующими на анаэробную микрофлору (метронидазол). При неэффективности выбранной антибиотикотерапии применяют цефалоспорины III-IV поколения (цефтриаксон) в сочетании с аминогликозидами III поколения (амикацин). Таким детям рекомендованы пробиотики и эубиотики для нормализации кишечной микрофлоры. Также проводят СВЧ-терапию, вводят иммуномодуляторы и гамма-глобулины.
Детям с 2б, 3а и 3б стадиями показано хирургическое вмешательство. Объем операции зависит от распространенности поражения кишечника. Как правило, проводится экономная резекция пораженного участка с формированием энтеростомы или колостомы. При локальных формах НЭК возможно наложение анастомоза по типу «конец в конец». После операции назначается инфузионная терапия и медикаментозное лечение, аналогичное более ранним стадиям.
Прогноз и профилактика НЭК новорожденных
Исход НЭК зависит от тяжести общего состояния ребенка и стадии заболевания. Так как данные показатели почти всегда отличаются нестабильностью, прогноз считается сомнительным даже на фоне полноценного лечения. Профилактика некротического энтероколита новорожденных включает в себя антенатальную охрану здоровья плода, рациональное ведение беременности, грудное вскармливание в физиологических объемах. Согласно некоторым исследованиям, риск развития заболевания снижается при использовании эубиотиков, пробиотиков и IgA у детей из группы риска. При высоком риске преждевременных родов применяют глюкокортикостероиды с целью профилактики РДС.
Источник
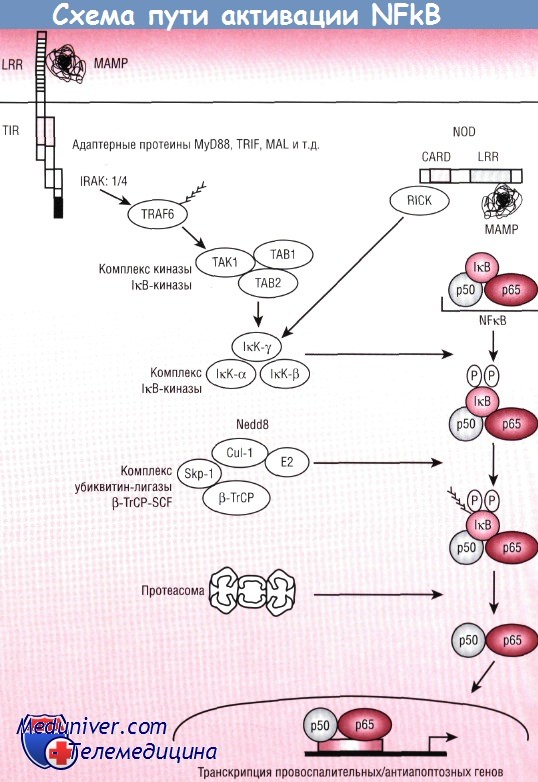
Состояние воспалительной реакции кишечника у недоношенных новорожденных детейОбсуждая защитные механизмы кишечника новорожденного, следует иметь в виду, что пищеварительный тракт ребенка во внутриутробном периоде не подвергается воздействию МАМР. Контакт с ними начинается с момента рождения, когда происходит заселение нормальной микрофлорой. Предварительные исследования показывают, что у плодов до 20 нед гестации в кишечных криптах определяется экспрессия TLR2 и TLR4. Тем не менее очень мало информации о функционировании врожденных иммунных сигнальных путей во время пре- и постнатального развития in vivo. Есть интересное предположение, что у зародышей мух система NFkB изначально возникает как эволюционный путь. Роль, которую выполняет NFkB в развитии кишечника у млекопитающих, пока не ясна, необходимы дальнейшие исследования. Результаты недавно проведенного исследования in vitro с использованием культуры клеток кишечного эпителия показывают, что незрелые клетки кишечника могут иметь предрасположенность к чрезмерному воспалительному ответу (оцениваемому по секреции IL-8) на патогенные стимулы. Авторы указанных работ предполагают, что в период развития недостаточная экспрессия IкВ может способствовать усиленной активности NFkB. При данных условиях чрезмерный воспалительный ответ будет приводить к выраженному клеточному воспалению и неконтролируемому повреждению тканей. Воспаление представляет собой важный процесс, необходимый для выживания в условиях многообразия кишечной микрофлоры. Однако воспалительный ответ, подобно многим другим иммунным реакциям, имеет свои плюсы и минусы. Воспаление ведет к одновременному повреждению тканей, в основном за счет высвобождения оксидантов и протеаз — производных нейтрофилов. Это может обусловить нарушение защитного эпителиального барьера и инвазии тех микроорганизмов, которые при нормальных условиях не способны проникать через него. Таким образом, вредное содержимое просвета кишки может достичь субэпителиальной поверхности, в результате возникнет порочный круг провоспалительной активации и повреждения тканей. Использование противовоспалительных лекарственных средств, как предполагается, способно тормозить развитие ЯНЭК на ранней стадии, но необходимы дальнейшие исследования in vivo, способные подтвердить, что описанные здесь процессы действительно происходят в кишечнике человека.
При другой патофизиологической ситуации возможен альтернативный сценарий. Активация путей NFkB и МАРК бактериальными и другими стимулирующими факторами индуцирует транскрипционную активность целого ряда провоспалительных эффекторов и приводит к острому воспалению. Вполне вероятно, что внутреннее нарушение способности отвечать на бактериальное заражение в период начальной колонизации кишечника (возможно, вследствие онтогенетической незрелости, врожденных дефектов или опосредованного внешней средой снижения экспрессии сигнальных путей) способно вызвать разрушение ткани. В клинической практике у взрослых пациентов, не способных к генерации адекватного воспалительного ответа в кишечнике (например, имеющих наследственные дефекты врожденного иммунитета или острую нейтропению), выявляется повышенная чувствительность к кишечным бактериальным инфекциям, часто приводящая к системной диссеминации заболевания. Аналогично у специально выведенной линии мышей, имеющих мутации воспалительных регуляторов, также выявляется повышенная чувствительность к кишечным инфекциям. Представляет интерес тот факт, что мутации гена NOD2, предрасполагающие к болезни Крона, ведут к потере функции NOD2, причем дефектный NFkB-сигнал преобладает над гиперактивным. К тому же при исследовании у мышей в экспериментальной модели воспалительного заболевания кишечника блокада NFkB посредством трансгенной экспрессии нераспадающегося варианта IкВ в эпителиальных клетках приводит к более тяжелому течению заболевания по сравнению с контрольной группой. Уменьшенный воспалительный сигнал может привести к избыточному росту бактерий или к гиперчувствительности к проапоптозным стимулам. Вполне вероятно, что невозможность активации воспалительных путей может снизить индукцию антиапоптозных, цитопротективных факторов. Таким образом, незрелость воспалительного ответа в онтогенетическом аспекте делает кишечник новорожденного ребенка уязвимым для апоптоза, возникающего вследствие действия стрессорных факторов внешней среды, избыточного роста микроорганизмов или гипоксии. Очевидно, что здоровье организма хозяина зависит от баланса между излишней провоспалительной активацией (ведущей к повреждению тканей и клиническим последствиям) и ее дефицитом (что лишает слизистую оболочку защиты и/или провоцирует ее саморазрушение). Как указывалось ранее, в ответ на транзиторную гипоксию кишечника мыши, у которых отсутствовала активация NFkB в энтероцитах, реагировали избыточным апоптозом эпителия. Исследования с применением модели ЯНЭК у крыс показывают, что ранний апоптоз играет решающую роль в патогенезе ЯНЭК. Таким образом, необходимо дальнейшее изучение in vivo гиперактивных воспалительных процессов, ведущих к выраженному воспалению или его дефициту, обусловливающему неконтролируемый рост бактерий или усиленный апоптоз. Выраженное воспаление или его дефицит могут иметь значение для различных клинических ситуаций либо определенных стадий патогенеза, что может приводить к патологическим повреждениям кишечника, поскольку уже начался и прогрессирует процесс разрушения эпителия (как, например, при ЯНЭК).
– Вернуться в оглавление раздела “физиология человека” Оглавление темы “Иммунная система желудочно-кишечного тракта”:
|
Источник