Незавершенный фагоцитоз при воспалении
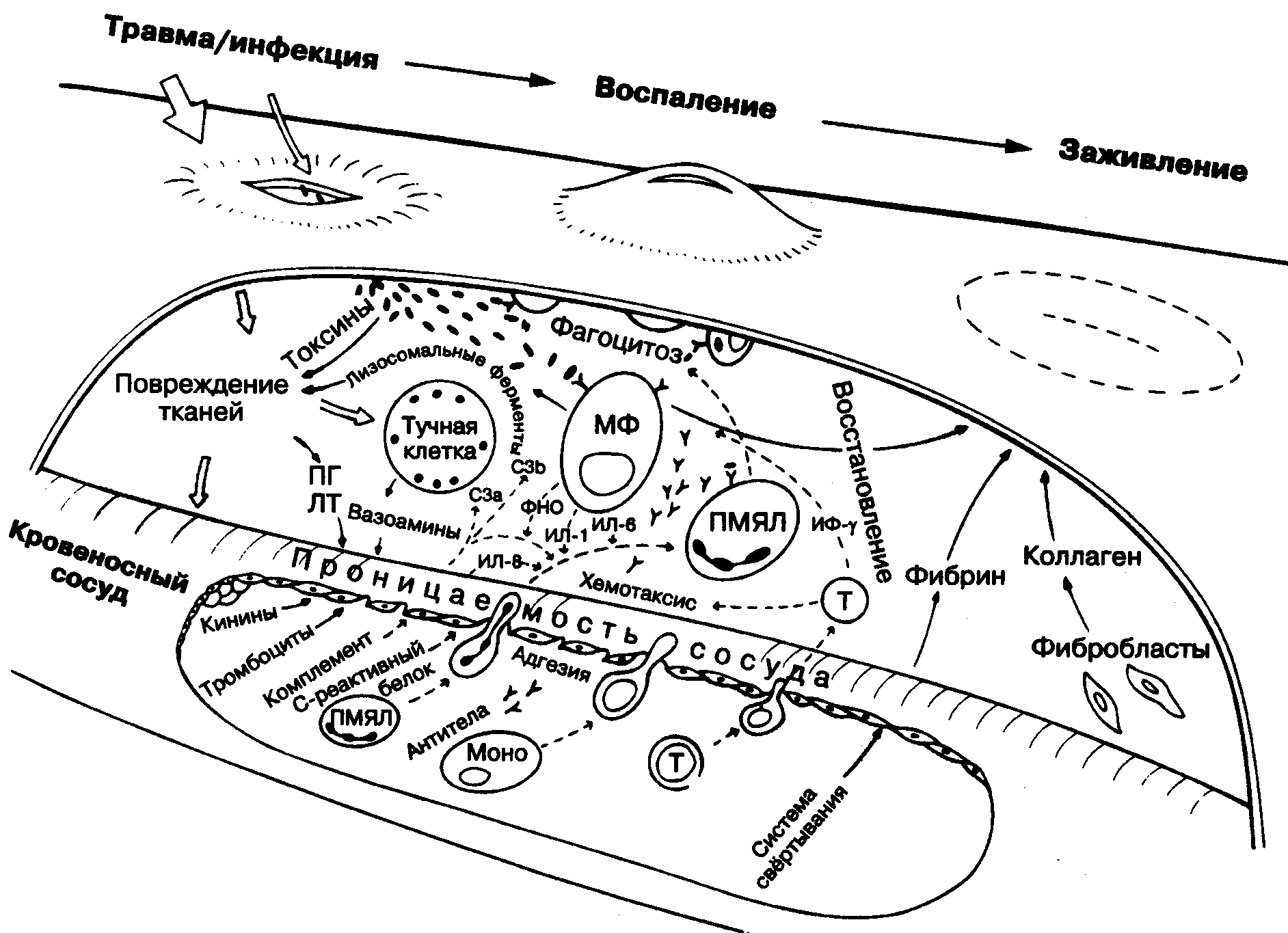
Фагоцитоз – это способность определенных клеток (фагоцитов) удерживать и переваривать плотные частицы. Это явление было открыто И. Мечниковым.
Фагоцитоз осуществляется микрофагами (нейтрофилами) и системой мононуклеарных макрофагов.
Мононуклеарные макрофаги
Система (MMS) включает следующие элементы:
- промоноциты (костный мозг);
- моноциты (кровь);
- тканевые макрофаги;
- гистиоциты соединительной ткани;
- печеночные клетки Куппера;
- легочные альвеолярные макрофаги;
- свободные и фиксированные макрофаги лимфатической ткани;
- плевру и перитонеальные макрофаги.
Клетки мононуклеарной системы объединяет общее происхождение гемопоэтических клеток и саморегуляция.
Моноцитопоэз
Моноцитопоэз – это стимулирующий фактор колонии фибробластов и фактор роста макрофагов, но он же подавляет (отрицательная саморегуляция) интерферон фибробластов и лейкоцитов и т. д.
Процесс фагоцитоза делится на четыре стадии:
- Приближение.
- Адгезия.
- Оседание;
- Стадия пищеварения.
Фаза приближения
Фагоцит приближается к объекту – бактериям, мервому клеточному элементу, инородному объекту. При движении под действием хемотаксиса цитоплазма фагоцита образует удлинения (псевдоподии).
Адгезия
Способствует образованию аминополисахаридов на поверхности фагоцитов и перекрытию фагоцитарного объекта белками сыворотки, особенно иммуноглобулинами. Последний механизм по сути является опсонизацией – бактерии и поврежденные клетки перекрываются с IgM, IgG и компонентами комплемента (C3, C5 и др.), что облегчает адгезию к фагоциту.
Адгезия
Поверхность фагоцита заряжена отрицательно, поэтому адгезия лучше, если объект, подлежащий фагоцитозу, заряжен положительно. Менее фагоцитарны отрицательно заряженные объекты, такие как опухолевые клетки.
Оседание
Этап фагоцитации объекта – путь инвагинации. Сначала фагоцит образует углубление, а затем фагосому – вакуоль, содержащую объект, подлежащий фагоцитозу. НАДН-зависимая оксидаза в мембране фагоцитов активируется до образования фагосом; в результате O2 превращается в O 2 ~ (супероксид-анион) и образуется H 2 O 2.
Эти продукты обладают бактерицидным действием, а также вызывают образование свободных радикалов. Под действием пероксидаз и каталаз H 2 O 2 расщепляется и высвобождается молекулярный O 2. Свободные радикалы и активный молекулярный O 2 действуют на мембрану фагоцита и объект, подлежащий фагоцитозу, активируя перекисное окисление липидов.
Липопероксиды и свободные радикалы неустойчивы к лизосомным мембранам и способствуют высвобождению лизосомальных ферментов.
Стадия пищеварения
Лизосомы присоединяются к фагосоме, содержащей фагоцитарный объект. Эти органеллы содержат все ферменты, необходимые для расщепления углеводов, белков, жиров и нуклеиновых кислот. В еще неактивной форме они попадают в вакуоль фагоцитов.
Пищеварительная вакуоль образуется при pH около 5,0, близком к оптимальному для лизосомальных ферментов. Активируются лизосомальные ферменты, и фагоцитарный объект постепенно переваривается. Во время стадии пищеварения проницаемость мембраны фагосомы увеличивается, содержимое фагосомы ускользает в цитоплазму, и микрофаг умирает (этому процессу способствует ацидоз). В этом случае фагоцитарный микроорганизм также может сохранять жизнеспособность.
Роль макрофагов в воспалительном процессе
Макрофаги начинают участвовать в фагоцитозе позже микрофагов. Макрофаги также более устойчивы к гипоксии и ацидозу, например, моноциты жизнеспособны даже при pH 5,5.
В очаге воспаления макрофаги выполняют несколько функций:
- Фагоцитируют бактериальные остатки, оставшиеся после эвакуации гноя и продуктов распада тканей – очищающая функция;
- Высвобождают лизосомальные ферменты – гиалуронидазу, аминопептидазу и др;
- Синтезируют компоненты системы комплемента и простагландины.
Взаимодействие макрофагов и лимфоцитов при хроническом воспалении
В то же время воспаленная тканевая среда также стимулирует образование фибробластов и фиброцитов. Постепенно появляется новая, богатая сосудами грануляционная ткань.
Фагоцитоз стимулируется продуктами повреждения тканей – внутриклеточные белки, ферменты, полипептиды, аминокислоты, электролиты и т. д., биологически активными веществами, половыми гормонами, тироксином, адреналином, лихорадкой. Но подавляется недостатком стимулирующих факторов, глюкокортикоидов, гликолортикоидов, ацетилхолина, ацетилхолина.
Фагоцитоз
Считается, что клетки плаценты и злокачественные опухоли способны секретировать вещество, которое подавляет функцию макрофагов, иммунологические реакции лимфоцитов и эмиграцию лейкоцитов, что приводит к значительному ослаблению или даже прекращению воспаления.
Объекты, которые фагоциты не могут переваривать, остаются в этих клетках в течение длительного времени и покрываются тонкой пленкой аминополисахаридов. После гибели фагоцитов они повторно фагоцитируются или выводятся из организма. Процесс, при котором фагоцит после переваривания высвобождает часть продуктов своего фагоцитоза в окружающую среду, называется экструзией.
Фагоцитоз – не единственный в организме механизм борьбы с воспалением. Большинство микроорганизмов погибают в условиях ацидоза, а также от ферментов, высвобождаемых во время гибели клеток и функционирования иммунокомпетентной системы.
Нейтрофилы во внеклеточном пространстве секретируют катионные белки, которые могут убивать ферменты без ферментов и фагоцитоза. Таким образом, воспалительные очаги постепенно избавляются от микроорганизмов и мертвых клеток.
Асептическое и острое воспаление
Дальнейшее течение воспаления зависит от того, является ли воспаление асептическим или бактериальным.
В асептических воспалительных условиях, например, вокруг хирургического шва, инородного тела, стенка микрофагов (нейтрофилов) начинает формироваться в течение нескольких часов, достигая максимума в течение дня.
Позже появляется следующий вал макрофагов, который достигает максимума через 2-3 раза. в день. Эмигрировавшие лейкоциты постепенно становятся неподвижными, больше не могут делиться и погибают в течение 3-5 дней. 2-3. на 5 сутки начинает формироваться стенка фибробластов, а на 5 сутки – соединительнотканная капсула.
Таким образом, в случае острого воспаления патогенный агент в организме преобразует белки, которые участвуют в реакции антиген-антитело, медиаторы и модуляторы воспаления, систему фагоцитов и миграцию клеток. В результате заканчивается острое воспаление. Однако, если инфекционные агенты попадают в участок асептического воспаления, например, в результате травмы, это воспаление становится септическим (бактериальным) воспалением.
Бактериальные воспалительные состояния бактерий и токсинов, не вызывающие гиперемии, экссудации и эмиграции лейкоцитов. Между клетками воспаленных тканей и особенно вокруг кровеносных сосудов накапливается все больше и больше микрофагов. Лизосомы микрофагов содержат множество активных ферментов, и эти клетки также начинают процесс фагоцитоза. При пальпации воспаленная ткань в это время кажется плотной, поэтому это называется стадией воспалительной инфильтрации.
По мере прогрессирования воспаления лейкоциты и те тканевые клетки, которые претерпели необратимые изменения во время воспаления, погибают. В этих клетках высвобождаются лизосомальные ферменты, которые расщепляют тканевые белки, белковые и липидные комплексы и другие структуры. Это стадия гнойного размягчения воспаления.
Эти стадии наблюдаются, например, у пациентов с гнойным воспалением перикарда (фурункул), гнойным воспалением апокринных потовых желез (гидраденит) и гнойным воспалением соединительной ткани (флегмона). При вдыхании воспаленная ткань выглядит мягкой, с характерным раскачиванием – флюктуацией. Образуется замкнутое скопление гноя – абсцесс.
Гнойное воспаление перикарда
Гной разрывается в направлении наименьшего сопротивления (либо наружу, либо внутри тела). Если гной попадает в кровоток (пемия), в организме может развиться множество очагов гноя, но под действием микроорганизмов и токсических веществ – угрожающее общее заболевание (сепсис, септикопиемия). Поэтому важно диагностировать накопление гноя и обеспечить хирургический дренаж гноя наружу.
Продолжение статьи
- Часть 1. Этиология и патогенез воспаления. Классификация.
- Часть 2. Особенности обмена веществ при воспалении.
- Часть 3. Физико – химические изменения. Роль нервной и эндокринной систем в развитии воспаления.
- Часть 4. Изменения в периферическом кровообращении при воспалении.
- Часть 5. Экссудация. Экссудат и транссудат.
- Часть 6. Эмиграция лейкоцитов. Хемотаксис.
- Часть 7. Фагоцитоз. Асептическое и острое воспаление.
- Часть 8. Распространение. Последствия. Принципы лечения воспаления.
Поделиться ссылкой:
Источник
Поглощённые фагоцитами бактерии обычно погибают и разрушаются, но некоторые микроорганизмы, снабжённые капсулами или плотными гидрофобными клеточными стенками, захваченные фагоцитом, могут быть устойчивы к действию лизосомальных ферментов или способны блокировать слияние фаго-сом и лизосом. В силу этого обстоятельства они на длительное время остаются в фагоцитах в жизнеспособном состоянии. Такая разновидность фагоцитоза получила название незавершённого. Существует множество причин незавершённого фагоцитоза, основные из них перечислены на рисунке.
Многие факультативные и облигатные внутриклеточные паразиты не только сохраняют жизнеспособность внутри клеток, но и способны размножаться. Персистирование патогенов опосредуют три основных механизма.
• Блокада фагосомо-лизосомального слияния. Этот феномен обнаружен у вирусов (например, у вируса гриппа), бактерий (например, у микобактерий) и простейших (например, у токсоплазм).
• Резистентность к лизосомальным ферментам (например, гонококки и стафилококки).
• Способность патогенных микроорганизмов быстро покидать фагосомы после поглощения и длительно пребывать в цитоплазме (например, риккетсии).
Фагоцитоз сопряжен с процессом передачи информации об Аг лимфоцитам. Это происходит тогда, когда объектом фагоцитоза являлся носитель чужеродной антигенной информации (клетки, микроорганизмы, опухолевые и вируссодержащие клетки, белковые неклеточные структуры и др.). В этом случае Аг после его модификации в фагоците (процессинг) экспрессируется на поверхности клетки. Такой Аг значительно более иммуногенен, чем интактный Аг. Фагоцитирующие клетки, осуществляющие процессинг, называют антигенпред-ставляющими клетками. При этом фагоцит представляет (презентирует) клеткам иммунной системы двоякую информацию: о чужеродном Аг и о собственных Аг, кодируемых генами HLA и необходимых для сравнения их с чужими Аг.
Фагоциты также продуцируют и выделяют в межклеточную жидкость ряд БАВ, регулирующих развитие либо иммунитета, либо аллергии, либо состояния толерантности. Таким образом, воспаление непосредственно связано с формированием иммунитета или иммунопатологических реакций в организме.
Основные причины незавершённого фагоцитоза.
Пролиферация
Пролиферация — компонент воспалительного процесса и завершающая его стадия — характеризуется увеличением числа стромальных и, как правило, паренхиматозных клеток, а также образованием межклеточного вещества в очаге воспаления. Эти процессы направлены на регенерацию альтерированных и/или замещение разрушенных тканевых элементов. Существенное значение на этой стадии воспаления имеют различные БАВ, в особенности стимулирующие пролиферацию клеток (митогены).
Пролиферативные процессы при остром воспалении начинаются вскоре после воздействия флогогенного фактора на ткань и более выражены по периферии зоны воспаления. Одним из условий оптимального течения пролиферации является затухание процессов альтерации и экссудации.
Формы и степень пролиферации органоспецифических клеток различны и определяются характером клеточных популяций.
• У части органов и тканей (например, печени, кожи, ЖКТ, дыхательных путей) клетки обладают высокой пролиферативной способностью, достаточной для ликвидации дефекта структур в очаге воспаления.
• У других органов и тканей эта способность весьма ограничена (например, у тканей сухожилий, хрящей, связок, почек и др.).
• У ряда органов и тканей паренхиматозные клетки практически не обладают пролиферативной активностью (например, миоциты сердечной мышцы, нейроны). В связи с этим при завершении воспалительного процесса в тканях миокарда и нервной системы на месте очага воспаления пролифе-рируют клетки стромы, в основном фибробласты, которые образуют и неклеточные структуры. В результате этого формируется соединительнотканный рубец. Вместе с тем известно, что паренхиматозные клетки указанных тканей обладают высокой способностью к гипертрофии и гиперплазии субклеточных структур.
Активация пролиферативных процессов коррелирует с образованием БАВ, обладающих антивоспалительным эффектом (своеобразных противовоспалительных медиаторов). К числу наиболее действенных среди них относятся:
• ингибиторы гидролаз, в частности протеаз (например, антитрипсина), р-микроглобулина, плазмина или факторов комплемента;
• антиоксиданты (например, церулоплазмин, гаптоглобин, пероксидазы, СОД);
• полиамины (например, путресцин, спермин, кадаверин);
• глюкокортикоиды;
• гепарин (подавляющий адгезию и агрегацию лейкоцитов, активность кининов, биогенных аминов, факторов комплемента).
Замещение погибших и повреждённых при воспалении тканевых элементов отмечается после деструкции и элиминации их (этот процесс получил название раневого очищения).
– Читать далее “Регуляция пролиферации. Острое воспаление.”
Источник
Оглавление темы “Факторы неспецифической резистентности организма. Интерферон (ифн). Иммунная система. Клетки иммунной системы.”:
1. Кислородзависимая микробицидная активность. Кислороднезависимые механизмы уничтожения микробов.
2. Завершённость фагоцитарных реакций. Завершение фагоцитоза. Персистирование микробов. Причины персистирования микроорганизмов. Другие защитные функции фагоцитов.
3. Факторы неспецифической резистентности организма. Система ИФН. Система интерферона (ифн). Функции интерферона (ифн). Механизм антивирусного действия интерферона (ифн).
4. Интерферон (ифн) первого типа. ИФН I. Функции интерферона (ифн) первого типа. Интерферон (ифн) второго типа. ИФН II (b-ИФН). Функции интерферона (ифн) второго типа.
5. Факторы выделяющиеся при разрушении клеток. Воспаление. Признаки воспаления. Классические признаки острого воспаления по Цельсу. Гистамин.
6. Кинины. Лейкотриены. Простагландины. Белки острой фазы воспаления. Цитокины. Реакции воспаления. Патогенез воспаления.
7. Иммунная система. Индуцибельные факторы защиты организма ( иммунная система ). Главный комплекс гистосовместимости ( МНС первого и второго класса ). Гены MHC I и MHC II.
8. Органы иммунной системы человека. Организация иммунной системы человека. Центральные органы иммунной системы. Периферические органы иммунной системы.
9. Клетки иммунной системы. Иммунокомпетентные клетки. Функция лимфоцитов. Классификация лимфоцитов. Какие бывают лимфоциты?
10. Т-лимфоциты ( Т-клетки ). Созревание Т-клеток. Основные цитокины иммунного ответа. Маркёры Т-клеток. CD-маркёры Т-лимфоцитов.
Завершённость фагоцитарных реакций. Завершение фагоцитоза. Персистирование микробов. Причины персистирования микроорганизмов. Другие защитные функции фагоцитов.
Завершённость фагоцитарных реакций. Поглощённые фагоцитами бактерии обычно погибают и разрушаются (рис. 10-4, Б). Некоторые бактерии, снабжённые капсулами или плотными гидрофобными клеточными стенками, могут быть устойчивы к действию лизосомальных ферментов; другая часть патогенов способна блокировать слияние фагосом и лизосом. В подобных случаях фагоцитоз носит незавершённый характер, и возбудитель выживает в цитоплазме поглотившей его клетки.
Многие факультативные и облигатные внутриклеточные, паразиты не только сохраняют жизнеспособность внутри клеток, но и способны размножаться. Персистирование патогенов опосредуют три основных механизма:
Блокада фагосомолизосомального слияния. Подобный механизм отмечен у вирусов (например, вируса гриппа), бактерий (например, микобактерий) и простейших (например, токсоплазм).
Резистентность к лизосомальным ферментам (например, гонококки и стафилококки). Способность патогенных микроорганизмов быстро покидать фагосомы после поглощения и длительно пребывать в цитоплазме (например, риккетсии).
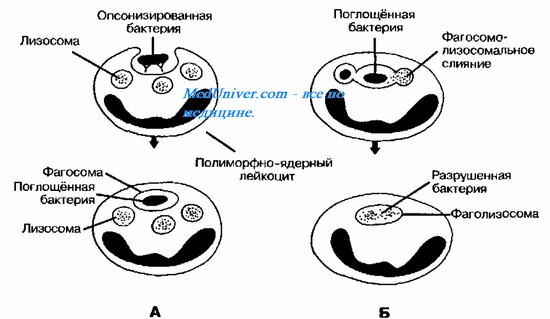
Рис. 10—4. Фагоцитоз. Этапы поглощения (А) и внутриклеточного уничтожения микроорганизмов (Б) фагоцитами.
Другие защитные функции фагоцитов
• Инициация иммунных реакций. Поглощая чужеродные агенты, макрофаги перерабатывают (так называемый процессинг Аг) и «представляют» (презентация) их Аг иммунокомпетентным клеткам. При этом они выделяют цитокины, активирующие лимфоциты. Другими словами, макрофаги — Аг-процессирующие и Аг-представляющие клетки, и фагоцитоз можно рассматривать как видимое отражение этих иммунных функций.
• Антителозависимый цитолиз. Фагоциты участвуют в антителозависимом клеточно-опо-средованном цитолизе; для этого клетки экспрессируют на своей поверхности рецептор Fc-фрагмента IgG (CD16).
– Также рекомендуем “Факторы неспецифической резистентности организма. Система ИФН. Система интерферона (ифн). Функции интерферона (ифн). Механизм антивирусного действия интерферона (ифн).”
Источник
Дефицит
белка.Дефицит
витаминов.Наследственные
ферментопатии.Иммунодефициты.
Особенности
возбудителя (его размеры значительно
превышают размеры самого фагоцита).Объектом
фагоцитоза являются комплексы
антиген-антитело, находящиеся на
плоской поверхности сосудистого
эндотелия.
Как
следствие, раздраженные мононуклеары
выделяют монокины, лимфокины, которые
стимулируют хемотаксис, соседние клетки
соединительной ткани и др. Активированные
хемоаттрактантами фагоциты способны
высвобождать содержимое своих гранул
не только внутрь фагосомы, но и во
внеклеточное пространство. При этом
содержимое гранул и продуцируемые
фагоцитами активные метаболиты кислорода
воздействуют
и на объект атаки, и на ткани организма
хозяина.
Дистантно развивается лейкоцитоз.
При
затяжных воспалительных процессах
(сопровождающихся незавершенным
фагоцитозом)
целесообразно применять
Стимуляторы
иммунитета, в частности, фагоцитоза
путем
искусственного обострения воспаления,
вводя, например, искусственно получаемые
эндотоксины бактерий (продигиозан);через
активацию лимфоцитов иммуностимуляторами
(см. тему “Патология иммунитета”).
Создание
гипертермии (положительный эффект на
активность ферментов, диссоциацию
оксигемоглобина).
Витаминотерапию.
Специфическую
антибиотикотерапию.
Механизмы пролиферации.
Пролиферация
– репаративная стадия воспаления, это
размножение клеток. Нейтрофилы погибают,
макрофаги расчищают поле для регенерации.
Фибробласты
– главные эффекторы репарации. Механизм
– стимуляция пролиферации через
синтез ДНК и митотическую активность.
Начинается с 1
стадии воспаления, а ее пик приходит к
3 стадии.
Медиаторы пролиферации (трефоны)
Полиамины
– путресцин, спермидин (продукты
орнитиндекарбоксилазы).Факторы
роста фибробластов
– тромбоцитарный и гипофизарный.Эндотелиальный
хемотаксический фактор
(из макрофагов) – для врастания сосудов
в грануляционную ткань.Тканеспецифические
стимуляторы
– иммуноглобулины G
и M.Лимфокины
(из Т-лимфоцитов) участвуют в пролиферации
лимфоцитов и макрофагов.Монокины
(из макрофагов).Эндотелиальный
фактор роста.Кейлоны
(ингибиторы пролиферации).
Их
эффекты ослабляет: адреналин,
глюкокортикоиды, цАМФ. Усиливает
альдостерон, цГМФ.

Рис. 10.5. Общая схема
острого воспаления.
Хроническое воспаление. Гранулема.
Хроническое
воспаление
развивается, когда повреждающий агент
действует длительное время, или первично
(при аллергических и аутоиммунных
болезнях), и характеризуется преобладанием
процессов пролиферации.
Причины хронического
воспаления
Слабая реактивность,
чаще у детей и стариков.Слабые сосудистые
реакции.Незавершённый
фагоцитоз.Устойчивые
микроорганизмы (при туберкулёзе,
проказе, листериозе, токсикоплазмозе).Неперевариваемые
объекты – инородные тела (металл,
древесина).
Активация
лимфоцитов как хронический аутоиммунный
процесс бывает при ревматоидном артрите,
системной красной волчанке (СКВ). Этому
способствует изменение антигенной
структуры клеток в очаге воспаления.

Рис. 10.6. Схема
хронического и клеточно-опосредованного
(гранулематозного) воспаления.
Гранулематозное
воспаление
– хроническое
воспаление, вызванное нерастворимыми
или медленно разрушающимися
(персистирующими) раздражителями и
сопровождающееся образованием гранулем,
возникающих в результате пролиферации
и трансформации способных к фагоцитозу
клеток.
Этиологические
факторы гранулематозного воспаления
Эндогенные
труднорастворимые
продукты повреждения тканей, в первую
очередь жировой ткани (например, мыла),продукты нарушенного
обмена, такие, как ураты.
Экзогенные
биологические
факторы (бактерии, грибы, простейшие,
гельминты и т. д.),органические
и неорганические вещества (при пылевых
болезнях – силикоз, талькоз, асбестоз,
биссиноз и др., крахмальные и тальковые
гранулемы, шовные гранулемы, вызванные
экзогенными жирами, сульфатом бария,
ртутью и т. д.), в том числе лекарственные
средства (гранулематозный гепатит,
олеогранулематозная болезнь).
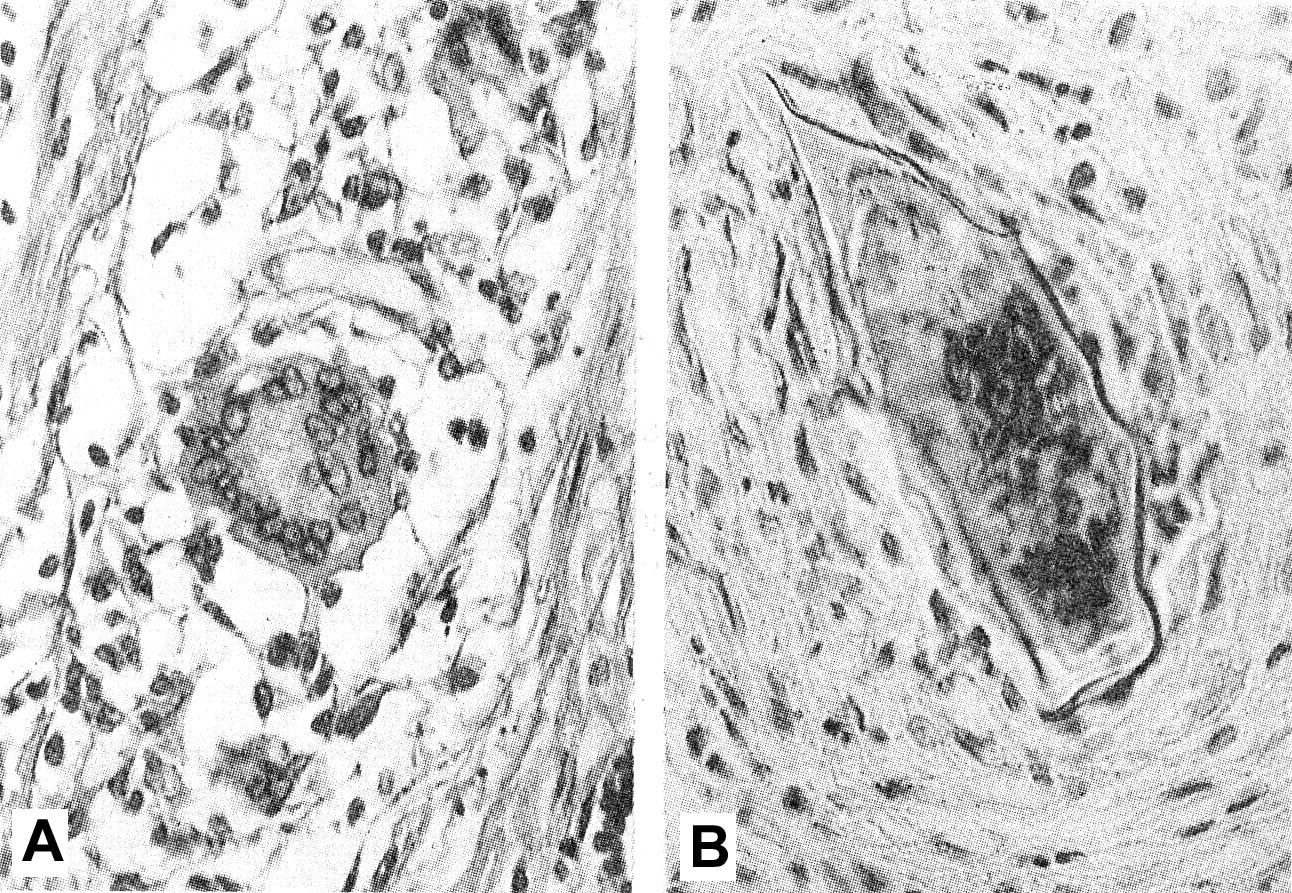
Рис.
10.7. Эпителиоидно-клеточные
гранулемы саркоидного типа.
Примечание.
А – гранулема саркоидного типа в стенке
тонкой кишки при болезни Крона, в центре
гранулемы – гигантская многоядерная
клетка Пирогова-Лангханса (увеличение
в 400 раз); В – гранулема саркоидного типа
вокруг яиц паразита при шистосомозе в
подслизистом слое тонкой кишки (увеличение
в 250 раз).
Длительно
раздражённые макрофаги выделяют
монокины, которые и формируют гранулёму.
Гранулемы
представляют собой компактное скопление
Макрофагов.
Эпителиоидных
клеток.Дополнительные
признаки (могут не быть)
инфильтрация
другими клетками (лимфоцитами,
плазматическими клетками, нейтрофильными
или эозинофильными гранулоцитами);наличием
фибробластов и развитием склероза;развитием
деструктивных изменений и некроза.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
