Плазменных медиаторов воспаления относятся
Они представлены кининами; компонентами системы комплемента; факторами системы гемостаза (изменяющими свертывание, антисвертывание и фибринолиз крови).
Кинины – различные ФАВ (брадикинин, каллидин и др.), которые образуются в плазме из кининогенов, синтезирующихся в печени и других органах под влиянием протеаз (калликреинов или кининогеназ), и одновременно разрушаются под действием карбоксипептидазных ферментов (кининаз). В очаге воспаления калликреины образуются из прекалликреинов под влиянием активаторов (ацидоз, катехоламины, фактор Хагемана, трипсин, плазмин, катепсины, урокиназа и др.).
Кинины оказывают мощное влияние на состояние микроциркуляторного русла. В частности, они резко (более чем в 10 раз, по сравнению с гистамином) повышают проницаемость стенок микрососудов (иногда до развития микрогеморрагий), стимулируют образование экссудата, расширяют артериолы (вызывая развитие артериальной гиперемии), активизируют процесс эмиграции лейкоцитов из крови в поврежденные ткани. Под влиянием повышенного количества кининов активизируется ноцицептивная система, формирующая болевые ощущения и различные реакции организма на него.
Компоненты системы комплемента либо поступают в очаг воспаления из синтезировавших их органов (главным образом, печени), либо из поступивших сюда мононуклеаров. Активизированные в поврежденных тканях компоненты данной системы (особенно С3а и С5а), повышают проницаемость микрососудов, активируют процессы хемотаксиса лейкоцитов и опсонизации объектов фагоцитоза, обладают бактерицидным и цитолитическим действием и т.д.
Факторы системы гемостаза в виде прокоагулянтов и коагулянтов, проантикоагулянтов и антикоагулянтов, плазминогена и плазмина, усиленно образуются в очаге повреждения различных клеток, тканей, в том числе эндотелия сосудов и клеток крови. Они занимают важное место в характере и степени развития местных и системных нарушений в организме.
Активизация системы коагуляции сопровождается образованием тромбов и тромбоэмболов, вызывающих расстройства местного кровообращения (ишемию, венозную гиперемию, стаз), нарушения процессов метаболизма, развитие дистрофических, некробиотических и некротических процессов. Активизация антисвертывающей системы и системы фибринолиза предупреждает образование тромбов, способствует геморрагиям, приводит к гипоксии и также к развитию деструктивно-дистрофических процессов в очаге воспаления.
Среди различных факторов гемостаза важное место занимает образующийся в очаге повреждения активизированный фактор Хагемана, который способен усиливать коагуляционный гемостаз и активизировать также кининовую и фибринолитическую системы.
Промежуточные медиаторы воспаления
Источником их образования являются, главным образом, лейкоциты (нейтрофилы, эозинофилы, моноциты, лимфоциты), часть из которых трансформируется в тканевые клетки (гистиофаги).
К медиаторам, образующимися лейкоцитами, внедренными в очаг повреждения тканей, относятся различные по строению и действию ФАВ, главным образом, групп цитокинов и лейкокинов.
Цитокины – это большая группа местных медиаторов, которые, взаимодействуя друг с другом и с разнообразными поврежденными и неповрежденными клеточно-тканевыми структурами организма, во 1-х, проявляют самые многообразные виды биологической активности; во 2-х, играют разную роль в развитии острого и хронического воспаления, его местных и системных реакций; в 3-х, участвуют в развитии не только воспаления, но и иммунитета, аллергии и аутоиммунных заболеваний и т.д.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
Замедление кровотока, а затем и его полная остановка готовят почву для следующих этапов воспаления. При повреждении эндотелия возникает чужеродная поверхность для циркулирующей крови. Это служит сигналом к активации фактора контакта (синонимы: фактор Хагемана, фактор XII свертывания крови) и включению механизма внутрисосудистого свертывания крови. Помимо свертывания крови, фактор Хагемана активирует фермент калликреин. Под действием калликреина от а-глобулинов плазмы отщепляется полипептид из 10 аминокислот – брадикинин. Наряду с ним образуются другие брадикинины, состоящие из 11 и 13 аминокислот. Они тоже активны, но в меньшей степени, чем лизил-брадикинин. В норме брадикинины быстро инактивируются специфическими пептидазами-кининазами (их особенно много в легочной ткани). Однако при стазе создаются условия для накопления брадикининов в сосуде, а их инактивация тормозится. Затормозить образование брадикининов можно ингибиторами калликреина – тразилолом, диизопропилфторфосфатом, антагонистом трипсина из соевых бобов. Своевременное введение всех этих препаратов тормозит развитие воспаления.
Брадикинин расширяет капилляры и посткапиллярные венулы, повышает проницаемость эндотелия, что связано с сокращением эндотелиоцитов, расхождением их отростков и открытием межэндотелиальных щелей.
Наряду со свертыванием крови через фактор Хагемана запускается фибринолиз, т.е. процесс растворения фибриновых сгустков.
Под действием фактора Хагемана в ходе свертывания крови активируется также система комплемента, многие фракции которого являются медиаторами воспаления. Фактор Хагемана прямо переводит в активную форму фермент СЗ-конвертазу. Под влиянием СЗ-конвертазы из СЗ-компонента комплемента образуется две активные фракции – СЗа и СЗв. СЗа меньших размеров переходит в жидкую фазу (плазму крови), а более крупный СЗв-фрагмент сохраняет связь с клеточными мембранами (эритроцитами, тромбоцитами, лейкоцитами крови). К СЗв на клеточной мембране присоединяется другой компонент – С5. В свою очередь он расщепляется на С5а и С5в. С5а переходит в жидкую фазу, а С5в остается на мембранах клеток. Если к С5в на мембране присоединяются компоненты С6, С7, С8 и С9, то в конце концов клетка может лизироваться. Перешедшие в плазму или другую биологическую жидкость сЗа и С5а начинают выступать в качестве молекулярных медиаторов воспаления. Под их влиянием повышается проницаемость эндотелия. Это связано с тем, что С5а-фракция взаимодействует с тучными клетками, из которых выделяется гистамин и другие факторы, расширяющие микрососуды и повышающие их проницаемость.
В крови имеются не только активаторы, но и ингибиторы системы комплемента. В противном случае любая, даже ничтожная по величине травма сосуда и окружающих тканей могла бы вести к бесконтрольному воспалению, которое потеряло бы свои защитные функции. Наибольшее значение имеют ингибиторы С1 и СЗ компонентов комплемента.
3.2.3. Клеточные медиаторы воспаления
В результате резкого замедления, а затем и полной остановки кровотока в сосуде концентрируются не только плазменные, но и клеточные медиаторы воспаления. Лейкоциты крови содержат вещества, которые могут повышать проницаемость капилляров и даже повреждать эндотелий. Прежде всего следует остановиться на нейтрофилах крови. В них имеются особые гранулы, насыщенные биологически активными веществами. У человека, кролика, крысы и других видов эти гранулы неоднородны. Различают азурофильные и специфические гранулы. Под электронным микроскопом азурофильные гранулы выглядят как плотные округлые тельца диаметром 0,3-0.5 мкм. Специфические гранулы меньше по размерам и больше варьируют по форме. В зрелом нейтрофиле 1/3 гранул относится к азурофильным (избирательно прокрашиваются азуром), а 2/3 – к специфическим. Но главное заключается не в окраске и структуре гранул, а в их содержимом.
Основная часть факторов, повышающих проницаемость микрососудов (“факторов проницаемости”) сосредоточена в азурофильных гранулах. В частности, в них имеется особый протеолитический фермент, активный в кислой среде. Под его действием от а-глобулинов крови отщепляется полипептид, состоящий из 25 аминокислот. Также как брадикинин, он резко повышает проницаемость сосудов. Наряду с ним из нейтрофилов выделяется калликреин, обладающий ферментативной активностью и запускающий образование брадикинина. Ферменты нейтрофилов коллагеназа и эластаза расщепляют базальные мембраны, что также ведет к росту проницаемости микрососудов.
Выделение медиаторов воспаления резко усиливается после стимуляции нейтрофилов бактериальным эндотоксином, иммунными комплексами, СЗа и С5а-фракциями комплемента, калликреином. В этих случаях клетки начинают выделять большие порции перекиси водорода, активных форм восстановленного кислорода – супероксиданионрадикал (-O2) и синглетный кислород (IO2). Эти факторы могут как-бы “обстреливать” разные клеточные мишени, в том числе – эндотелий капилляров. В результате такого “обстрела” в мембранах клеток запускается перекисное окисление липидов.
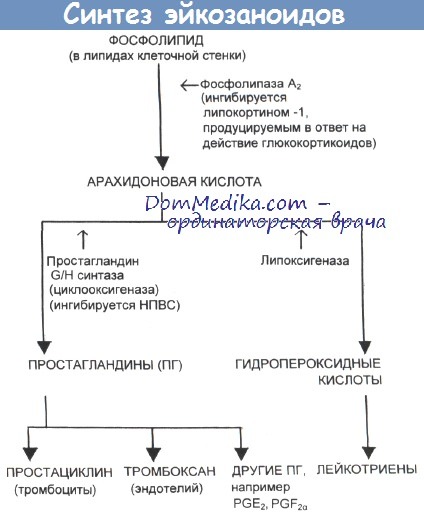
Стимулированные нейтрофилы выделяют продукты окисления арахидоновой кислоты, которая входит в состав фосфолипидов их мембран. При окислении арахидоновой кислоты с помощью фермента циклооксигеназы образуются простагландины. Под влиянием простагландинов группы Е проницаемость эндотелия резко возрастает, а микрососуды расширяются. Напротив, простагландины группы F вызывают не расширение, а спазм микрососудов и уменьшение их проницаемости. При другом пути окисления арахидоновой кислоты под действием фермента липоксигеназы образуются полициклические продукты, получившие название лейкотриены. Из соединений этого класса наиболее стабильной биологической активностью обладают лейкотриены С4, Д4, и Е4. Цифра “4” обозначает число двойных связей в молекуле. Выяснилось, что так называемая, медленно реагирующая субстанция анафилаксии (МРСА) является комбинацией из этих трех лейкотриенов. Лейкотриены повышают проницаемость капилляров и усиливают агрегацию тромбоцитов. В свою очередь из тромбоцитов образуются свои медиаторы воспаления – серотонин, тромбоксан A2, АДФ, простагландины Е.
Клеточные и плазменные медиаторы в кровотоке действуют сообща. Например, СЗа- и С5а-фракции комплемента стимулируют нейтрофилы, секретируют протеазы, которые активируют комплемент. Образующиеся в результате этого СЗа и С5а, а также ряд других фракций вновь стимулируют нейтрофилы. Аналогичный механизм формируется и при другом пути активации комплемента – через иммунные комплексы. Образующиеся в этом случае С3а- и С5а-фракции комплемента, также как и сами иммунные комплексы, через соответствующие С3-рецепторы стимулируют нейтрофилы в зоне контакта с эндотелием.
Нейтрофилы выделяют медиаторы, нарушающие проницаемость эндотелия в месте контакта, и открывают дорогу воспалению. Отсюда понятно, почему при резком дефиците нейтрофилов (после введения горчичного яда или облучения) удается затормозить даже такие остротекущие формы иммунокомплексного воспаления как феномен Артюса, острый гломерулонефрит и другие формы воспаления, вызванные органоспецифическими антителами.
В повышении проницаемости микрососудов принимают деятельное участие не только клетки крови, но и тканей, окружающих сосудов. Из них очень важную роль играют тучные клетки. В их характерных метахроматически окрашенных гранулах содержится гистамин, серотонин, гепарин и другие медиаторы воспаления. Тучные клетки начинают разгружаться от медиаторов под действием С5а-фракции комплемента (анафилотоксина), протеолитических ферментов из гибнущих клеток или специфического аллергена. В патогенезе острого воспаления наибольшую роль играет гистамин. Это – первый медиатор, который был обнаружен в очаге воспаления еще в 1910 году Дейлом. Особенно много гистамина выделяется тучными клетками в очаге аллергического воспаления, протекающего с явлениями повышенной чувствительности немедленного типа. Гистамин вызывает быстрое и резкое сокращение эндотелиоцитов. В связи с этим обнажаются межэндотелиальные щели и усиливается выход жидкой части крови и ее форменных элементов в ткань.
Соседние файлы в папке ЛЕКЦИИ
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
По степени задействования различных провоспалительных и противовоспалительных механизмов в развитии воспаления выделяют два альтернативных варианта:
– экссудативно-деструктивное, или гнойное, воспаление;
– продуктивное, или пролиферативно-клеточное, воспаление.
Главной движущей силой воспаления в первом случае становятся обладающие выраженным флогогенным потенциалом нейтрофилы, а также система комплемента и иммуноглобулины (Ig), особенно IgG. Во втором случае отмечают гораздо менее выраженную экссудативно-сосудистую реакцию, преобладающим клеточным элементом инфильтрата бьшают мононуклеары, а в некоторых случаях (например, при гельминтозах) – эозинофилы.
В воспалительном процессе, возникшем в ответ на действие генетически чужеродных агентов (как экзогенного, так и эндогенного происхождения), принимают участие различные регуляторные, исполнительные физиологические и метаболические системы, а также клетки и межклеточные структуры.
Обязательные участники воспаления – стенки микроциркуляторного русла (артериол, прекапилляров, капилляров, посткапилляров, венул), особенно их эндотелиоциты, межклеточное вещество с различными стромальными клетками (особенно фибробластами) повреждённых тканей и органов, мигрирующие в очаг воспаления лейкоциты (особенно нейтрофилы, моноциты и лимфоциты), белки повреждённых тканей и плазмы и разнообразного происхождения медиаторы воспаления (лат. tor – посредник).
Именно медиаторам воспаления принадлежит особо значимая роль в развитии многообразных процессов в очаге воспаления (характере и выраженности вторичной альтерации, сосудистых реакций, экссудации, эмиграции лейкоцитов, фагоцитоза, расстройств метаболических процессов, взаимодействия между собой клеток и субклеточных структур, пролиферации, репаративной регенерации и др.). К медиаторам воспаления относят различные по химическому строению, интенсивности, длительности действия и месту образования ФАВ. Эти ФАВ опосредуют многообразное действие на организм как самих флогогенных факторов, так и патогенетических факторов, формирующихся в динамике воспаления.
Следует отметить, что все медиаторы бывают синтезированы в тех или иных клетках.
Причём одни (клеточные) медиаторы образуются и выделяются в очаг воспаления в функционально активном состоянии (гистамин, серотонин, ацетилхолин, норадреналин, простагландины Е и I, тромбоксан В2, лейкотриены, продукты ПОЛ и др.).
Другие медиаторы – в функционально неактивном состоянии, в виде предшественников, которые под влиянием соответствующих промоторов в гуморальных средах (преимущественно в плазме) становятся физиологически активными и затем уже поступают в очаг воспаления или какие-либо другие структуры организма (ки-нины, компоненты системы комплемента, факторы системы гемостаза).
Третьи образуются в лейкоцитах (гранулоцитах, моноцитах, лимфоцитах): как циркулирующих в крови, так и усиленно мигрирующих в очаг повреждения клеточ-но-тканевых структур [интерлейкины (ИЛ), интерфероны (ИФ), хемо- и лейкокины, гидролазы, катионные белки, кейлоны, фибронектин, оксид озота и др.].

С учётом сказанного по месту приобретения физиологически активного состояния медиаторы воспаления делят на три группы:
– клеточные (локальные, образующиеся в месте повреждения);
– плазменные;
– лейкоцитарные (промежуточные).
Клеточные медиаторы воспаления преимущественно образуются следующими клетками:
– лаброцитами (например, тучные клетки, тканевые базофилы, мастоциты);
– тромбоцитами;
– клетками соединительной ткани;
– клетками эпителиальной ткани;
– клетками нервной ткани.
К клеточным медиаторам воспаления относят следующие:
– биогенные амины (гистамин, серотонин);
– нейромедиаторы (норадреналин, ацетилхолин);
– простагландины (А, В, С, Д, Е, F, I), главным образом Е2 и Ib2;
– тромбоксаны, преимущественно типа А2;
– факторы активации тромбоцитов;
– лейкотриены (А, В, С, Д, Е), главным образом типа В4 (продукты липоксигеназного превращения арахидоновой кислоты);
– продукты свободнорадикального перекисного окисления липидов мембран клеток (перекиси, гидроперекиси, альдегиды, активные формы кислорода и др.);
– нуклеотиды (АТФ, ц АМФ, ц ГМФ и др.);
– нуклеозиды (аденозин и др.);
– кейлоны и антикейлоны;
– гидролазы повреждённых клеточно-тканевых структур;
– оксид азота эндотелиоцитов и др.
К плазменным медиаторам воспаления относят следующие:
– кинины (брадикинин, каллидин);
– компоненты системы комплемента;
– факторы системы гемостаза (участвующие в изменении активности свёртывающей, противосвёртывающей и фибринолитической систем крови).
К промежуточным медиаторам воспаления относят цитокины (ранее именуемые монокинами и лимфокинами):
– интерлейкины: ИЛ-1а, ИЛ-1(3, ИЛ-2, ИЛ-4, ИЛ -6, ИЛ -8, ИЛ-10, ИЛ-12, ИЛ-16, ИЛ-18, ИЛ-22, ИЛ-1 -рецепторный антагонист;
– интерфероны: ИФ-а, ИФ-(3, ИФ-у;
– хемокины – факторы хемотаксиса гранулоцитов, лимфоцитов, моноцитов;
– лейкокины (лизосомальные гидролазы, катионные белки, белки острой фазы воспаления, фибронектин и др.);
– кейлоны и антикейлоны и т.д.;
– митогенные факторы – факторы, стимулирующие деление клеток;
– факторы роста – факторы, стимулирующие рост клеток и тканей;
– факторы некроза опухолей (особенно ФНОа);
– колониестимулирующие факторы – факторы, активирующие КОЕ белого, красного и тромбоцитарного ростков костного мозга;
– бактерицидные, цитолитические и другие факторы;
– оксида азот макрофагов, нейтрофилов, тромбоцитов.
– Читать далее “Локальные медиаторы воспаления. Клеточные медиаторы воспаления”
Оглавление темы “Факторы и этапы воспаления”:
1. Альтерации при воспалении. Виды альтерации
2. Обмен веществ при воспалении. Метаболические изменения при воспалении
3. Кровообращение при воспалении. Венозный стаз при воспалении
4. Эксудация при воспалении. Виды и факторы эксудата
5. Пути эксудации. Эмиграция лейкоцитов в очаг воспаления
6. Третья и четвертая стадия эмиграции лейкоцитов. Значение эмиграции лейкоцитов
7. Фагоцитоз в очаге воспаления. Этапы фагоцитоза при воспалении
8. Формы пролиферации при воспалении. Этапы пролиферации в очаге воспаления
9. Медиаторы воспаления. Классификация медиаторов воспаления
10. Локальные медиаторы воспаления. Клеточные медиаторы воспаления
Источник
