Показатели острой фазы воспаления
Белки острой фазы воспаления — это неоднородная группа белковых субстанций, которые интенсивно синтезируются при развитии острой фазы воспаления по принципу индуцибельной системы генной регуляции и являются важными компонентами врожденных механизмов резистентности.
Почти все острофазовые белки вырабатываются гепатоцитами под влиянием доиммуных цитокинов макрофагов (в первую очередь интерлейкин-6 [ИЛ-6], а также интерлейкин-1β [ИЛ-1β] и фактор некроза опухоли α [ФНО- α]).
Все острофазовые белки условно разделены на три группы (А, Б и В) и отличаются друг от друга по механизму действия. В группу А включены церулоплазмин и С3-компонент комплемента. При развитии воспаления их содержание в плазме крови возрастает на 25-50% от исходного. Группу Б составляют α1-антитрипсин, α1-антихимотрипсин, β2-макроглобулин, гаптоглобин и фибриноген. В острой фазе воспаления их уровень повышается в 2-3 раза. Перечисленные острофазовые белки играют протективную роль, максимально ограничивая самоповреждение при воспалении, обуславливая наиболее придельное, а значит, и экономное использование других факторов врожденной резистентности.
И наконец, в третью группу включены С-реактивный белок, маннозосвязывающий протеин, сывороточный белок амилоида А и интерлейкин-1β. Их уровень при воспалении увеличивается почти в 1000 раз. Такие разнородные белки объединены в единую группу, исходя из практических соображений, поскольку их содержание при воспалении резко возрастает, они используются на практике как лабораторные маркеры воспалительного процесса. Данные белки острой фазы задействованы в эффекторных механизмах. Из таких белков наиболее изученными являются С-реактивный белок и маннозосвязывающий белок. Оба фактора синтезируются гепатоцитами и обладают по крайней мере двумя свойствами, которые определяют их противомикробную активность, — способностью к опсонизации и обеспечению активации комплемента.
Церулоплазмин относится к так называемым антинутриентам — эффективно связывает медь, предотвращая поступление этого микроэлемента в микроорганизм.
Сывороточный белок амилоида А
Сывороточный белок амилоида А используется для быстрого механического заполнения дефектов, образованных вследствие некротических процессов при воспалении.
Многие острофазовые белки являются ингибиторами протеаз (например, α1-антитрипсин, α1-антихимотрипсин и β2-макроглобулин). Именно они инактивируют лизосомальные ферменты, высвобожденные из разрушенных клеток, нейтрализуют протеолитические энзимы, секретированные фагоцитами, а также обеспечивают корректную степень активации калликреин-кининовой системы и системы свертывания крови.
Гаптоглобин обеспечивает эвакуацию уцелевшего гемоглобина из очага воспаления.
Фибриноген при экссудации в периваскулярное пространство образует фибриновые сгустки, составляющие преграду для быстрого распространения воспалительного процесса, а также выполняет функцию опсонина.
С-реактивный белок (рис. 3) является своеобразным прототипом антитела и имеет высокую тропность к фосфорилхолину, лецитину и подобным им молекулам, которые широко представлены среди поверхностных структур микроорганизмов. Такие же молекулы находятся и на собственных клетках, однако они надежно экранированы от распознавания. Связавшись с указанной молекулой, С-реактивный белок может выступать в роли опсонина, облегчая распознавание инфекционного агента фагоцитами, или активировать систему комплемента по классическому пути. Дело в том, что данный фактор способен связывать Clq-компонент комплемента с последующим вовлечением всего каскада и формированием мембранатакующих комплексов.
Известно, что содержание СРБ резко возрастает при аутоиммунной патологии (в частности, при системных заболеваниях соединительной ткани). Бытует ошибочное мнение, что СРБ способствует аутоагрессии, хотя в действительности он призван ограничивать ее. Установлено, что С-реактивный протеин совершает опсонизацию и обуславливает дальнейшее разрушение экстраклеточной ДНК и клеточного детрита, которые могут стать причиной аутоиммунной атаки (scavengerfunction). Кроме этого, СРБ осуществляет экранирование наиболее распространенных аутоантигенных детерминант соединительной ткани (фибронектин, ламинин, поликатионные поверхности коллагена, липопротеины низкой и очень низкой плотности). Связываясь с этими лигандами, СРБ выполняет роль своеобразного пластыря, прикрывающего аутоантигены от распознавания и презентации, или же обеспечивает их дальнейшее разрушение, что приводит к утрате антигенных свойств. Материал с сайта https://wiki-med.com
Маннозосвязывающий лектин
Маннозосвязывающий протеин (МСП) является лектином и взаимодействует с остатками маннозы на поверхности клеточных стенок бактерий, опсонизируя их для фагоцитоза моноцитами (макрофаги как более зрелые клетки имеют мембранные маннозосвязывающие рецепторы). Данный протеин работает вместе с так называемыми лектин-ассоциированными протеазами 1 и 2. Присоединение этого фактора к микробным лигандам активирует протеазы, которые расщепляют С2- и С4-компоненты комплемента. Продукты расщепления — фрагменты С2а и С4Ь — формируют СЗ-конвертазу, которая инициирует дальнейший молекулярный каскад комплемента. Таким образом, комплекс маннозосвязывающего протеина и его лектин-ассоциированных протеаз является аналогом Cl-компонента комплемента. Но при этом активация комплемента происходит без участия иммунных комплексов, а значит, начинается сразу же после поступления инфекционного агента в организм.
В последнее время установлена важная роль МСП в аутоиммунных реакциях. Низкая экспрессия этого белка может рассматриваться как фактор риска СКВ, что связано с нарушением клиренса иммунных комплексов, которые образуются при любой инфекции. С другой стороны, МСП играет ведущую роль в аутоагрессии при ревматоидном артрите (РА). Известно, что одной из причин иммунных расстройств при РА является синтез дефектного IgG, который не содержит остатка галактозы. Это приводит к оголению N-ацетил глюкозаминовых групп, которые распознаются МСП как чужеродные, что вызывает активацию комплемента и аутоповреждение.
 На этой странице материал по темам:
На этой странице материал по темам:
белки очтрой
острофазовые белки крови
белки отстрой фазы
что такое белки острой фазы воспаления в крови
фазы воспаления имунология
Источник

ТОП 10:
Понятие “белки острой фазы” объединяет до 30 белков плазмы крови, участвующих в реакции воспалительного ответа организма на повреждение. Белки острой фазы синтезируются в печени, их концентрация существенно изменяется и зависит от стадии, течения заболевания и массивности повреждения.
Синтез белков острой фазы воспаления в печени стимулируют: 1). ИЛ-6, 2); ИЛ-1 и сходные с ним по действию (ИЛ-1 а, ИЛ-1Р, факторы некроза опухолей ФНО-ОС и ФНО-Р); 3). Глюкокортикоиды; 4). Факторы роста (инсулин, факторы роста гепатоцитов, фибробластов, тромбоцитов).
Выделяют 5 групп белков острой фазы
1. К «главным» белкам острой фазы у человека относят С-реактивный белок (СРВ) и амилоидный А белок сыворотки крови. Уровень этих белков возрастает при повреждении очень быстро (в первые 6-8 часов) и значительно (в 20-100 раз, в отдельных случаях – в 1000 раз).
2. Белки, концентрация которых при воспалении может увеличиваться в 2-5 раз в течение 24 часов. Это кислый α1-гликопротеид, α1-антитрипсин, фибриноген, гаптоглобин.
3. Белки, концентрация которых при воспалении или не изменяется или повышается незначительно (на 20-60% от исходного). Это церулоплазмин, С3-компонент комплемента.
4. Белки, участвующие в острой фазе воспаления, концентрация которых, как правило, остается в пределах нормы. Это α1-макроглобулин, гемопексин, амилоидный Р белок сыворотки крови, иммуноглобулины.
5. Белки, концентрация которых при воспалении может снижаться на 30-60%. Это альбумин, трансферрин, ЛПВП, преальбумин. Уменьшение концентрации отдельных белков в острой фазе воспаления может быть обусловлено снижением синтеза, увеличением потребления, либо изменением их распределения в организме.
Целый ряд белков острой фазы обладает антипротеазной активностью. Это α1-антитрипсин, антихимотрипсин, α2-макроглобулин. Их важная функция состоит в ингибировании активности эластазоподобных и химотрипсиноподобных протеиназ, поступающих из гранулоцитов в воспалительные экссудаты и вызывающих вторичное повреждение тканей. Снижение уровней ингибиторов протеиназ при септическом шоке или остром панкреатите является плохим прогностическим признаком.
Парапротеинемия – появление в плазме крови нехарактерных белков.
Например, во фракции α-глобулинов может появиться α-фетоглобулин, карциноэмбриональный антиген.
α-Фетоглобулин — один из фетальных антигенов, которые циркулируют в крови примерно у 70% больных с первичной гепатомой. Этот антиген выявляется также у пациентов с раком желудка, предстательной железы и примитивными опухолями яичка. Исследование крови на наличие в ней α-фетопротеина полезно для диагностики гепатом.
Карциноэмбриональный антиген (КЭА) — гликопротеид, опухолевый антиген, характерный в норме для кишечника, печени и поджелудочной железы плода. Антиген появляется при аденокарциномах органов ЖКТ и поджелудочной железы, в саркомах и лимфомах, также обнаруживается при целом ряде неопухолевых состояний: при алкогольном циррозе печени, панкреатите, холецистите, дивертикулите и язвенном колите.
ФЕРМЕНТЫ ПЛАЗМЫ КРОВИ
Ферменты, находящиеся в плазме крови, можно разделить на 3 основные группы:
1. Секреторные. Они синтезируются в печени, эндотелии кишечника, сосудов поступают в кровь, где выполняют свои функции. Например, ферменты свертывающей и противосвертывающей системы крови (тромбин, плазмин), ферменты обмена липопротеинов (ЛХАТ, ЛПЛ).
2. Тканевые. Ферменты клеток органов и тканей. Они попадают в кровь при увеличении проницаемости клеточных стенок или при гибели клеток тканей. В норме их содержание в крови очень низкое. Некоторые тканевые ферменты имеют диагностическое значение, т.к. по ним можно определить пораженный орган или ткань, по этому их еще называют индикаторными. Например, ферменты ЛДГ с 5 изоформами, креатинкиназа с 3 изоформами, АСТ, АЛТ, кислая и щелочная фосфатаза и т.д.
3. Экскреторные. Ферменты, синтезируемые железами ЖКТ (печень, поджелудочная железа, слюнные железы) в просвет ЖК тракта и участвующие в пищеварении. В крови эти ферменты появляются при повреждении соответствующих желез. Например, при панкреатите в крови обнаруживают липазу, амилазу, трипсин, при воспалении слюнных желез – амилазу, при холестазе – щелочную фосфатазу (из печени).
| Фракция | Белки | Конц г/л | Функция |
| альбумины | Транстиретин | 0,25 | Транспорт тироксина и трийодтиронина |
| Альбумин | Поддержание осмотического давления, транспорт жирных кислот, билирубина, жёлчных кислот, стероидных гормонов, лекарств, неорганических ионов, резерв аминокислот | ||
| α1-глобулины | α1-антитрипсин | 2,5 | Ингибитор протеиназ |
| Кислый α1- гликопротеин | Транспорт прогестерона | ||
| Протромбин | 0,1 | Фактор II свёртывания крови | |
| Транскортин | 0,03 | Транспорт кортизола, кортикостерона, прогестерона | |
| Тироксинсвязывающий глобулин | 0,02 | Транспорт тироксина и трийодтиронина | |
| α2-глобулины | Церулоплазмин | 0,35 | Транспорт ионов меди, оксидоредуктаза |
| Антитромбин III | 0,3 | Ингибитор плазменных протеаз | |
| Гаптоглобин | Связывание гемоглобина | ||
| α2-Макроглобулин | 2,6 | Ингибитор плазменных протеиназ, транспорт цинка | |
| Ретинолсвязывающий белок | 0,04 | Транспорт ретинола | |
| Витамин Д связывающий белок | 0,4 | Транспорт кальциферола | |
| β-глобулины | ЛПНП | 3,5 | Транспорт холестерола |
| Трансферрин | Транспорт ионов железа | ||
| Фибриноген | Фактор I свёртывания крови | ||
| Транскобаламин | 25*10-9 | Транспорт витамина В12 | |
| Глобулин связывающий белок | 20*10-6 | Транспорт тестостерона и эстрадиола | |
| С-реактивный белок | <0,01 | Активация комплемента | |
| γ-глобулины | IgG | Поздние антитела | |
| IgA | 3,5 | Антитела, защищающие слизистые оболочки | |
| IgM | 1,3 | Ранние антитела | |
| IgD | 0,03 | Рецепторы В-лимфоцитов | |
| IgE | <0,01 | Реагин |
ЛЕКЦИЯ № 23
Тема: Биохимия крови 2.
Особенности обмена в эритроцитах и лейкоцитах
Факультеты: лечебно-профилактический, медико-профилактический, педиатрический.
2 курс.
Эритроциты (erythrosytus) это форменные элементы крови, они образуются в костном мозге, циркулируют в крови около 120 дней, а потом разрушаются макрофагами в печени, селезёнке и костном мозге. В сутки обновляется 1% эритроцитов, т.е. в течение одной секунды в кровоток поступает около 2 млн. эритроцитов.
Организм взрослого человека содержит около 25*1012 эритроцитов. Концентрация эритроцитов у мужчины составляет 3,9*1012 – 5,5*1012 /л, у женщины – 3,7*1012 – 4,9*1012/л. Более высокое содержание эритроцитов у мужчин обусловлено стимулирующим эритропоэз влиянием андрогенов. Женские половые гормоны, наоборот тормозят эритропоэз.
ФункциИ эритроцитов
Основными функциями эритроцитов, которые реализуются с участием гемоглобина, являются транспорт от легких к тканям О2 и обратно СО2, а также регуляция КОС.
Кроме того эритроциты адсорбируют и транспортируют на своей клеточной мембране аминокислоты, антитела, токсины, лекарственных веществ и другие вещества.
Строение эритроцитов
Эритроциты у человека и млекопитающих в токе крови обычно (80%) имеют форму двояковогнутых дисков и называются дискоцитами. Такая форма эритроцитов создаёт наибольшую площадь поверхности по отношению к объёму, что обеспечивает максимальный газообмен, а также обеспечивает большую пластичность при прохождении эритроцитами мелких капилляров.
Диаметр эритроцитов у человека колеблется от 7,1 до 7,9 мкм, толщина эритроцитов в краевой зоне – 1,9 – 2,5 мкм, в центре – 1 мкм. В нормальной крови указанные размеры имеют 75% всех эритроцитов – нормоциты; большие размеры (свыше 8,0 мкм) – 12,5 % – макроциты. У остальных эритроцитов диаметр может быть 6 мкм и меньше – микроциты.
Поверхность отдельного эритроцита у человека приблизительно равна 125 мкм2, а объём (MCV) – 75-96 мкм3.
Эритроциты человека и млекопитающих представляют собой безъядерные клетки, утратившие в процессе фило- и онтогенеза ядро и большинство органелл, они имеют только цитоплазму и плазмолемму (клеточную мембрану), толщиной около 20 нм.
Химический состав эритроцитов
Плазмолемма эритроцитов
Плазмолемма эритроцитов состоит из примерно равного количества липидов и белков, а также небольшого количества углеводов.
Липиды
Бислой плазмолеммы образован глицерофосфолипидами, сфингофосфолипидами, гликолипидами и холестерином. Внешний слой содержит много холина (фосфатидилхолин, сфингомиелин) и около 5% (от общего количества липидов) гликолипидов, внутренний – много фосфатидилсерина и фосфатидилэтаноламина.
Белки
В плазмолемме эритроцита идентифицировано 15 главных белков с молекулярной массой 15-250 кДа. Большинство этих белков (спектрин, гликофорин, белок полосы 3, белок полосы 4.1, актин, анкирин) образуют с цитоплазматической стороны плазмалеммы цитоскелет, который придает эритроциту двояковогнутую форму и высокую механическую прочность.
Самыми распространенными белками плазмолеммы (более 60% всех мембранных белков) являютсяспектрин, гликофорин и белок полосы 3.
Спектрин – основной белок цитоскелета эритроцитов (составляет 25% массы всех мембранных и примембранных белков), имеет вид фибриллы 100 нм, состоящей из двух антипаралельно перекрученных друг с другом цепей α-спектрина (240 кДа) и β-спектрина (220 кДа). Молекулы спектрина образуют сеть, которая фиксируется на цитоплазматической стороне плазмалеммы с помощью анкирина и белка полосы 3 или актина, белка полосы 4.1 и гликофорина.
Белок полосы 3 – трансмембранный гликопротеид (100 кДа), его полипептидная цепь которого много раз пересекает бислой липидов. Белок полосы 3 является компонентом цитоскелета и анионным каналом, который обеспечивает трансмембранный антипорт для ионов НСО3- и Сl-.
Гликофорин – трансмембранный гликопротеин (30 кДа), который пронизывает плазмолемму в виде одиночной спирали. С наружной поверхности эритроцита к нему присоединены 20 цепей олигосахаридов, которые несут отрицательные заряды. Гликофорины формируют цитоскелет и, через олигосахариды, выполняют рецепторные функции.
Na+,K+-АТФ-аза мембранный фермент, обеспечивает поддержание градиента концентраций Na+ и К+ по обе стороны мембраны. При снижении активности Na+K+-АТФ-азы концентрация Na+ в клетке повышается, что приводит к увеличению осмотического давления, увеличению поступления воды в эритроцит и к его гибели в результате гемолиза.
Са2+-АТФ-аза — мембранный фермент, осуществляющий выведение из эритроцитов ионов кальция и поддерживающий градиент концентрации этого иона по обе стороны мембраны.
Углеводы
Олигосахариды (сиаловая кислота и антигенные олигосахариды) гликолипидов и гликопротеидов, расположенные на наружной поверхности плазмолеммы, образуют гликокаликс.
Олигосахариды гликофорина определяют антигенные свойства эритроцитов. Они являются агглютиногенами (А и В) и обеспечивают агглютинацию (склеивание) эритроцитов под влиянием соответствующих белков плазмы крови – a- и b-агглютининов, находящихся в составе фракции g-глобулинов. Агглютиногены появляются на мембране на ранних стадиях развития эритроцита.
На поверхности эритроцитов имеется также агглютиноген – резус-фактор (Rh-фактор). Он присутствует у 86% людей, у 14% отсутствует. Переливание резус-положительной крови резус-отрицательному пациенту вызывает образование резус-антител и гемолиз эритроцитов.
Цитоплазма эритроцитов
В цитоплазме эритроцитах содержится около 60% воды и 40% сухого остатка. 95% сухого остатка составляет гемоглобин, он образует многочисленные гранулы размером 4-5нм. Оставшиеся 5% сухого остатка приходятся на органические (глюкоза, промежуточные продукты ее катаболизма) и неорганические вещества. Из ферментов в цитоплазме эритроцитов присутствуют ферменты гликолиза, ПФШ, антиоксидантной защиты и метгемоглобинредуктазной системы, карбоангидраза.
Источник
Ответ
острой фазы – это комплекс последовательных
реакций, инициируемых физическими,
химическими, биологическими повреждающими
воздействиями или опухолевым процессом.
Принято
считать, что через 3-15
часов
после первичной альтерации на фоне
нейтрофилии повышается количество и
активность моноцитов, а затем и лимфоцитов
(возникает первичный иммунный ответ),
что и является началом ООФ, достигающего
максимума через 1-2
суток,
затем медленно ослабевающего и
заканчивающегося (в зависимости от
характера и выраженности как первичной,
так и вторичной альтерации) через 1-3
недели.
Субъективными
проявлениями ответа острой фазы являются:
сонливость, потеря аппетита (анорексия),
безразличие к окружающему (апатия), боли
в мышцах (миалгии), боли в суставах
(артралгии).
Объективные
проявления ответа острой фазы:
1.Изменения
со стороны крови:
1.1.нейтрофильный
лейкоцитоз с регенеративным сдвигом
влево
1.2.
увеличение СОЭ за счет снижения
поверхностного заряда эритроцитов,
который снижается из-за оседания
глобулинов и фибриногена на поверхности
эритроцитов, а также Н+
нейтрализуют отрицательный заряд
эритроцитов, происходит их агрегация,
снижение СОЭ.
1.3.Диспротеинемия:
гипоальбуминемия, гипергаммаглобулинемия,
появление в крови белков ответа острой
фазы (БОФ),
1.4.
снижение содержания железа (гипосидеремия),
цинка и увеличение концентрации меди
в сыворотке крови
1.5.
активация системы комплемента, активация
системы свертывания крови
2.лихорадка,
3.Развитие
общего адаптационного синдрома
4.активация
клеток иммунной системы
С биологических позиций ООФ следует
рассматривать как естественную
эволюционно сформированную реакцию
организма, цель которой заключается в
предотвращении тканевого повреждения,
изоляции и разрушении повреждающего
агента, а также в активации репаративных
процессов, необходимых для восстановления
нормальных жизненных функций. В ответ
на первичную альтерацию в развитии
воспалительного процесса наиболее
быстро (уже в течение 1-2 ч) активизируются
и эмигрируют из крови в очаг воспаления
нейтрофилы. Они осуществляют выраженное
местное защитное действие, проявляющееся
в пиноцитозе веществ, фагоцитозе
микроорганизмов, продуктов распада
тканей, токсинов, а также в высвобождении
и активации гидролаз, свободных радикалов
кислорода, перекисей, катионных белков
и других антимикробных и антитоксических
веществ. Через 3-15 ч после первичной
альтерации в очаге воспаления на фоне
нейтрофилии сначала повышается количество
и активность моноцитов, а затем и
лимфоцитов (раньше Т-, позже В-лимфоцитов),
т.е. возникает так называемый первичный
иммунный ответ. Фактически это и есть
начало ответа ООФ, достигающего максимума
через 1-2 сут, затем медленно ослабевающего
и заканчивающегося (в зависимости от
характера и выраженности как первичной,
так и вторичной альтерации) через 1-3
нед. Через выделение различных цитокинов
сначала нейтрофилы, а позже эндотелиоциты,
моноциты, гистиоциты, лимфоциты и
фибробласты начинают участвовать не
только в местных, но и в системных
реакциях, в том числе в активизации
различных звеньев и всей системы
иммунитета, а также гипофиза, надпочечников
и других различных как регуляторных,
так и исполнительных систем.
При
воспалении в крови изменяется содержание
белков ответа острой фазы (БОФ). Выделяют
две группы БОФ:
1) негативная
группа – концентрация БОФ снижается
(альбумин,трансферрин);
2) позитивная
группа – концентрация БОФ нарастает в
2-10 раз (альфа-1-антитрипсин, альфа-1-
антихимотрипсин, фибриноген, гаптаглобин);
менее чем в 2 раза (церулоплазмин, Сз
компонент комплемента, инактиватор
С1компонента
комплемента) и более, чем в 1000 раз (С –
реактивный белок (СРБ),сывороточный
амилоидный протеин А(САП-А)).
Белки
ООФ при остром экссудативно-деструктивном
воспалении (Д.Н.
Маянский, 2008)
Тип | Функции |
С1, | Опсонизация, |
Калликреин | Повышение |
Плазминоген | Активация |
С-реактивный | Регуляция |
Церулоплазмин | Нейтрализация |
а1-кислый | Регуляция |
а1- | Тормозит |
а | Тормозит |
а | Тормозит |
Гаптоглобин | |
Сывороточный |
СРБ
– наиболее популярен из всех БОФ, однако
интерпретация титров этого белка сложна,
так как его количество может не отражать
интенсивности воспалительного процесса.
В норме концентрация его составляет от
0,1 до 8,0 мг/л. Уровень СРБ достигает
максимума на 2-3-й день воспалительного
процесса и постепенно возвращается к
исходному значению на 12-15-е сутки.
При
затяжном и хроническом воспалении
содержание СРБ сохраняется на высоком
уровне.
К
наиболее чувствительным БОФ относятся
САП-А. Затем, по убыванию располагаются
СРБ, а-1-химотрипсин, церулоплазмин,
а-1-кислый гликопротеид. Определение
гаптаглобина или фибриногена
малоинформативно. При тяжелых формах
воспаления, особенно гепатитах, синтез
БОФ снижается. В этом случае их титр не
будет соответствовать активности
воспалительного процесса.
В
учебниках и руководствах по патологии
подробно рассматривается структурные,
метаболические и функциональные
изменения в очаге воспаления и мало
уделяется внимания на причины и патогенез
системных изменений.
Патогенез
системной реакции организма при
воспалении (по
Ю.С. Свердлову, 2000)
Повреждение
тканей (инфекция,
травма, распад опухоли, некроз, комплекс
антиген-антитело и др.)

 Воспаление
Воспаление
(освобождение
ИЛ –
1, ИЛ
–
6, ИЛ
–
8, ФНО
-а, ИНФ-у)
Системные
реакции
Нервная
Эндокринная Печень
Костный
Активация
система система мозг лимфоцитов
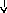
(активация
Гипоталамус
Гипофиз БОФ Лейкоцитоз,
иммунитета)
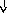

ретикулоцитоз
Лихорадка
АКТГ
В
настоящее время принято считать, что
реализацию системных изменений в
организме при воспалении осуществляют:
интерлейкин-1, интерлейкин-6, интерлейкин-8,
фактор некроза опухолей, интерфероны,
фактор ингибирования лейкемии, онкостатин
М, цилиарный нейтрофический фактор,
трансформирующий фактор роста в, а так
же глюкокортикоиды.
В
настоящее время показано, что инсулин
действует как ингибитор цитокиновой
индукции некоторых БОФ.
Интерлейкин-1
представлен двумя полипептидами ИЛ-1-а
и ИЛ-1-в, последний у человека преобладает.
Стимуляторами выделения ИЛ-1 являются
компоненты клеточных стенок бактерий
(липополисахарид) и медиаторы воспаления,
выделяемые активированными клетками.
Больше всего ИЛ-1 вырабатывают макрофаги.
На всех клетках организма имеются
рецепторы к ИЛ-1, и это обуславливает
его разнообразные эффекты на организм.
Обладая снотворным действием, этот
цитокин вызывает снижение работоспособности,
гиподинамию; стимулирует продукцию
кортикотропина и кортикостероидов,
подавляет гипоталамическую секрецию
соматолиберина и стимулирует выработку
соматостатина, что вызывает ослабление
анаболизма, протеолиз и освобождение
аминокислот из скелетных мышц, усиление
секреции синовиальной жидкости и
резорбтивные изменения в костях и
хрящах, что проявляется костно-мышечно-суставными
болями, а также снижение продукции
инсулина.
Фактор
некроза опухолей, образуется в виде
двух фракций. ФНО-а (кахектин) вырабатывается
макрофагами, лимфоцитами, тучными
клетками и микроглией. ФНО-в (лимфокин)
образуется лимфоцитами. Кахектин
является мощным пирогеном, тормозит
активность центра голода и стимулирует
центр насыщения в гипоталамусе, что
ведет к потере веса, обладает сильным
контринсулярным эффектом, стимулирует
синтез белков острой фазы печени,
индуцирует апоптоз гепатоцитов и клеток
желудочно-кишечного тракта.
ФНО
и ИЛ-1 особенно токсичны при совместном
действии, они способны блокировать
мембранное пищеварение и перистальтику
кишечника, провоцировать рвоту, понос,
вызывать дисфункцию гепатоцитов,
гиперкалиемию и ацидоз, а при массированном
освобождении приводить к летальности,
способствуя развитию ДВС-синдрома. Они
стимулируют эндотелий к продукции
прокоагулянтов, окиси азота и
миокардиального депрессорного фактора,
который вызывает снижение сократимости
миокарда.
ИЛ-6
– важнейший индуктор синтеза белков
острой фазы. Мишенью его действия служат
гепатоциты, тимоциты и лимфоциты. Он
также стимулирует гемопоэз, вызывая
продукцию гранулоцитов, моноцитов,
тромбоцитов, эритроцитов.
ИЛ-8
– это семейство пептидов, которые
вырабатываются макрофагами и клетками
кожи по сигналу ИЛ-6. Он усиливает
хемотаксис и краевое стояние лейкоцитов,
стимулирует освобождение дефензинов
из нейтрофилов.
В
ряде случаев системных проявлений
острого воспалительного процесса может
не быть, хотя различные органы организма
реагируют на повреждение. Это наблюдается
при достаточно быстрой активизации
антимедиаторной системы.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
02.05.201534.57 Mб302008Руководство по кардиологии.pdf
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
