Последовательность клеточных реакций при остром воспалении
Фагоцитоз – это способность определенных клеток (фагоцитов) удерживать и переваривать плотные частицы. Это явление было открыто И. Мечниковым.
Фагоцитоз осуществляется микрофагами (нейтрофилами) и системой мононуклеарных макрофагов.
Мононуклеарные макрофаги
Система (MMS) включает следующие элементы:
- промоноциты (костный мозг);
- моноциты (кровь);
- тканевые макрофаги;
- гистиоциты соединительной ткани;
- печеночные клетки Куппера;
- легочные альвеолярные макрофаги;
- свободные и фиксированные макрофаги лимфатической ткани;
- плевру и перитонеальные макрофаги.
Клетки мононуклеарной системы объединяет общее происхождение гемопоэтических клеток и саморегуляция.
Моноцитопоэз
Моноцитопоэз – это стимулирующий фактор колонии фибробластов и фактор роста макрофагов, но он же подавляет (отрицательная саморегуляция) интерферон фибробластов и лейкоцитов и т. д.
Процесс фагоцитоза делится на четыре стадии:
- Приближение.
- Адгезия.
- Оседание;
- Стадия пищеварения.
Фаза приближения
Фагоцит приближается к объекту – бактериям, мервому клеточному элементу, инородному объекту. При движении под действием хемотаксиса цитоплазма фагоцита образует удлинения (псевдоподии).
Адгезия
Способствует образованию аминополисахаридов на поверхности фагоцитов и перекрытию фагоцитарного объекта белками сыворотки, особенно иммуноглобулинами. Последний механизм по сути является опсонизацией – бактерии и поврежденные клетки перекрываются с IgM, IgG и компонентами комплемента (C3, C5 и др.), что облегчает адгезию к фагоциту.
Адгезия
Поверхность фагоцита заряжена отрицательно, поэтому адгезия лучше, если объект, подлежащий фагоцитозу, заряжен положительно. Менее фагоцитарны отрицательно заряженные объекты, такие как опухолевые клетки.
Оседание
Этап фагоцитации объекта – путь инвагинации. Сначала фагоцит образует углубление, а затем фагосому – вакуоль, содержащую объект, подлежащий фагоцитозу. НАДН-зависимая оксидаза в мембране фагоцитов активируется до образования фагосом; в результате O2 превращается в O 2 ~ (супероксид-анион) и образуется H 2 O 2.
Эти продукты обладают бактерицидным действием, а также вызывают образование свободных радикалов. Под действием пероксидаз и каталаз H 2 O 2 расщепляется и высвобождается молекулярный O 2. Свободные радикалы и активный молекулярный O 2 действуют на мембрану фагоцита и объект, подлежащий фагоцитозу, активируя перекисное окисление липидов.
Липопероксиды и свободные радикалы неустойчивы к лизосомным мембранам и способствуют высвобождению лизосомальных ферментов.
Стадия пищеварения
Лизосомы присоединяются к фагосоме, содержащей фагоцитарный объект. Эти органеллы содержат все ферменты, необходимые для расщепления углеводов, белков, жиров и нуклеиновых кислот. В еще неактивной форме они попадают в вакуоль фагоцитов.
Пищеварительная вакуоль образуется при pH около 5,0, близком к оптимальному для лизосомальных ферментов. Активируются лизосомальные ферменты, и фагоцитарный объект постепенно переваривается. Во время стадии пищеварения проницаемость мембраны фагосомы увеличивается, содержимое фагосомы ускользает в цитоплазму, и микрофаг умирает (этому процессу способствует ацидоз). В этом случае фагоцитарный микроорганизм также может сохранять жизнеспособность.
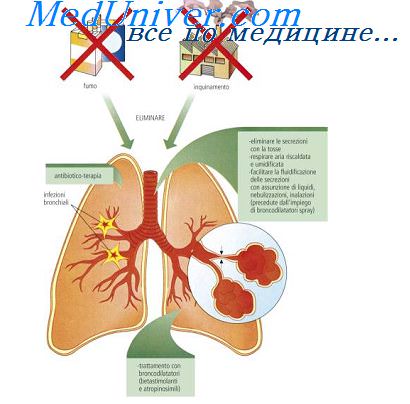
Роль макрофагов в воспалительном процессе
Макрофаги начинают участвовать в фагоцитозе позже микрофагов. Макрофаги также более устойчивы к гипоксии и ацидозу, например, моноциты жизнеспособны даже при pH 5,5.
В очаге воспаления макрофаги выполняют несколько функций:
- Фагоцитируют бактериальные остатки, оставшиеся после эвакуации гноя и продуктов распада тканей – очищающая функция;
- Высвобождают лизосомальные ферменты – гиалуронидазу, аминопептидазу и др;
- Синтезируют компоненты системы комплемента и простагландины.
Взаимодействие макрофагов и лимфоцитов при хроническом воспалении
В то же время воспаленная тканевая среда также стимулирует образование фибробластов и фиброцитов. Постепенно появляется новая, богатая сосудами грануляционная ткань.
Фагоцитоз стимулируется продуктами повреждения тканей – внутриклеточные белки, ферменты, полипептиды, аминокислоты, электролиты и т. д., биологически активными веществами, половыми гормонами, тироксином, адреналином, лихорадкой. Но подавляется недостатком стимулирующих факторов, глюкокортикоидов, гликолортикоидов, ацетилхолина, ацетилхолина.
Фагоцитоз
Считается, что клетки плаценты и злокачественные опухоли способны секретировать вещество, которое подавляет функцию макрофагов, иммунологические реакции лимфоцитов и эмиграцию лейкоцитов, что приводит к значительному ослаблению или даже прекращению воспаления.
Объекты, которые фагоциты не могут переваривать, остаются в этих клетках в течение длительного времени и покрываются тонкой пленкой аминополисахаридов. После гибели фагоцитов они повторно фагоцитируются или выводятся из организма. Процесс, при котором фагоцит после переваривания высвобождает часть продуктов своего фагоцитоза в окружающую среду, называется экструзией.
Фагоцитоз – не единственный в организме механизм борьбы с воспалением. Большинство микроорганизмов погибают в условиях ацидоза, а также от ферментов, высвобождаемых во время гибели клеток и функционирования иммунокомпетентной системы.
Нейтрофилы во внеклеточном пространстве секретируют катионные белки, которые могут убивать ферменты без ферментов и фагоцитоза. Таким образом, воспалительные очаги постепенно избавляются от микроорганизмов и мертвых клеток.
Асептическое и острое воспаление
Дальнейшее течение воспаления зависит от того, является ли воспаление асептическим или бактериальным.
В асептических воспалительных условиях, например, вокруг хирургического шва, инородного тела, стенка микрофагов (нейтрофилов) начинает формироваться в течение нескольких часов, достигая максимума в течение дня.
Позже появляется следующий вал макрофагов, который достигает максимума через 2-3 раза. в день. Эмигрировавшие лейкоциты постепенно становятся неподвижными, больше не могут делиться и погибают в течение 3-5 дней. 2-3. на 5 сутки начинает формироваться стенка фибробластов, а на 5 сутки – соединительнотканная капсула.
Таким образом, в случае острого воспаления патогенный агент в организме преобразует белки, которые участвуют в реакции антиген-антитело, медиаторы и модуляторы воспаления, систему фагоцитов и миграцию клеток. В результате заканчивается острое воспаление. Однако, если инфекционные агенты попадают в участок асептического воспаления, например, в результате травмы, это воспаление становится септическим (бактериальным) воспалением.
Бактериальные воспалительные состояния бактерий и токсинов, не вызывающие гиперемии, экссудации и эмиграции лейкоцитов. Между клетками воспаленных тканей и особенно вокруг кровеносных сосудов накапливается все больше и больше микрофагов. Лизосомы микрофагов содержат множество активных ферментов, и эти клетки также начинают процесс фагоцитоза. При пальпации воспаленная ткань в это время кажется плотной, поэтому это называется стадией воспалительной инфильтрации.
По мере прогрессирования воспаления лейкоциты и те тканевые клетки, которые претерпели необратимые изменения во время воспаления, погибают. В этих клетках высвобождаются лизосомальные ферменты, которые расщепляют тканевые белки, белковые и липидные комплексы и другие структуры. Это стадия гнойного размягчения воспаления.
Эти стадии наблюдаются, например, у пациентов с гнойным воспалением перикарда (фурункул), гнойным воспалением апокринных потовых желез (гидраденит) и гнойным воспалением соединительной ткани (флегмона). При вдыхании воспаленная ткань выглядит мягкой, с характерным раскачиванием – флюктуацией. Образуется замкнутое скопление гноя – абсцесс.
Гнойное воспаление перикарда
Гной разрывается в направлении наименьшего сопротивления (либо наружу, либо внутри тела). Если гной попадает в кровоток (пемия), в организме может развиться множество очагов гноя, но под действием микроорганизмов и токсических веществ – угрожающее общее заболевание (сепсис, септикопиемия). Поэтому важно диагностировать накопление гноя и обеспечить хирургический дренаж гноя наружу.
Продолжение статьи
- Часть 1. Этиология и патогенез воспаления. Классификация.
- Часть 2. Особенности обмена веществ при воспалении.
- Часть 3. Физико – химические изменения. Роль нервной и эндокринной систем в развитии воспаления.
- Часть 4. Изменения в периферическом кровообращении при воспалении.
- Часть 5. Экссудация. Экссудат и транссудат.
- Часть 6. Эмиграция лейкоцитов. Хемотаксис.
- Часть 7. Фагоцитоз. Асептическое и острое воспаление.
- Часть 8. Распространение. Последствия. Принципы лечения воспаления.
Поделиться ссылкой:
Источник
Воспаление (лат. inflammatio) – это сложный процесс реакции организма на внешний или внутренний повреждающий (болезненный) фактор. Воспаление направлено на устранение этого фактора, восстановление поврежденных тканей и защиту от развития заболеваний.
Таким образом, воспаление выполняет защитную функцию в организме, но только тогда, когда оно острое. Хроническое воспаление перестает быть физиологическим фактором и становится патогеном, ведущим к аутоиммунным заболеваниям и раку.
Воспаление – это естественный процесс, который происходит на определенных этапах. Без воспалительной реакции, которая активирует иммунную систему для борьбы с патогеном, например, вирусом, бактериями, травмированными участками, мы не смогли бы пережить даже самую маленькую инфекцию.
Сложность воспалительного процесса отражается в часто используемых терминах – состояние, процесс или воспалительная реакция.
Симптомы воспаления
Симптомы острого воспаления были впервые описаны римским ученым и энциклопедистом Аврелием Цельсом (25 г. до н.э. – 50 г. н.э.). в единственной работе «Медицина», которая сохранилась до наших дней, он описал четыре основных симптома острого воспаления, которые иногда называют тетрадой Цельса:
- боль (лат. dolor);
- повышенная температура (лат. calor);
- покраснение (лат. rubor);
- отек (лат. tumor).
Пятый признак воспаления – потеря функции и повреждение органов (лат. Functiolaesa) был добавлен немного позже, возможно, греческим врачом и философом Галеном (129-200 н.э).
Покраснение кожи является результатом увеличения кровотока в области, пораженной патогенными микроорганизмами, отек – это результат проникновения белка и клеток из сосудов в ткани – все это вызывает боль. Температура также является следствием увеличения кровотока. В свою очередь, «потеря функции» означает, что орган не функционирует должным образом.
В развитии воспалительной реакции участвуют многие физиологические механизмы, связанные как с клетками – гранулоцитами, моноцитами, тромбоцитами, лимфоцитами Т и В, тучными клетками, эндотелиальными клетками кровеносных сосудов, макрофагами, фибробластами, так и с веществами, выделяемыми ими – медиаторами воспаления. Со временем могут быть поражены целые органы и могут возникнуть системные симптомы – повышение температуры тела, потеря веса, мышечная атрофия, чувство общей слабости.
Воспаление при ларингите
Как возникает воспаление?
Чаще всего повреждающий фактор, который инициирует воспалительный процесс, приходит извне. Это может быть:
- физическое повреждение – химическое, тепло или холод, механическая травма;
- биологический агент – бактерии, вирус, чужеродный белок.
Также бывает, что причиной воспаления является процесс, происходящий внутри организма – эмболия артерии, сердечный приступ или развитие рака.
Изменения в кровеносных сосудах всегда являются корнем воспалительной реакции. Сосуды расширяются, и их проницаемость увеличивается. Это приводит к проникновению медиаторов и воспалительных клеток в окружающие ткани.
Составляющие воспаления
Острое воспаление выполняет важную защитную функцию – оно удаляет возбудителя и восстанавливает нормальную функцию органа. Переход острой фазы в хроническую фазу часто связан с потерей контроля организма над воспалительными механизмами и, следовательно, с функциональными нарушениями и даже повреждением пораженной ткани. Этот процесс можно сравнить с превращением острой боли (защитной функции) в хроническую боль, которая становится самой болезнью.
Патогенез воспалительного процесса
Воспалительная реакция неразрывно связана с иммунным ответом. Начинается с контакта патогена со специализированными клетками иммунной системы, так называемыми антигенпрезентирующие клетки. Когда клетки стимулируются, они продуцируют и высвобождают медиаторы воспаления, которые имеют решающее значение для инициации и поддержания воспалительного процесса.
Медиаторы оказывают про-и противовоспалительное действие на клетки-мишени, модулируя течение воспаления. Со временем адаптивная иммунная система (специфическая реакция) также участвует в борьбе с повреждающим фактором. Работа этой системы чрезвычайно точна – взаимодействие лимфоцитов Т и В приводит к выработке специфических антител, которые селективно нейтрализуют возбудителя.
Правильно функционирующая иммунная система эффективно распознает патогены и эффективно уничтожает их, не повреждая свои собственные клетки и ткани. Однако в определенных ситуациях иммунорегуляторные механизмы могут работать с дефектом – возникает воспалительная реакция на аутоантигены.
Это состояние встречается при многих аутоиммунных заболеваниях (диабет 1 типа, ревматоидный артрит, красная волчанка, целиакия, болезнь Хашимото).
Поделиться ссылкой:
Источник
Клеточные механизмы защитных реакций организма при воспалении.Основные закономерности развития необратимых патологических изменений в клетках при первичной и вторичной альтерации Рассматривая воспаление как типовой патологический процесс, протекающий в виде последовательно сменяющих друг друга, а в ряде случаев развивающихся параллельно стадий альтерации, экссудации и пролиферации, необходимо отметить, что при определенных условиях течение воспалительных реакций может иметь как преимущественно защитно-приспособительный, так и разрушительный характер. Воздействие на ткани различных по своей природе факторов (химических, физических, бактериальных), как правило, приводит к развитию первичной альтерации. Степень выраженности и распространенность альтеративных изменений определяется интенсивностью действующего фактора, устойчивостью клеток к этому воздействию и способностью клеточных механизмов компенсировать патологические изменения. Повреждение ткани сопровождается выделением биологически активных веществ, способных еще в большей степени увеличивать альтеративные процессы – вызывать вторичную альтерацию. Независимо от особенностей воздействующего фактора, индуцирующего воспалительный процесс, все изменения в клетках можно свести к следующим типам:
Деструктивные процессы в тканях, возникающие в альтернативной стадии (фазе) воспаления, имеют преимущественно патологический характер. Их выраженностью в значительной степени определяется возможная степень неблагоприятного течения воспалительного процесса в целом. При обратимых сублетальных изменениях клетка способна адаптироваться и восстанавливать свою структуру и функцию. В этом случае, как правило, происходит снижение интенсивности метаболических процессов, ограничение потребления кислорода, угнетение процессов окислительного фосфорилирования, активирование гликолиза, уменьшение запасов макроэргических фосфорных соединений, падение уровня активности K-Na-АТФ-азы, ингибирование внутриклеточных ферментов, активирующих анаболические процессы. В процессе необратимого повреждения клетки наблюдается постепенное увеличение объема внутриклеточных структур (расширение эндоплазматической сети, набухание митохондрий, увеличение объема лизосом). Летальные изменения в клетках сопровождаются повреждением наружной и внутриклеточных мембран, в результате чего повышается их пассивная проницаемость для ионов. Одним из кардинальных признаков повреждения клетки является увеличение содержания натрия в цитозоле и выход во внеклеточную среду калия. Тяжелые метаболические расстройства клеточных функций сопровождаются увеличением содержания кальция в цитозоле. В нормальных условиях в цитоплазме регистрируется низкая концентрация кальция, не превышающая 10″‘ моль/л, которая обеспечивается непрерывной работой Са-АТФаз. Основные запасы кальция содержатся в эндоплазматическом ретикулуме, большая часть мембраны которого плотно покрыта белком с молекулярной массой 110 кДа, являющегося Са-насосом. Концентрация кальция в эндоплазматическом ретикулуме в 10 000-100 000 раз выше чем в цитозоле. Деполяризация клеточной мембраны и гидролиз мембранных липидов сопровождаются раскрытием кальциевых каналов, по которым кальций из внутриклеточных депо (цистерн эндоплазматического ретикулума, митохондрий) или интерстициального пространства устремляется в цитозоль. Возникающие в ходе воспаления метаболические нарушения энергообеспечения работы транспортных систем клеток изменяют нормальное протекание процессов реабсорбции кальция, который устремляется из кальцийсодержащих структур и внеклеточной среды в цитозоль по механизмам пассивного транспорта. – Также рекомендуем “Изменения клеток при альтеративной стадии воспаления.” Оглавление темы “Ключевые механизмы воспаления легких.”: |
Источник
