Последствия ацидоза в очаге воспаления
Оглавление темы “Изменения клеток при воспалении.”:
1. Изменение клеток при воспалении. Изменение морфологии и обмена веществ при воспалении.
2. Метаболизм углеводов при воспалении. Нарушение обмена углеводов при воспалении.
3. Метаболизм липидов при воспалении. Нарушение обмена липидов при воспалении.
4. Метаболизм белков при воспалении. Нарушение обмена белков при воспалении.
5. Метаболизм ионов и воды при воспалении. Нарушение обмена ионов и воды при воспалении.
6. Физико-химические изменения в очаге воспаления. Ацидоз.
7. Гиперосмия в очаге воспаления. Гиперонкия в очаге воспаления.
8. Изменение поверхностного натяжения мембран в очаге воспаления. Изменения коллоидного состояния цитозоля в очаге воспаления.
9. Медиаторы воспаления. Виды медиаторов воспаления.
10. Биогенные амины. Серотонин. Адреналин. Норадреналин.
Основные физико-химические изменения в очаге воспаления перечислены на рисунке.
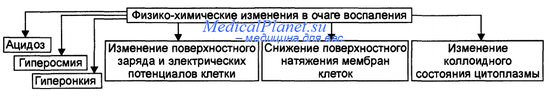
Физико-химические изменения в очаге воспаления.
Ацидоз в очаге воспаления
Воспалительная реакция характеризуется увеличением [Н+] и, соответственно, снижением рН в клетках и межклеточной жидкости — развитием ацидоза.
Причина ацидоза
Причина метаболического ацидоза — накопление в очаге воспаления избытка недоокисленных соединений.
Механизмы развития метаболического ацидоза
• Образование большого количества «кислых» продуктов изменённого метаболизма вследствие:
– активации гликолиза, что сопровождается накоплением избытка молочной и пировиноградной кислот;
– усиления протеолиза и липолиза с накоплением аминокислот, ВЖК и КТ.
• Нарушение оттока из очага воспаления продуктов как нормального, так и нарушенного обмена веществ. Последнее особенно выражено в связи с замедлением оттока венозной крови и развитием стаза в очаге воспаления.
• Истощение щелочных буферных систем (бикарбонатной, фосфатной, белковой и др.) клеток и межклеточной жидкости, которые на начальном этапе воспаления нейтрализуют избыток кислых соединений.
Особенности изменения [Н+] в очаге воспаления
• Чем острее протекает воспаление, тем более выражен ацидоз: из компенсированного он быстро трансформируется в некомпенсированный.
• Как правило, [Н+] наибольшая в зоне первичной альтерации, она меньше в прилегающей к ней зоне вторичной альтерации и постепенно снижается по направлению к неповреждённой ткани.
• В отдельных участках интенсивной деструкции и аутолиза тканей, где накапливаются восстановленные органические и неорганические соединения, продукты промежуточного белкового распада (аммиак и его производные), может развиваться более или менее выраженный преходящий алкалоз. Однако в целом для очага воспаления характерен ацидоз.

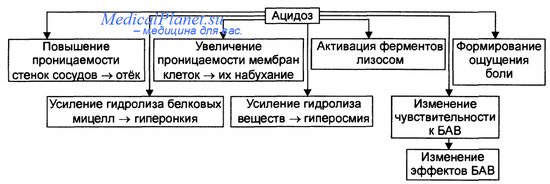
Эффекты ацидоза в очаге воспаления
Последствия ацидоза
Последствия метаболического ацидоза в очаге воспаления приведены на рисунке.
• Повышение проницаемости клеточных мембран, в том числе плазмо-леммы и лизосом, приводит к выходу гидролаз в цитозоль и межклеточное вещество.
• Активация лизосомальных ферментов сопровождается усилением деструкции клеточных и неклеточных структур в очаге воспаления.
• Повышение проницаемости стенок сосудов за счёт усиления неферментного и ферментного гидролиза компонентов межклеточного матрикса, включая базальные мембраны.
• Формирование ощущения боли в очаге воспаления в связи с раздражением и повреждением чувствительных нервных окончаний в условиях избытка Н+.
• Усиление гидролиза солей и органических соединений ведёт к повышению осмотического и онкотического давления, изменяет коллоидное состояние цитозоля.
• Изменения чувствительности рецепторных структур клеток (в том числе стенок микрососудов) к регуляторным факторам (гормонам, нейромеди-аторам, другим БАВ) сопровождаются нарушениями регуляции тонуса сосудистой стенки. Так, на стадии альтерации в очаге воспаления, как правило, снижается чувствительность рецепторов к адреномиметикам (в частности, к норадреналину) и повышается к холиномиметическим агентам.
– Читать далее “Гиперосмия в очаге воспаления. Гиперонкия в очаге воспаления.”
Источник
Последствия метаболического ацидоза в очаге воспаления приведены на рисунке 6-7.
Ы верстка! вставить рисунок «рис-6-7» Ы
Рис. 6-7. Эффекты ацидоза в очаге воспаления.
Гиперосмия
В очаге воспаления закономерно, в большей или меньшей степени, повышается осмотическое давление.
Причины гиперосмии:
Ú повышенное ферментативное и неферментное разрушение макромолекул (гликогена, гликозаминогликанов, протеогликанов и др.);
Ú усиленный в условиях ацидоза гидролиз солей и соединений, содержащих неорганические вещества;
Ú поступление осмотически активных соединений из поврежденных и разрушенных клеток.
Гиперосмия обусловливает:
Ú гипергидратацию в очаге воспаления;
Ú повышение проницаемости сосудистых стенок;
Ú стимуляцию эмиграции в зону воспаления лейкоцитов;
Ú изменение тонуса стенок сосудов и кровообращения;
Ú формирование чувства боли.
Гиперонкия
Увеличение онкотического давления в воспаленной ткани — закономерный феномен.
Причины гиперонкии:
Ú увеличение концентрации белка в очаге воспаления в связи с усилением ферментативного и неферментного гидролиза пептидов;
Ú повышение гидрофильности белковых мицелл и других коллоидов в результате изменения их конформации при взаимодействия с ионами;
Ú выход белков (в основном альбуминов) из крови в очаг воспаления в связи с повышением проницаемости стенок микрососудов.
Основное последствиегиперонкии в очаге воспаления — это развитие отека.
Поверхностный заряд и электрические потенциалы клеток
Альтерация тканей при воспалении ведет к изменению (как правило — снижению) их поверхностного заряда, а также мембранных потенциалов возбудимых клеток.
Причинынарушений заряда и потенциалов мембран клеток:
Ú повреждение клеточных мембран;
Ú расстройства энергообеспечения трансмембранного переноса ионов;
Ú ионный баланс во внеклеточной жидкости.
Основные последствияотклонения мембранных потенциалов клеток в очаге воспаления:
Ú изменения порога возбудимости клеток;
Ú колебание чувствительности клеток к действию БАВ (цитокинов, гормонов, нейромедиаторов и других);
Ú потенцирование миграции фагоцитов за счет электрокинеза (см. рис. 6-20);
Ú стимуляция кооперации клеток в связи со снижением величины их отрицательного поверхностного заряда, нейтрализацией его или даже перезарядкой (у поврежденных и погибших клеток внешняя поверхность цитолеммы заряжена положительно в связи с избытком на ней К+, Н+ и других катионов).
Поверхностное натяжение мембран клеток
Для очага воспаления характерно уменьшение поверхностного натяжения клеточных мембран.
Основная причина этого— значительное увеличение концентрации в очаге воспаления поверхностноактивных веществ (фосфолипидов, ВЖК, K+, Ca2+ и некоторых других).
Основными последствиямиуменьшения поверхностного натяжения клеточных мембран при воспалении считают:
Ú облегчение подвижности лейкоцитов (уменьшение поверхностного натяжения плазмолеммы способствует образованию псевдоподий);
Ú потенцирование процесса адгезии фагоцитов к объекту фагоцитоза;
Ú облегчение контакта фагоцитов и лимфоцитов при развитии реакций иммунитета и аллергии.
Коллоидное состояние цитозоля и межклеточного вещества
Изменения коллоидного состояния цитозоля и межклеточного вещества выявляются уже на начальном этапе воспаления.
Причина этого— накопление избытка Н+, K+, Na+, жирных кислот, пептидов, аминокислот, других метаболитов и БАВ (наряду с изменением степени гидратации цитоплазмы) приводит к облегчению переходов цитозоля: «гель–золь». В наибольшей степени такая трансформация характерна для фагоцитов.
Основные механизмы изменения коллоидного состояния в очаге воспаления:
Ú колебание степени полимеризации макромолекул (гликозаминогликанов, белков, протеогликанов и других);
Ú фазовые переходы состояния микрофиламентов интерстиция. Переход цитозоля в состояние геля происходит при образовании из нитей F-актина упорядоченной структуры (актиновая решетка). Такая структура формируется при перекрестном соединении нитей актина с участием актинсвязывающих белков и при низкой концентрации Ca2+. При увеличении в цитозоле содержания Ca2+ процесс формирования актиновой решетки подавляется, цитоплазма приобретает состояние золя.
Главные последствияизменений коллоидного состояния цитозоля и интерстиция заключается в изменении тканевой проницаемости (в основном стенок микрососудов) и потенцировании процесса миграции лейкоцитов к объекту фагоцитоза.
Медиаторы воспаления
Образование и реализация эффектов БАВ — одно из ключевых звеньев воспаления. БАВ обеспечивают закономерный характер развития воспаления, формирование его общих и местных проявлений, а также исходы воспаления. Именно поэтому БАВ нередко именуют как «пусковые факторы», «организаторы», «внутренний двигатель», «мотор» воспалительной реакции, «медиаторы воспаления».
| Медиаторы воспаления: |
| БАВ, образующиеся при воспалении, |
| обеспечивающие закономерный характер его развития и исходов, |
| формирование его местных и общих признаков |
Все медиаторы воспаления и их неактивные предшественники образуются в клетках организма. Выделяют клеточные и плазменные медиаторы воспаления (рис. 6-8).
Ы верстка! вставить рисунок «рис-6-8» Ы
Рис. 6-8. Виды медиаторов воспаления.
Клеточные медиаторы высвобождаются в очаге воспаления уже в активированном состоянии непосредственно из клеток, в которых они синтезировались и накопились.
Плазменные медиаторы образуются в клетках и выделяются в межклеточную жидкость, лимфу и кровь, но не в активном состоянии, а в виде предшественников.Эти вещества активируются под действием различных промоторов преимущественно в плазме крови. Они становятся физиологически дееспособными и поступают в ткани.
Предложено несколько классификаций групп медиаторов воспаления. Все они содержат в качестве классифицирующих несколько критериев. Рассматриваемые далее медиаторы воспаления разделены на группы и подгруппы в соответствии со сложившимся на момент написания учебника представлениями. Некоторые пояснения приводятся в тексте этого раздела, а также в статьях «Цитокины», «Хемокины», «Факторы», «Интерлейкины», «Интерфероны», «Лейкоциты», «Макрофаги», «Тромбоциты» (см. «Справочник терминов»).
Клеточные медиаторы воспаления
Основные группы клеточных медиаторов воспаления приведены на рисунке 6-9.
Ы верстка! вставить рисунок «рис-6-9» Ы
Рис. 6-9. Основные классы клеточных медиаторов воспаления.
Биогенные амины
Из биогенных аминов наиболее значимую роль при воспалении играют гистамин, серотонин, адреналин и норадреналин.
Гистамин. Основными источниками гистамина являются базофилы и тучные клетки. Действие гистамина опосредуют H1- и H2-рецепторы на клетках-мишенях.H1-рецепторы активируются малыми дозами гистамина. К эффектами их активации относят ощущения боли, жжения, зуда, напряжения.Н2-рецепторы активируются гистамином в высокой его концентрации. Эффекты их возбуждения заключаются в изменении синтеза ПГ, потенцировании образования циклических нуклеотидов, повышении проницаемости стенок микрососудов и (особенно — венул), активации миграции макрофагов, нейтрофилов, эозинофилов в очаг воспаления, сокращении ГМК. Промежуточные дозы гистамина активируют оба вида рецепторов. Это сопровождается значительным расширением артериол и развитием в очаге воспаления артериальной гиперемии, снижением порога возбудимости и повышением чувствительности тканей, в т.ч. болевой.
Серотонин. Источниками серотонина являются тромбоциты, тучные клетки, нейроны, энтероэндокринные клетки. К числу основных эффектовсеротонина в очаге воспаления относят повышение проницаемости стенок микрососудов, активацию сокращения ГМК венул (что способствует развитию венозной гиперемии), формированиечувства боли, активацию процессов тромбообразования.
Адреналин и норадреналин. Эффекты норадреналина в очаге воспаления являются, в основном, результатом его действия на клетки как нейромедиатора симпатической нервной системы (его прямые метаболические эффекты, в отличие от адреналина, сравнительно мало выражены).
Нейромедиаторы
Из нейромедиаторов при развитии воспалении наиболее важную роль играют катехоловые амины и ацетилхолин.
Норадреналин и адреналин синтезируются из тирозина в нейронах головного мозга, симпатической нервной системы, а также в хромаффинных клетках параганглиев и мозгового вещества надпочечников. Эффекты адреналина и норадреналина реализуются через a- и/или b-адренорецепторы.
В очаге воспаления норадреналин выделяется из окончаний нейронов симпатической нервной системы, а катехоламины надпочечникового происхождения поступают с кровью.
Эффекты катехоламинов заключаются в:
Ú активации гликолиза, липолиза и липопероксидации;
Ú увеличении транспорта Ca2+ в клетки;
Ú сокращении ГМК стенок артериол, уменьшении просвета артериол и развитие ишемии;
Ú регуляции эмиграции лейкоцитов из сосудов в ткань и течения фагоцитарной реакции.
Ацетилхолин cинтезируется в нейронах из холина и ацетилкоэнзима А при участии холинацетилтрансферазы; выделяется из окончаний нейронов парасимпатической нервной системы и реализует свои эффекты через холинорецепторы.
Эффектыацитилхолина проявляются в:
Ú снижении тонуса ГМК артериол, расширении их просвета и развитии артериальной гиперемии;
Ú регуляции процессов эмиграции лейкоцитов в очаг воспаления;
Ú стимуляции фагоцитоза;
Ú активации пролиферации и дифференцировки клеток.
Пептиды и белки
Из нейропептидов при развитии воспаления важную роль выполняет вещество P (см. в «Справочнике терминов» статьи «Вещество» и «Тахикинины»).
Цитокины играют ключевую роль в адаптивных реакциях организма (в т.ч. иммунном, аллергическом и при воспалении), регулируют дифференцировку, пролиферативную активность и экспрессию фенотипа клеток-мишеней.
К цитокинам отнесены факторы роста, интерлейкины (ИЛ), ФНО, колониестимулирующие факторы, интерфероны (ИФН), хемокины и некоторые другие. Общий современный термин для всего класса— цитокин (устаревшие наименования подклассов: лимфокины и монокины).
ИЛ— вещества белковой природы, синтезирующиеся множеством клеток (в т.ч. моноцитами, макрофагами и лимфоцитами). В очаге воспаления ИЛ (особенно ИЛ 1–4, 6 и 8) регулируют взаимодействие лейкоцитов между собой и с другими клетками.
Эффекты ИЛ:
Ú регуляция хемотаксиса лейкоцитов;
Ú активация захвата и внутриклеточной деструкции объекта фагоцитоза;
Ú стимуляция синтеза ПГ клетками эндотелия;
Ú активация адгезивной способности эндотелиоцитов;
Ú стимуляция пролиферации и дифференцировки различных клеток;
Ú потенцирование микротромбообразования;
Ú развитие лихорадки.
Интерфероны — гликопротеины, вырабатываемые различными клетками и имеющие антивирусную активность. В очаге воспаления ИФН стимулируют фагоцитоз, активируют цитотоксическую активность лейкоцитов, регулируют иммунные и аллергические процессы.
Хемокины — низкомолекулярные секреторные пептиды, регулирующие перемещения лейкоцитов. Значение хемокинов для иммуногенеза, иммуномодуляции, воспаления и патогенеза исключительно велико (подробнее см. статью «Хемокины» в «Справочнике терминов»).
Лейкокины— общее название для различных БАВ, образуемых лейкоцитами, но не относимых к иммуноглобулинам (Ig) и цитокинам. С функциональной точки зрения лейкокины — местные медиаторы воспалительной реакции. К группе лейкокинов относят белки острой фазы, катионные белки, а также фибронектин и некоторые другие выделямые разными лейкоцитами химические вещества, имеющие значение для патогенеза воспаления.
Белки острой фазы (см. статью «Белки острой фазы» в «Справочнике терминов» на компакт-диске) и компонент комплемента C3 (субстрат в реакции активации комплемента, подробнее см. статью «Комплемент» в «Справочнике терминов» на компакт-диске) — важные факторы патогенеза воспаления. Расщепление C3 конвертазой сопровождается образованием большой группы белков, обладающих высокой хемотаксической способностью и свойством стимулировать выход гранулоцитов из костного мозга.
Катионные белки (КТ) образуются в гранулоцитах (главным образом — в нейтрофилах) и хранятся в их гранулах. КТ несут на поверхности белковой мицеллы значительный положительный заряд (отсюда их название). Эффекты КТ многочисленны. Они обладают высокой неспецифической бактерицидной активностью:
Ú КТ легко контактируют с отрицательно заряженной внешней мембраной микробов. Это расстраивает трансмембранные процессы, в связи с чем структура оболочки микроорганизмов нарушается, повышается ее проницаемость, резистентность микробов резко снижается. При наличии в окружающей среде гидролитических белков, активных форм кислорода, свободных радикалов микробные клетки быстро лизируется;
Ú КТ повышают проницаемость стенок микрососудов (КТ действуют как сигнал для выброса гистамина), стимулируют эмиграцию лейкоцитов;
Ú инициируют контакты нейтрофилов и макрофагов с микробами и другими объектами фагоцитоза.
Фибронектины синтезируются многими клетками, в т.ч. мононуклеарными фагоцитами, фибробластами и тучными клетками. Фибронектины активируют процесс опсонизации объектов фагоцитоза, обеспечивают фиксацию объекта фагоцитоза на поверхности фагоцитов. Продукты гидролиза фибронектинов обладают высокой хемотаксической активностью.
Ферменты в очаге воспаления участвуют в формировании всех компонентов воспаления: альтерации, сосудистых реакций, экссудации, фагоцитоза, пролиферации.
Описано 2 источникаферментов: эндогенный(собственные клетки поврежденной ткани и лейкоцитов организма) и экзогенный (микроорганизмы, грибы, паразиты, клетки трансплантата, т.е. генетически чужеродные клеточные агенты).
Биологическая роль ферментов в очаге воспаления весьма значима, поскольку они регулируют:
Ú метаболизм (киназы, дегидрогеназы, АТФазы, ДНК-полимеразы и другие);
Ú образование медиаторов воспаления (кининогеназы, аминопептидазы, C3-конвертаза, гистидиндекарбоксилаза, тирозингидроксилаза);
Ú текучесть и жесткость клеточных мембран (протеазы, липазы, фосфолипазы, лизоцим);
Ú проницаемость стенок сосудов микроциркуляторного русла (гиалуронидаза, эластаза, коллагеназа);
Ú процессы разрушениясобственных (погибших и поврежденных), а также чужеродных клеток (микробов, паразитов, опухолей, трансплантата, вируссодержащих клеток) путем экзо- или эндоцитоза (фагоцитоза);
Ú синтетические процессыв клетках (РНК- и ДНК-синтетазы, лигазы, гликогенсинтетазы, полимеразы, синтетазы холестерина и ВЖК, аминоацилсинтетазы и другие).
Оксид азота
Оксид азота (эндотелием освобождаемый фактор вазодилатации) — важный медиатор воспаления (см. статью «Фактор» в «Справочник терминов»).
Липидные медиаторы воспаления
Липидными медиаторами воспаления называют производные арахидоновой кислоты — ПГ, тромбоксаны и лейкотриены, обладающие вазо- и бронхоактивными свойствами. Из мембранных фосфолипидов образуется также фактор активации тромбоцитов (PAF) — наиболее сильный спазмоген. К этой же группе относят продукты перекисного окисления липидов — липопероксиды.
Арахидоновая и линоленовая кислоты входят в состав фосфолипидов клеточных мембран, откуда и освобождаются под влиянием фосфолипаз. Дальнейшие превращения этих кислот происходят либо по циклооксигеназному, либо по липооксигеназному пути (рис. 6-10).
Ы верстка! вставить рисунок «рис-6-10» Ы
Рис. 6-10. Образование и эффекты ПГ и лейкотриенов.
Лейкотриены образуются по липооксигеназному пути; эйкозаноиды [например, ПГ F2a, ПГ E2, ПГ D2, ПГ I2 (простациклин), тромбоксан A2] — по циклооксигеназному. На первом этапе из арахидоновой кислоты под влиянием циклооксигеназ формируется эндопероксид H2 (ПГ H2), а в результате дальнейших реакций и другие эйкозаноиды.Циклооксигеназа 1 — фермент конститутивного синтеза, постоянно экспрессируемый в тромбоцитах, эндотелии, желудке, почке и других органах.Циклооксигеназа 2 — индуцибельный фермент, экспрессию которого в очаге воспаления запускают провоспалительные цитокины (например, ИЛ1).
Дата добавления: 2015-08-05; просмотров: 9; Нарушение авторских прав
Источник
