Пролиферативную и экссудативную фазы воспаления
Воспаление всегда начинается с изменения. Через некоторое время процессы инфильтрации, протеолиза, некроза и синяков уменьшаются или прекращаются, и на первый план выходит регенерация тканей.
Наибольшее повреждение тканей вызывает гнойное воспаление. После эвакуации гноя в тканях остается полость (тканевой дефект), которая постепенно заполняется соединительнотканными элементами – происходит разрастание соединительной ткани.
Разрастанию соединительной ткани в месте воспаления способствует особый материал, присутствующий в повышенных количествах в воспаленных тканях и экссудате, активаторы роста, возникающие в результате процессов изменения, снижение хилона (ингибиторы пролиферации), пролиферация cAMF и слабый ацидоз.
В условиях слабого ацидоза для диссоциации оксигемоглобина на ткани требуется более высокое парциальное давление кислорода, чем обычно – кривая диссоциации Hb02 смещается вправо. Это уже начало следующей фазы – регенерации. Все интенсивно пролиферирующие ткани нуждаются в большом количестве воды, и регенерация соединительной ткани также начинается в гипергидратационных условиях (фаза гипергидратации).
Микрофаги в очаге воспаления постепенно погибают, и начинают преобладать макрофаги. Повышается фагоцитарная активность этих клеток, они фагоцитируют мертвые клетки и другие продукты изменения. В очаге воспаления один тип клеток заменяет другой (микрофаги – макрофаги – фибробласты), каждый из которых выполняет свою функцию, а затем отдает свое место другому типу клеток.
Таким образом, основные изменения соединительной ткани в очаге воспаления – это разрастание макрофагов, фибробластов и гистиоцитов, образование капилляров (2-3 дня) и развитие волокон соединительной ткани (3-6 дней). Дефект ткани постепенно заполняется грануляционной тканью – новой, энергично растущей и богатой сосудами тканью, которая окружает очаг воспаления.
В условиях повышенной активности фагоцитоза, ацидоза, протеолитических и липолитических ферментов уничтожаются микроорганизмы и элементы омертвевшей ткани, ограничивается воспаление, уменьшается экссудация и площадь гиперемии.
После заполнения дефекта ткани кровеносные сосуды и лимфатические сосуды начинают опорожняться (лимфатические сосуды выполняют дренажную функцию для устранения воспалительного отека). Воспалительный отек исчезает, наступает фаза гипогидратации. Происходит регенерация не только соединительной ткани, но и клеток органов и тканей. Однако по мере увеличения числа дифференцированных клеток, интенсивность регенерации снижается.
Если повреждение ткани невелико, регенерация часто бывает полной, тогда как при большом повреждении возникает рубцевание. Клетки высокодифференцированной паренхимы органов (головной мозг, миокард) неспособны к регенерации после травмы. Соединительная ткань часто перерастает в некротическую массу, например, после инфаркта миокарда, плеврита, операций на брюшной полости. Особенно интенсивно разрастается соединительная ткань вокруг инородного тела – вокруг него образуется плотная капсула.
Асептическая рана, края которой соприкасаются, заживает в первую очередь. В этом случае происходит выраженное разрастание макрофагов и интенсивное образование соединительнотканных волокон, которые вместе с эпителиальными клетками замещают фибрин тромба в ране.
Иногда поврежденные клеточные элементы, такие как слизистые оболочки, кожа, способны регенерировать и заполнить дефект определенными тканями, и тогда рана заживает без рубца. Напротив, инфицированные раны, а также асептические раны, если их края не совпадают, заживают вторично, и образуется рубец.
Последствия воспаления
Если регенерация ткани, поврежденной при воспалении, завершена, то функции также полностью восстанавливаются (restitutio ad integrum). Когда определенные ткани заменяются соединительной тканью, функции восстанавливаются только частично (restitutio incpleta). В результате такого воспаления образуется рубец, а функции тканей остаются ограниченными (замещение).
![]() Рубец
Рубец
Большой рубец часто негативно влияет на организм. По мере сокращения рубцовой ткани развивается значительная дисфункция органа или конечности. Спайки и рубцы, например, в брюшной полости после перитонита или хирургического вмешательства, стеноз пищевода и желудка после ожога кислотой или щелочью, деформируют органы и нарушают их функцию. Распространены нарушения движений конечностей из-за воспаления нервов, сухожилий и суставов. Также в паренхиматозных органах (легких, печени, поджелудочной железе, почках) часто возникают тяжелые функциональные нарушения после воспаления.
Процессы изменения, которые убивают высокодифференцированные клетки жизненно важных органов, могут угрожать существованию организма. Очень опасны рубцы, например, после воспаления сердечных клапанов или мозговых оболочек.
Биологическое значение воспаления в организме
Уже И. Мечников доказал, что воспаление, усложняющееся в ходе эволюции, является одним из неспецифических механизмов защиты всех организмов от действия патогенного агента. Даже сегодня воспаление считается типичным патологическим процессом, при котором компоненты повреждения и защиты связаны в неразрывное целое, а также во взаимной борьбе.
Вредные для организма процессы – это ухудшение функции и интоксикация, когда нарушаются функции воспаленного органа (ткани). Например, при воспалении сустава движения в нем болезненны и ограничены или даже невозможны.
Воспаление как защитная реакция организма проявляется по-разному. Уже во время смены высвобождаются биологически активные вещества, которые участвуют в сосудистых реакциях и процессах пролиферации. Спазм сосудов предотвращает дальнейшее распространение инфекционного агента в организме. В условиях венозной гиперемии уменьшается кровоток и лимфоток, поэтому токсические и пирогенные вещества дольше задерживаются в очаге воспаления.
Также важен для защиты воспалительный экссудат.
- Из-за кислой среды экссудат является бактерицидным. Его белки связывают бактериальные токсины.
- Экссудат разжижает и ферментативно расщепляет, препятствуя абсорбции и дальнейшему распространению токсинов в организме.
- Экссудат используется для доставки антител к специфическим антигенам в месте воспаления.
Особое значение имеет фагоцитарная и пролиферативная функция клеток соединительной ткани. Грануляционная ткань, образующаяся в процессе пролиферации, и соединительнотканный барьер изолируют воспаление от окружающих тканей. Благодаря этим защитным механизмам подопытному животному можно вводить токсины в очаге воспаления, но заметной реакции организма не происходит. С другой стороны, в здоровых тканях токсины вызывают у животного значительную реакцию или даже гибель.
![]() Грануляционная ткань
Грануляционная ткань
Как и другие типичные патологические процессы в организме, защитная функция воспаления не безгранична. Если действие вредного агента сильное, защитные реакции могут стать ненормальными, вредными для организма. Например, тяжелый фурункулез, разлитой гнойный перитонит, септическое состояние и т. д. нельзя считать положительной защитной реакцией.
Способность реагировать на действие болезнетворных агентов воспалением – очень важный типичный патологический процесс в организме, нарушение которого может иметь опасные последствия. Эти нарушения могут быть связаны с уменьшением количества нейтрофилов (нейтропения) и проблемами с их функцией.
В свою очередь, наиболее частыми причинами тяжелой нейтропении являются лекарственный агранулоцитоз и лейкоз. В редких случаях возникает так называемая циклическая (периодическая) нейтропения, когда каждые 21 день наблюдается значительное снижение количества нейтрофилов. Эта нейтропения чаще встречается у пациентов с инфекционными кожными заболеваниями, отитом и артритом.
Дисфункция лейкоцитов может включать хемотаксис, эмиграцию и фагоцитоз. Например, нарушения хемотаксиса и эмиграции лейкоцитов возникают при диабете, пародонтите, терапии кортикостероидами и других.
Также описаны многие наследственные дефекты фагоцитарной системы. Некоторые дефекты – это нарушения бактерицидной активности фагоцитов, другие – нарушения подвижности фагоцитов.
- К первой группе относится хронический гранулематоз у детей, в основе которого лежит снижение активности НАДН2-зависимой оксидазы. В результате в клетке не образуется H 2 O 2 и не повреждается мембрана фагоцитирующего объекта. Процесс фагоцитоза не завершается, и из гистиоцитов развиваются гранулемы (чаще всего в легких). Гранулемы разрушаются, лейкоциты и микроорганизмы оставляют очаги воспаления, развивается сепсис.
- Вторая группа наследственных дефектов включает синдром Чедиака-Хигаси. Признаки включают лейкоцитарные аномалии и нарушения пигментации кожи, склонность к рецидивам, гнойные инфекции, анемию, лейкоцитопению, тромбоцитопению и т. д.
Воспаление развивается плохо из-за нарушения фагоцитоза. Снижается сопротивляемость организма инфекции, и ухудшается состояние больного. Например, в случае пониженной реактивности смертность больных пневмонией намного выше.
Принципы противовоспалительной терапии
Поскольку воспаление и часто связанная с ним лихорадка являются защитными, с ними не всегда нужно бороться. Иногда эти типичные патологические процессы изолируют возбудителя болезни, иногда – благотворно влияют на течение некоторых хронических заболеваний. Однако при многих острых воспалительных заболеваниях (фурункулез, тромбофлебит, острый аппендицит, острый панкреатит и т. д.) Необходимо бороться с воспалением, чтобы избежать опасных для организма осложнений.
Воспалительная терапия бывает этиологической и патогенетической.
- Цель этиологической терапии – устранить биологический агент воспаления (антибиотики, противотуберкулезные препараты, терапевтические сыворотки и т. д.) Или подавить действие аллергена.
- Задача патогенетического лечения – предотвратить или полностью заблокировать один из этапов воспалительного патогенеза.
Например:
- Противовоспалительные препараты (салицилаты, глюкокортикоиды) стабилизируют лизосомальную мембрану, снижают активность ферментов (трансаминаз, дегидрогеназ, эстераз, протеаз) и тем самым уменьшают образование биологически активных веществ.
- Индометацин подавляет синтез простагландинов. Гиперосмолярные растворы (как местные, так и внутривенные) используются для уменьшения воспалительного отека.
- Глюкокортикоиды подавляют фагоцитоз, пролиферацию клеток и иммунологические процессы. В результате течение воспаления ослабевает и замедляется. Эти препараты широко используются при лечении аллергических воспалений.
![]() Противовоспалительная терапия
Противовоспалительная терапия
Чтобы создать наиболее благоприятные условия для развития воспаления как защитного процесса организма, воспаленным тканям нужен покой. В случае острого воспаления механические движения могут помешать локализации воспаления и способствовать распространению инфекции.
В лечении воспалений играют роль различные тепловые процедуры: они улучшают кровообращение и циркуляцию лимфы в воспаленных тканях и стимулируют экссудацию, тем самым усиливая и ускоряя воспалительные процессы. Холод снижает интенсивность этих процессов.
Основная задача хирургических методов лечения – удаление внутренних ограниченных инфекционных очагов воспаления (флегмонозный отросток, желчный пузырь), а также вскрытие и дренирование гнойной полости (абсцесс, флегмона).
В современной медицине, в том числе при лечении воспалений, успешно применяются каликреин и препараты ингибиторов каликреина.
Ингибиторы протеаз, обладающие широким спектром действия, участвуют в регуляции хининов и фибринолитической системы. Эти ингибиторы играют защитную роль при различных заболеваниях, включая панкреатит. Они препятствуют образованию калькреина и прогрессированию воспаления. Многие ингибиторы каликреина содержатся в бычьей печени, слюнных железах, поджелудочной железе. Препараты-ингибиторы (трасилол, калол, контральтик) используются при лечении острого панкреатита.
Препараты каликреина (падутин, депокаликреин, дилминал D, ангиотропин) расширяют кровеносные сосуды и играют важную роль в лечении облитерирующего эндартериита.
В период разрастания соединительной ткани для борьбы с негативными последствиями рубцевания, особенно контрактур, движения следует выполнять постепенно, увеличивая их амплитуду до максимума.
Продолжение статьи
- Часть 1. Этиология и патогенез воспаления. Классификация.
- Часть 2. Особенности обмена веществ при воспалении.
- Часть 3. Физико – химические изменения. Роль нервной и эндокринной систем в развитии воспаления.
- Часть 4. Изменения в периферическом кровообращении при воспалении.
- Часть 5. Экссудация. Экссудат и транссудат.
- Часть 6. Эмиграция лейкоцитов. Хемотаксис.
- Часть 7. Фагоцитоз. Асептическое и острое воспаление.
- Часть 8. Распространение. Последствия. Принципы лечения воспаления.
Источник
Диклофенак по праву может считаться лидером в группе нестероидных противовоспалительных препаратов (НПВП) по соотношению клинической эффективности, частоте побочных эффектов и стоимости. Он обладает выраженным противовоспалительным эффектом, хорошим обезболивающим действием, при этом стабильно занимая ведущие места в клинических исследованиях и метанализах, посвященных сравнительной переносимости НПВП [1]. НПВП применяются при различных состояниях, сопровождающихся лихорадкой различного генеза (инфекционного и неинфекционного), а также для лечения дегенеративно-воспалительных заболеваний суставов.
Механизм действия НПВП одинаков для всех подгрупп препаратов и основывается на ингибировании фермента циклооксигеназы (ЦОГ), играющего ключевую роль в синтезе метаболитов арахидоновой кислоты, обладающих провоспалительным эффектом и непосредственно участвующих в терморегуляции и формировании болевых ощущений. Угнетая указанный фермент, НПВП уменьшают проявления воспаления [2].
Способность купировать боли различного происхождения является главным фактором широкого применения НПВП в терапевтической, хирургической и ревматологической практике. В отличие от наркотических анальгетиков НПВП не вызывают привыкания и не угнетают дыхательный центр [3]. НПВП назначаются приблизительно 20% стационарных больных, страдающих заболеваниями внутренних органов [3].
По данным отечественных авторов, к 20-му году жизни каждый второй житель России имеет то или иное ревматическое заболевание, а к 65 годам этот показатель достигает 100% [4].
Основная задача медикаментозного лечения ревматических болезней заключается в купировании боли и тугоподвижности мышц и суставов с помощью НПВП [5].
Сравнительная характеристика некоторых наиболее употребимых НПВП приведена в табл. 1, где они ранжированы в порядке убывания степени выраженности того или иного действия.
Таким образом, диклофенак относится к наиболее мощным нестероидным противовоспалительным средствам [6]. Кроме того, у препарата также очень низкая вероятность ульцерогенного действия [4].
Многолетний положительный опыт применения диклофенака в разных странах, обилие доступных лекарственных форм, широкий диапазон допустимых дозировок – все это дает возможность считать его препаратом первого выбора при большинстве ревматических заболеваний и для купирования болевого синдрома небольшой и средней интенсивности [1].
Дикловит представляет собой ректальные суппозитории, содержащие в качестве активного действующего вещества диклофенак и используемые как болеутоляющее, противовоспалительное и жаропонижающее средство.
Фармакологическое действие
Согласно современным представлениям, диклофенак обладает целым рядом фармакологических эффектов, из которых главным является ингибирование активности фермента ЦОГ, катализирующего образование из арахидоновой кислоты простагландинов – мощных медиаторов воспалительного процесса [3]. Установлено существование двух изоэнзимов ЦОГ – ЦОГ-1 и ЦОГ-2.
ЦОГ-1 индуцирует продукцию простаноидов: простагландинов, обладающих цитопротективным эффектом в отношении слизистой оболочки желудка, и тромбоксана А2, влияющего на агрегацию тромбоцитов.
ЦОГ-2 экспрессируется в очагах воспаления и способствует синтезу провоспалительных простагландинов. Таким образом, противовоспалительный эффект диклофенака связывается с подавлением активности ЦОГ-2, а развитие побочных эффектов – с подавлением ЦОГ-1.
Диклофенак способен вызывать разобщение окислительного фосфорилирования в митохондриях с уменьшением синтеза АТФ и снижением энергообеспечения воспалительной реакции, а также тормозить перекисное окисление липидов.
Способность диклофенака воздействовать на острое экссудативное воспаление за счет ингибирования ЦОГ делает его одним из наиболее мощных НПВП, используемых для лечения заболеваний опорно-двигательного аппарата (ревматоидный артрит, анкилозирующий спондилоартрит и др.) [1].
Диклофенак подавляет экссудативную и пролиферативную фазы воспаления. При этом снижается образование различных простагландинов, простациклинов в очагах воспаления и предупреждается образование свободных радикалов из циклических эндоперекисей и образование перекисей липидов в клеточных мембранах, что приводит к ограничению воспаления.
Ограничивая экссудацию, диклофенак препятствует попаданию в ткань факторов плазмы крови, стимулирующих ферменты, которые активируют синтез коллагена фибробластами. В результате подавляется и пролиферативный компонент воспаления [7].
Непосредственный обезболивающий эффект диклофенака, так же как и противовоспалительный, в основном объясняется блокированием синтеза простагландинов как в периферических тканях, так и в ЦНС.
Наиболее частой причиной хронических болей в пожилом возрасте является остеоартроз. В связи с тем, что воспалительные реакции синовиальной оболочки и периартикулярных тканей играют важнейшую роль в патогенезе болевого синдрома, диклофенак при остеоартрозе в большинстве случаев обеспечивает более выраженный обезболивающий эффект, чем ненаркотические анальгетики [1]. Анальгезирующее действие препарата также связано с уменьшением экссудации и ослаблением механического давления на болевые рецепторы в тканях, а также с предупреждением развития гипералгезии [6].
Жаропонижающее действие обусловлено угнетением синтеза простагландинов E1 в центральной нервной системе и уменьшением его влияния на центр терморегуляции. Жаропонижающее действие диклофенака также можно объяснить ингибирующим влиянием на синтез эндогенных пирогенов с молекулярной массой 10 000 – 20 000 Д в полиморфноядерных нейтрофилах, моноцитах и ретикулоцитах [6].
Антиагрегантный эффект характерен для всех неселективных ингибиторов ЦОГ и связан с ингибированием синтеза тромбоксана А2 [1, 6].
Десенсибилизирующий эффект диклофенака развивается медленно. Для его получения препарат необходимо назначать в течение 2-х месяцев и более. В механизме возникновения десенсибилизирующего эффекта имеют значение следующие механизмы:
• Ингибирование синтеза простагландинов E2 в очаге воспаления и в лейкоцитах, а также снижение хемотаксической активности моноцитов.
• Снижение образования гидро-гептранотриеновой кислоты, что уменьшает хемотаксическую активность Т-лимфоцитов, эозинофилов и полиморфноядерных нейтрофилов в очаге воспаления.
• Торможение бласттрансформации лимфоцитов вследствие блокирования образования простагландинов [6, 7].
Многочисленные физиологические функции простоноидов обусловливают применение НПВП в различных областях медицины, в частности в гинекологии. Диклофенак может с успехом применяться при первичной дисменорее, которая связана с образованием большого количества простагландинов в матке и ее повышенной способностью сокращаться, что служит основой для лечения ингибиторами простагландинового синтеза [1, 7].
Диклофенак относится к короткоживущим НПВП – период полувыведения препарата составляет 1,5-3,5 ч.
Необходимо иметь в виду, что кинетические параметры НПВП в сыворотке крови и в синовиальной жидкости различны. При этом синовиальная концентрация длительноживущих препаратов коррелирует с уровнем в сыворотке, а при приеме короткоживущих препаратов она сначала низкая, но затем существенно нарастает и может превышать сывороточную концентрацию. Это позволяет объяснить длительно сохраняющуюся клиническую эффективность короткоживущих препаратов [3].
Диклофенак обладает высокой степенью абсорбции и биодоступности. В печени метаболизируется до 99% препарата, 75% диклофенака выводится через почки.
Таким образом, в качестве патогенетического или симптоматического средства диклофенак показан:
• при воспалении различного генеза;
• для снятия болевого синдрома легкой или умеренной степени выраженности различного генеза;
• для снижения повышенной температуры тела (при необходимости) [3].
Лекарственная форма диклофенака в виде суппозиториев Дикловит имеет ряд преимуществ:
• Свечи не вызывают тех осложнений, которые возможны при парентеральном введении лекарственных средств. Для НПВП при длительном применении характерно развитие мышечных некрозов на месте инъекции. Длительное (более 2-3 дней) парентеральное применение чревато развитием инфильтратов и нагноений.
• Немаловажное значение, особенно для пожилых больных, имеет сокращение числа приемов препарата в день. Очень часто суппозитории применяются в комбинированной терапии: в течение дня больной получает или инъекции или таблетки, а на ночь – свечи, что создает лучший терапевтический эффект благодаря более равномерному и длительному поддержанию концентрации препарата в крови.
• Свечи целесообразно назначать при невозможности принимать препараты через рот (у ослабленных больных, при наличии стриктур пищевода и т.д.).
• При приеме per os существует непосредственный повреждающий эффект диклофенака .на клетки слизистой желудка с повреждением митохондрий и разобщением окислительного фосфорилирования. Вот почему при наличии признаков поражения желудка и двенадцатиперстной кишки отдается предпочтение свечевым формам диклофенака [1, 5, 8].
Клинические испытания Дикловита
В исследованиях, проведенных на базе кафедры пропедевтики внутренних болезней Московского стоматологического института, суппозитории Дикловит использовались у больных с широким спектром артрологических заболеваний (рис. 1.). При лечении достоверно снижались показатели СОЭ, С-реактивного белка, серомукоидов крови (табл. 2).
Высокая терапевтическая эффективность препарата была продемонстрирована и в исследованиях, проведенных в Институте ревматологии РАМН.
Выявленное анальгетическое, противовоспалительное действие свечей Дикловит положительно сказывалось на функции суставов: уменьшались или исчезали экссудативные проявления, продолжительность утренней скованности, выраженность болевого синдрома, увеличивался объем движений в суставах, уменьшалось количество пораженных суставов и степень их функциональной недостаточности (рис. 2).
В исследовании эффективности и безопасности свечей Дикловит, проведенном в Главном военном клиническом госпитале им. Н.И. Бурденко, показано, что продолжительность действия свечей Дикловит больше продолжительности действия таблетированной формы диклофенака.
Показания к применению
• Воспалительные и дегенеративные заболевания суставов – ревматоидный артрит, анкилозирующий спондилоартрит (болезнь Бехтерева), болезнь Рейтера, остеоартрозы, псориатический артрит, подагра:
• ревматические поражения мягких тканей – бурсит, тендовагинит, синовит;
• заболевания нервной системы – плечелопаточный периартрит, люмбаго, люмбалгии, невралгии, миалгии;
• гинекологические заболевания – первичная дисменорея, аднексит, периметрит;
• фебрильные состояния при инфекционно-воспалительных заболеваниях ЛОР-органов;
• воспаление, боль, тризм, отек вследствие стоматологических, ортопедических, гинекологических и других хирургических вмешательств.
Способ применения и режим дозирования
Освободив суппозиторий от контурной упаковки, его вводят в прямую кишку после клизмы или самопроизвольного опорожнения кишечника. После введения следует находиться в постели в течение 20-30 мин. Применяют по 1 суппозиторию 2 раза в сутки. Максимальная суточная доза – 150 мг.
Длительность курса лечения определяется врачом в зависимости от тяжести заболевания.
Побочное действие и противопоказания
Препарат обычно хорошо переносится и редко вызывает побочные явления.
Однако возможны (особенно в начале лечения) диспепсические явления, диарея, тяжесть в эпигастрии, сонливость, головные боли и легкое головокружение. Эти явления обычно проходят самостоятельно. В редких случаях возможно местнораздражающее действие на слизистую оболочку кишечника.
Противопоказаниями к применению Дикловита являются: язвенная болезнь желудка или двенадцатиперстной кишки, геморрагический колит, обострение геморроя, нарушения кроветворения неясной этиологии, повышенная индивидуальная чувствительность к диклофенаку, ацетилсалициловой кислоте или другим НПВП, III триместр беременности, детский возраст (до 15 лет).
Литература
1. Каратеев Д.Е. Нестероидные противовоспалительные препараты // Медицинская газета. 1999; 82: 8-9.
2. Зейгарник М.А. Стоимость длительного лечения НПВС: выбор есть // Ремедиум. 1999; 11: 58-60.
3. Насонов Е.Л. Нестероидные противовоспалительные препараты // Русский медицинский журнал. 1999; Т 7: 8: 392-96.
4. Корниенко В.В. Антигомотоксическая терапия ревматических заболеваний // Медицинский вестник. 1996; 4: 12-3.
5. Лоуренс Д.Р., Беннит П.Н. Клиническая фармакология: В 2-х т. – М.: Медицина, 1993; Т. 2: 583-84.
6. Кукес В.Г. Клиническая фармакология: Учеб. / Науч. ред. Байчурина А.З. – 2-е изд., перераб. и доп. – М.: ГЭОТАР Медицина, 1999; 528.
7. Каркищенко Н.Н. Фармакологические основы терапии (руководство и справочник для врачей и студентов). – М.: IMP – Медицина, 1996; 560.
8. Машковский М.Д. Лекарственные средства: В 2-х т. – 13-е изд. Харьков: Торсинг, 1997; Т. 1: 320.
Свечи с диклофенаком –
Свечи с диклофенаком –
Дикловит (торговое название)
Наиболее частой причиной хронических болей в пожилом возрасте является остеоартроз
Рис. 1. Заболевания, при которых проводились клинические испытания препарата Дикловит.
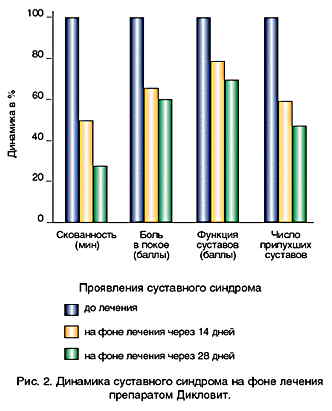
Рис. 2. Динамика суставного синдрома на фоне лечения препаратом Дикловит.
Источник
