Роль хемокинов в воспалении
Провоспалительные хемокины продуцируются миелоидными (моноциты, макрофаги) и эндотелиальными клетками после их активации. В очагах
воспаления в синтезе хемокинов участвуют и активированные эпителиальные клетки. Стимул к выработке хемокинов — прямое действие патогенов, распознаваемых в основном TLR, а также действие провоспалительных цитокинов (IL-1, TNFa, IL-6, IL-17 и т.д.). В этом отношении провоспалительные хемокины ничем не отличаются от других провоспалительных цитокинов. Хотя эти хемокины преимущественно индуцибельные, они могут нарабатываться заранее, связываться с глюкозаминогликанами, храниться в гранулах (в нейтрофилах, эозинофилах, цитотоксических Т-клет- ках) и выбрасываться при дегрануляции клетки. При активации лимфоциты (особенно Т-клетки) тоже секретируют хемокины. Уже упоминалось, что иммобилизация хемокинов глюкозаминогликанами межклеточного матрикса и на поверхности клеток необходима для формирования их градиента, обеспечивающего направленность миграции.
К провоспалительным хемокинам относят лиганды рецепторов CXCR1, CXCR2, CXCR3, CCR1, CCR2, CCR3 и CCR5. Хемокиновые рецепторы обычно экспрессируются конститутивно, т.е. перемещение клеток при воспалении ограничено не рецепторным аппаратом клеток, а секретируемы- ми хемокинами. Спектры реактивности рецепторов провоспалительных хемокинов обычно широки и сильно перекрываются, однако они все-таки обладают некоторым своеобразием. Это определяет разнообразие клеток, привлекаемых в очаг при различных типах воспаления (острое, хроническое, классическое макрофагальное или аллергическое эозинофильное и т.д.). При воспалении хемокины играют роль не только хемотаксических факторов. Очень важно их участие в активации лейкоцитов, особенно на этапе вовлечения их в процесс миграции.
Решающую роль в привлечении нейтрофилов в начальном периоде острого воспаления играют СХС-хемокины. Среди них к группе провоспалительных факторов относят СХС-хемокины с порядковыми номерами 1—8 (только включение в эту группу CXCL4 вызывает сомнения), взаимодействующие с CXCR1 и CXCR2. Особую подгруппу образуют 3 лиганда CXCR3, секреция которых индуцируется IFNy — MIG, IP-10 и ITAC. По ряду свойств они занимают промежуточное положение между СХС- и СС-хемокинами: их мишени не только нейтрофилы, но и моноциты, а также активированные Т-клетки и Т-клетки памяти, преимущественно ориентированные на клеточный иммунный ответ (Thl-клетки).
Самый изученный и, вероятно, самый важный среди провоспалительных хемокинов — IL-8. Он относится к СХС-хемокинам и имеет характерную третичную структуру (2 a-спирали и p-слой). Существуют варианты молекулы, различающиеся по длине (от 69 до 77 остатков; основной вариант — 72 остатка). Такие различия определяются природой протеаз, осуществляющих процессинг молекулы. Молекула IL-8 содержит 2 дисульфидные связи. В жидкой фазе она существует преимущественно в виде димера. Как и другие хемокины, IL-8 обладает сродством к глюкозаминогликанам, в том числе к гепарансульфату, присутствующему в тканях. Благодаря этому значительная часть IL-8 иммобилизируется, что очень важно для формирования градиента его концентрации в тканях.
Многие клетки способны вырабатывать IL-8, однако основные его продуценты — моноциты, макрофаги и эндотелиальные клетки. Описана секреция
IL-8 тучными и эпителиальными клетками, лимфоцитами, фибробластами и некоторыми другими клетками. Условия выработки IL-8 — активация клеток микроорганизмами и вирусами и их продуктами, провоспалительными цитокинами (IL-1p, TNFa и др.), некоторыми другими медиаторами воспаления (компоненты комплемента, кинины и т.д.) и факторами тромбообразования. Ген IL-8 входит в группу генов, активируемых при участии NF-kB и других активационных транскрипционных факторов. Хемокин выявляют в секрете клеток через 2—3 ч после активации. Эндотелиальные клетки, а также нейтрофилы могут накапливать пресинтезированный IL-8 и быстро (через 10—15 мин) выделять его при активации.
IL-8 распознают 2 рецептора — CXCR1 (связывает только IL-8) и CXCR2 (связывает также некоторые другие a-хемокины). Основные клетки, экспрессирующие эти рецепторы, и главная мишень IL-8 — нейтрофилы. Показана способность IL-8 привлекать также эозинофилы, базофилы и Т-лимфоциты. Тем не менее главная функция IL-8 состоит в обеспечении экстравазации нейтрофилов и их направленной миграции в очаг воспаления. При этом в качестве источников IL-8 выступают как макрофаги воспалительного очага, так и эндотелиальные клетки сосудов в зоне воспаления. IL-8, вырабатываемый эндотелиальными клетками, обеспечивает привлечение нейтрофилов к сосудистой стенке и активацию их интегринов, а также инициируют эмиграцию клеток из сосуда. При этом IL-8 связан с поверхностью эндотелиальной клетки через глюкозаминогликаны. С эндотелием может связываться также IL-8, диффундирующий к сосудам из очага воспаления. Прикрепившись к базальной поверхности эндотелиоцита, IL-8 подвергается трансцитозу и перемещается на апикальную поверхность клетки, обращенную в просвет сосуда. Градиент IL-8, формирующийся при его фиксации на межклеточном матриксе, обеспечивает выход нейтрофилов из сосудистого русла и миграцию этих клеток в очаг воспаления.
В очаге воспаления IL-8 продолжает проявлять свою активность. Он активирует находящиеся там нейтрофилы, способствует дегрануляции клеток, стимулирует выработку мононуклеарами цитокинов. Действие IL-8 на кислородный метаболизм выражено слабее, чем у провоспалительных цитокинов. Важный эффект IL-8 — его ангиогенное действие, особенно важное не только при развитии воспаления, но и при заживлении ран.
Аналогичную роль в привлечении и активации нейтрофилов играют другие a-хемокины. Однако детальные проявления их функциональной активности, а также «разделение труда» между ними изучены недостаточно. Уже упоминалось, что некоторые СХС-хемокины, содержащие в своем составе последовательность ELR (Glu—Leu—Arg) обладают ангиогенными свойствами, т.е. способствуют размножению эндотелиальных клеток и образованию новых сосудов в очаге воспаления. Остальные СХС-хемокины не просто лишены ангиогенной активности — они проявляют антиангиогенное действие, с чем связано их противоопухолевое действие.
Среди СС-хемокинов выделяют несколько подгрупп. К провоспалительным цитокинам относят CCL с номерами 3—6, 14—16, 18 и 23. Основная мишень для большинства этих хемокинов — моноциты; для CCL5 (RANTES, от Regulated upon activation normal T-cell expressed and secreted) — активированные Т-клетки и Т-клетки памяти. Этим факторам принадлежит ключевая роль на поздних этапах любой воспалительной реакции, а также при развитии хронического воспаления. Подгруппу аллергических хемокинов образуют CCL c номерами 1, 2, 7, 8, 11—13, 24 и 26. Большинство из них обладает способностью привлекать эозинофилы или базофилы и вызывать выброс гистамина. Аллергическим хемокинам также присуща провоспалительная активность, реализуемая через их способность привлекать и активировать моноциты. Другие подгруппы СС-хемокинов непосредственно не участвуют в развитии воспаления. Это хемокины, связанные с развитием клеток (представленные в тимусе CCL17, CCL22, CCL25), и гомеостатические хемокины (CCL19, CCL20, CCL21), ответственные за упорядоченное распределение лимфоидных и дендритных клеток во вторичных лимфоидных органах (см. раздел 3.4.2.5). Единственный представитель семейства СХ3С-хемокинов — фракталкин (синтезируется эндотелиальными клетками и связан с их мембраной) — сходен по составу клеток-мишеней и функциям с СС-хемокинами.
Спектр клеток-мишеней СС-хемокинов шире, чем у СХС-хемокинов. Способность СС-хемокинов привлекать моноциты находит отражение в названии пяти из них — хемотаксические белки моноцитов (МСР — от Monocyte chemotactic protein). Однако большинство из провоспалительных СС-хемокинов служит хемотаксическими факторами и для дендритных клеток, В-лимфоци- тов, NK-клеток, Т-клеток памяти и активированных Т-лимфоцитов (в ряде случаев СС-хемокины избирательно действуют на субклассы Т-клеток — Th1 и Th2). Наряду с хемотаксическим действием эти хемокины стимулируют провоспалительную активность моноцитов и марофагов. Этому соответствует обозначение шести СС-хемокинов как воспалительных белков макрофагов (MIP — от Macrophage inflammation protein). Способность привлекать в очаг воспаления эозинофилы дала название трем эотаксинам (CCL11, CCL24, CCL26).
Среди 20 провоспалительных хемокинов группы СС ключевая роль в инициации и развитии воспалительных процессов, обусловленных преимущественной активностью моноцитов, принадлежит двум факторам: CCL2 (MCP-1) и CCL5 (RANTES). Удаление этих факторов с помощью моноклональных антител или «выключения» соответствующих генов приводит к ослаблению воспалительного процесса и рассматривается как потенциальный терапевтический подход при некоторых воспалительных заболеваниях. Показана роль CCL2 и CCL5 в патогенезе атеросклероза и противоопухолевой защите. При аллергии защитного эффекта достигают при воздействии на хемокины CCL11 (эотаксин) и CCL5.
Из данных о спектре клеток-мишеней провоспалительных СС-хемокинов следует, что функциональная роль хемокинов проявляется не на начальных фазах острого воспаления, а в более поздние его сроки, а также при хроническом воспалении и реализации иммунологической или аллергологической составляющих воспалительной реакции. Иными словами, если роль СХС-хемокинов проявляется практически исключительно в рамках врожденного иммунитета, то СС-хемокины во многом служат факторами, интегрирующими врожденный и адаптивный иммунитет.
Источник
Хемокины — семейство мелких (от 8 до 10 кДа) белков, которые действуют в основном как хемоаттрактанты для определенных типов лейкоцитов. Идентифицировано около 40 разных хемокинов и 20 разных рецепторов к ним. Хемокины распределены в группы в соответствии с расположением остатков цистеина в матричных белках:
– CXC-хемокины (а-хемокины). Имеют один аминокислотный остаток, разделяющий два первых цистеиновых остатка. СХС-хемокины первично действуют на нейтрофилы. IL-8 — типичный представитель этой группы. Он секретируется активированными макрофагами, эндотелиальными клетками и вызывает активацию и хемотаксис нейтрофилов при лимитированной активности моноцитов и эозинофилов. Самые важные индукторы IL-8 — микробные продукты и другие цитокины, в основном IL-1 и TNF;
– СС-хемокины (b-хемокины). Имеют два первых смежных цистеиновых остатка. К этой группе относятся моноцитарный хемоаттрактантный белок 1 (МСР-1), эотаксин, воспалительный белок макрофагов 1а (М1Р-1а) и хемокин RANTES, экспрессируемый и секретируемый Т-клетками при активации.
СС-хемокины обычно привлекают моноциты, эозинофилы, базофилы и лимфоциты, но не нейтрофилы. Большинство хемокинов этого класса имеют перекрывающиеся эффекты, кроме эотаксина, который селективно мобилизует эозинофилы;
– С-хемокины (у-хемокины). В их структуре отсутствуют два (первый и третий) из четырех ци-стеинов. С-хемокины относительно специфичны для лимфоцитов (например, лимфотактин);
– CX3C-хемокины. Содержат три аминокислоты между двумя цистеинами. Единственным известным членом этого класса является фрактал-кин, существующий в двух формах. Клеточная белковая мембраносвязанная форма может появиться на эндотелиальных клетках под действием воспалительных цитокинов и обеспечивает сильную адгезию моноцитов и Т-клеток.
Вторая форма, растворимая, образуется при протеолизе мембраносвязанного белка и имеет потенциальную хемоаттрактантную активность в отношении тех же клеток.
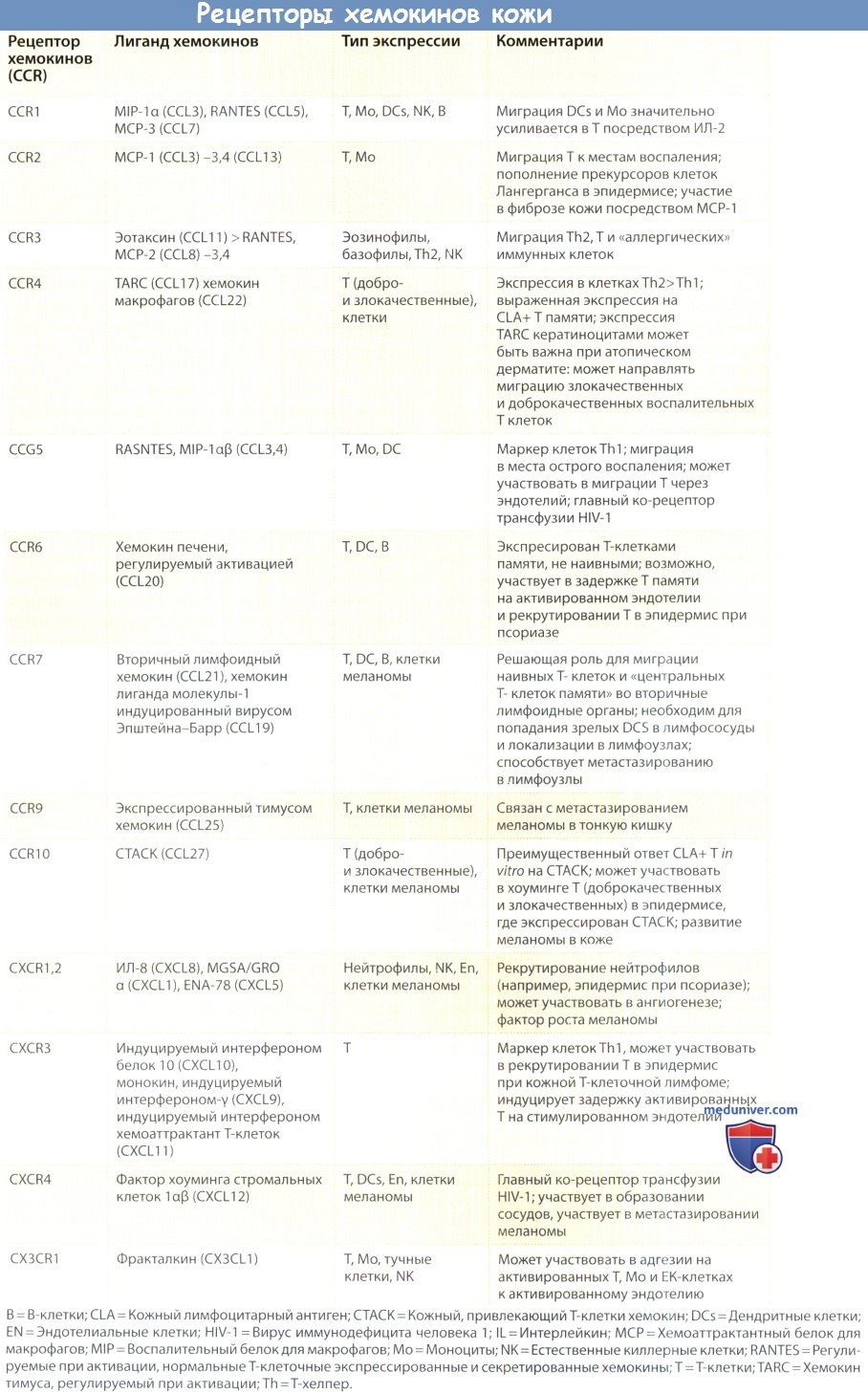
Хемокины опосредуют свои эффекты через взаимодействие с 7-трансмембранными G-белок-связанными рецепторами. Эти рецепторы (CXCR и CCR для СХС-и СС-хемокинов соответственно) высокоспецифичны, и лейкоцит обычно экспрессирует несколько типов таких рецепторов.
Определенные хемокиновые рецепторы (CXCR4, CCR5) работают как корецепторы для вирусного гликопротеина оболочки вируса иммунодефицита человека типа I и вовлечены в процессы связывания и проникновения вируса в клетку.
Хемокины выполняют две основные функции: стимулируют мобилизацию лейкоцитов в очаг воспаления и контролируют нормальную миграцию клеток в различные ткани. Некоторые хемокины образуются быстро в ответ на стимул воспаления и запускают мобилизацию лейкоцитов в очаг воспаления.
Другие хемокины образуются в тканях постоянно и ответственны за анатомическую сегрегацию различных популяций клеток в тканях. В обоих случаях хемокины могут образовываться в высоких концентрациях, прикрепляясь к протеогликанам на поверхности эндотелиальных клеток и в ВКМ.

– Рекомендуем ознакомиться со следующей статьей “Типы ферментов лизосом лейкоцитов и их функции”
Оглавление темы “Патогенез воспаления”:
- Цитокины участвующие в воспалении
- Хемокины участвующие в воспалении
- Типы ферментов лизосом лейкоцитов и их функции
- Образование нейропептидов и их функции при воспалении
- Система комплемента как плазменно-белковый медиатор воспаления
- Участие системы коагуляции и кининов как медиаторов воспаления
- Исходы острого воспаления
- Фазы острого воспаления и их морфология
- Причины хронического воспаления и его определение
- Морфология (гистология) хронического воспаления
Источник
Интерлейкин 6, интерлейкин 8 и хемокины. Роли интерлейкина 6, интерлейкина 8 и хемокинов при воспалении.Интерлейкин 6 (IL-6) является мультифункциональным цитокином, который продуцируют как лимфоидные, так и нелимфоидные клетки и который регулирует иммунный ответ, острофазный воспалительный ответ и гемопоэз. Рецепторы для 1L-6 обнаруживаются и на лимфоидных, и на нелимфоидных клетках. Одной из основных функций IL-6 является регуляция процессов созревания антителопродуцирующих клеток из В-лимфоцитов и самой продукции иммуноглобулинов. IL-6 участвует также в активации Т-лимфоцитов. Не менее существенный вклад вносит IL-6 в регуляцию синтеза острофазных белков, сопутствующего воспалению. Биосинтез острофазных белков геиатоцитами регулируется всей группой провоспалительных цитокинов, но IL-6 отводится особая роль “гепатоцит-активирующего фактора”. IL-6 может индуцировать синтез многих острофазных белков: фибриногена, al-антихимотрипсина, al-кислого гликопротеина, гаптоглобина, сывороточного амилоида A, CRP, a1-антитрипсина и а2-макроглобулина. Продукция альбумина при этом снижается. При развитии острой фазы воспаления уровень IL-6 в сыворотке крови коррелирует с уровнем CRP и с уровнем лихорадки у больного. Повышение уровня IL-6 в сыворотке крови может предшествовать подъему уровня CRP. Между провоспалительными цитокинами, для которых характерны синергидные эффекты, существуют достаточно сложные взаимнорегули-рующие отношения. В частности, IL-6 ингибирует продукцию IL-1 и TNFa, которые являются оба активными индукторами синтеза IL-6. Кроме того, IL-6 через гипоталамус-гипофизарное регуляторное звено усиливает продукцию кортизола, который, в свою очередь, действует на клетки печени, усиливая индукцию 1L-6 острофазных белков, но ингибирует экспрессию гена IL-6, как и генов других провоспалительных цитокинов.
Интерлейкин 8 и хемокиныВсе современные цитокины, основной биологической функцией которых является хемоаттрактантная активность, объединены под названием хемокины, а по структуре разделены на два семейства. Первое, с последовательностью С-Х-С, представлено прежде всего IL-8 и PF4, а также другими, менее изученными: GROa, GROp, GROy, NAP-2, ENA-78, IP-10 и GCP-2. Основными представителями второго семейства с последовательностью С-С являются МСР-1, MIP-1 и RANTES. Источниками хемокинов являются большинство клеток периферической крови и тканей. Основные биологические эффекты хемокинов связаны с их хемоаттрактантной активностью. Однако некоторые цитокины в отношении различных клеток-мишеней обладают и другими эффектами, связанными с активацией этих клеток. Еще задолго до открытия IL-8 у альвеолярных макрофагов была обнаружена способность продуцировать хемоаттрактант для нейтрофилов. В последние годы установлено, что эти наблюдения связаны преимущественно с IL-8. Так, у больных идиопатическим фиброзом легких была обнаружена повышенная экспрессия mRNA для IL-8, что коррелировало с содержанием IL-8, числом нейтрофилов в БАЖ и с тяжестью заболевания. Аналогичные наблюдения имеются в отношении МСР-1, который экспрессируется макрофагами, эпителиальными, эндотелиальными и гладкомышечными клетками легких. Высокий уровень IL-8 в легких обнаружен при остром воспалении. У больных респираторным дистресс-синдромом содержание IL-8, количество нейтрофилов коррелировало со смертностью. При муковисцидозе нейтрофильная эластаза, присутствующая в БАЖ, индуцирует продукцию IL-8 эпителиальными клетками бронхов. Хемокины также являются медиаторами аллергического воспаления. У больных БА наблюдается повышенная экспрессия IL-8 эпителиальными клетками бронхов, а повышенное наличие GM-CSF, IL-3 и IL-5 повышает чувствительность базофилов и эозинофилов больных БА к С-Х-С и С-С хемокинам. – Также рекомендуем “Интерлейкин 10, 4. Роли интерлейкина 10 и 4 при воспалении.” Оглавление темы “Воспаление легких.”: |
Источник
Молекулы адгезии. Роль молекул адгезии при воспалении.Движение лейкоцитов в очаг воспаления начинается с серии адгезионных событий, каждое из которых касается лейкоцитов определенного типа: нейтрофилов, моноцитов или лимфоцитов. Циркулирующие лейкоциты обычно вступают лишь в мимолетные контакты с эндотелиальными клетками посткапиллярных венул: лейкоциты как бы “скользят” по поверхности эндотелия сосудистой стенки. Эта фаза обеспечивается взаимодействием вначале Р-, а затем L- и Е-селектинов с углеводными компонентами мембран клеток. L-селектин экспрессирован на большинстве лейкоцитов. селектин эндотелиальных клеток опосредует адгезию нейтрофилов и моноцитов к эндотелию. Е-селектин экспрессируется на активированных эндотелиальных клетках и поддерживает адгезию лимфоцитов. Лигандами селектинов служат сиалил-фукозилированные олигосахариды в составе многих гликопротеинов и гликолипидов мембран клеток, например, муциноподобные молекулы. Муциноподобный домен содержит клеточная адгезионная молекула – мукозный адрессин (MAdCAM-1), которая за счет взаимодействия с L-селектином обеспечивает возврат лимфоцитов в мукозноассоциированную лимфоидную ткань. Фаза скольжения происходит без активации лейкоцитов, однако скользящие лейкоциты при контактах с поверхностью эндотелия получают сигналы активации, что ведет к их иммобилизации. Наступает вторая фаза прочной адгезии, опосредованная усилением способности лейкоцитарных интегринов связываться с лигандами из суперсемейства иммуноглобулинов на эндотелиальных клетках. В качестве сигналов активации могут служить воздействия цитокинов (хемокинов): MIP-ip, MCP-1, IL-8, MIF, PAF, С5а-фракции комплемента, которые способны связываться с глюкозамингликанами поверхности эндотелиальных клеток и действовать на “скользящие” лейкоциты.
Интегрины – это большое семейство молекул клеточной поверхности, представители которых обнаружены на большинстве типов клеток. Интегрины опосредуют взаимодействие клеток с их микроокружением, обеспечивая адгезию клетка – клетка и клетка – матрикс. Интегрины – это гетеродимеры гликопротеинов, состоящие из различных комбинаций а- и (J- цепей. Описано более 20 разных представителей интегринов. На лейкоцитах экспрессированы: LFA-1, Macl, pl50,95. Лигандами для LFA-1 являются : ICAM-1, ICAM-2, ICAM-3, для Macl -ICAM-1. Эти интегрины опосредуют адгезию к эндотелию нейтрофилов, базофилов, эозинофилов, моноцитов и лимфоцитов. В отличие от нейтрофилов остальные типы клеток могут адгезироваться к цитокин-активированным эндотелиальным клеткам через интегрины VLA-4 к лигандам VCAM-1. На поверхности эндотелиальных клеток лигандами интегринов служат молекулы, имеющие структурную гомологию с иммуноглобулинами. К ним относятся интерклеточные адгезионные молекулы: ICAM-1, ICAM-2, ICAM-3, васкулярно-клеточная адгезионная молекула – VCAM1. Последняя эксирессируется преимущественно на активированных эндотелиальных клетках. Следующая после прочной адгезии стадия трансмиграции лейкоцитов через эндотелий контролируется частично теми же интегринами, взаимодействующими с молекулами ICAM-1, расположенными и на внутренней, и на латеральной, и на базальной поверхности эндотелиальных клеток. Описаны и другие молекулы, облегчающие трансмиграцию лейкоцитов: например CD31 (РЕСАМ-1), обнаруженные и на эндотелиальных клетках, и на тромбоцитах, нейтрофилах, моноцитах, лимфоцитах. За трансмиграцию моноцитов отвечает интегрин CD18, но после активации эндотелиальных клеток под влиянием IL-1 и TNF-a трансмиграция идет при участии интегринов а, взаимодействующих с молекулой VCAM-1. Все стадии адгезии и трансмиграции зависят от активации эндотелиальных клеток, которая проявляется усилением экспрессии на них адгезионных молекул. Экспрессия Е-селектина усиливается в самые ранние стадии воспаления тромбином, гистамином или активированной системой комплемента, и не требует синтеза белка de novo. Роль стимуляторов на этой стадии могут играть различные оксиданты. – Также рекомендуем “Молекулы адгезии в подострой фазе воспаления.” Оглавление темы “Воспаление легких.”: |
Источник

