Роль эйкозаноидов при воспалении
Воспаление – реакция организма на повреждение или инфекцию, направленная на уничтожение инфекционного агента и восстановление повреждённых тканей. Продукция медиаторов воспаления – эйкозаноидов, гистамина, кини-нов (пептидных гормонов местного действия) – активируется каскадами реакций, запускающимися при внедрении инфекционных агентов или повреждении тканей. Фактором, лимитирующим скорость синтеза эйкозаноидов, служит освобождение жирной кислоты под действием
фосфолипазы А2. Фосфолипаза А2связана с мембранами клеток и активируется многими факторами: гистамином, кининами, механическим воздействием на клетку, контактом комплекса антиген-антитело с поверхностью клетки. Активация фосфолипазы А2 приводит к увеличению синтеза эйкозаноидов.
Многие эйкозаноиды выполняют функцию медиаторов воспаления и действуют на всех этапах воспаления. В результате увеличивается проницаемость капилляров, транссудат и лейкоциты проходят через сосудистую стенку. Лейкотриен В4 и липоксин А4 являются мощными факторами хемотаксиса; взаимодействуя с рецепторами, стимулируют движение лейкоцитов в область воспаления и секрецию ими лизосомальных ферментов и фагоцитоз чужеродных частиц.
Симптомы воспаления – покраснение, жар, отёк и боль. Покраснение и жар вызываются факторами, увеличивающими приток крови к
месту повреждения. Отёк – результат увеличения притока жидкости из капилляров и движения клеток белой крови в область воспаления. Боль вызывается химическими компонентами (продуктами распада тканей, протонами) и сдавлением нервных окончаний. В развитии этих признаков воспаления участвуют разные типы эйкозаноидов (табл. 8-8).
Роль эйкозаноидов в тромбообразовании
Свёртывание крови можно рассматривать как процесс, который поддерживается в состоянии равновесия противодействующими системами: свёртывания и противосвёртывания. В условиях патологии или при действии фармакологических средств это равновесие может смещаться в ту или другую сторону. В норме клетки эндотелия сосудов продуцируют простациклин I2, который препятствует агрегации тромбоцитов и сужению сосудов (рис. 8-51). При разрушении клеток эндотелия (например, в результате образова-
Таблица 8-8. Характеристика биологического действия основных типов эйкозаноидов
ния атеросклеротической бляшки) синтез PGI2 снижается. Тромбоциты контактируют с повреждённой стенкой сосуда, в результате чего активируется фосфолипаза А2. Это приводит к увеличению секреции ТХ стимулирующего агрегацию тромбоцитов и образование тромба в области повреждения сосуда (рис. 8-52), что часто приводит к развитию инфаркта.
При изучении факторов риска инфаркта миокарда было показано, что люди, потребляющие большое количество рыбьего жира, значительно меньше подвержены этому заболеванию, так как у них реже образуются тромбы в сосудах сердца. Оказалось, что на семейства эйкозаноидов, синтезируемых в организме, влияет состав жирных кислот пищи (см. выше табл. 8-3). Если с пищей поступает больше эйкозапентаеновой кислоты (20:5, ω-3), в большом количестве содержащейся в рыбьем жире, то эта кислота включается преимущественно в фосфолипиды мембран (вместо арахидоновой) и после действия фосфолипазы А2 служит основным субстратом для синтеза эйкозаноидов. Это имеет существенное влияние на свёртывание крови.
При обычной диете с преобладанием арахидо-новой кислоты (20:4, ω-6) над эйкозапентаено-вой действие ТХ А2 уравновешено действием PG I2 (рис. 8-53) и другими простагландинами. В случае диеты с преобладанием ω-3 кислот в клетках эндотелия образуются более сильные ингибиторы тромбообразования (PG I3, PG E3, PG D3), что снижает риск образования тромба и развития инфаркта миокарда.
Источник
Воспаление- это физиологическая реакция ткани на травму или раздражение. При воздействии на ткани механических, химических или иммунологических стимулов происходят синтез и высвобождение эйкозаноидов, поэтому воспалительная реакция всегда сопровождается выделением простагландинов.
В воспаленных тканях обнаруживается множество различных эйкозаноидов, но доминирующим продуктом является ПГЕ2. Наблюдается также присутствие тромбоксанов, простациклина и лейкотриенов. Синтез эйкозаноидов сопровождает ряд воспалительных заболеваний-от острого солнечного ожога до хронического ревматоидного артрита. Кроме того, в этот список входят ожоговые поражения, контактная экзема, псориаз, язвенный колит, увеит, остеоартриты и подагра.
При экспериментальном воспалении максимальный синтез эйкозаноидов наблюдается в острую фазу. Образование ТОА2 и ЛТВ4 быстро прекращается, а синтез ПГЕ2 (хотя он и сохраняется) ослабевает по мере прогрессирования воспалительного процесса. Тем не менее ткани, пораженные хроническим воспалением, продолжают генерировать эйкозаноиды. В тканях гранулемы через несколько дней после начала воспаления определяется высокое содержание эйкозаноидов, а синовиальные ткани через несколько дней после индукции иммунного артрита обнаруживают повышенную способность метаболизировать арахидоновую кислоту. Более того, образование эйкозаноидов хронически воспаленными тканями проявляется высоким уровнем ПГЕ2 и ЛТВ4, определяемым в синовиальной жидкости, аспири- руемой из суставов больных ревматоидным артритом (см. главу 33) или подагрой.
В воспалительной реакции участвуют несколько типов клеток, в том числе клетки окружающих тканей и кровеносных сосудов, а также мигрирующие клетки крови. Клетки различных типов вносят разные эйкозаноиды. Хотя высокие концентрации ТОВ2 определяются на ранних стадиях экспериментального воспаления, тромбоциты (основной источник тромбоксанов), вероятно, не являются источником эйкозаноидов в воспаленных тканях.
У животных при сниженном содержании тромбоцитов концентрации ТОВ2, ПГЕ2 и 6-кето- ПГБіа в воспалительных экссудатах не отличаются от таковых у контрольных животных, У животных с невысоким уровнем ПМЯЛ концентрации ТОВ2 и ЛТВ4 снижены, причем их уменьшение идет параллельно сокращению числа ПМЯЛ, накапливающихся в экссудате. Однако образование ПГЕ2 и простациклина остается практически неизменным при отсутствии ПМЯЛ. Эти наблюдения свидетельствуют о том, что при остром воспалении ПМЯЛ служат главным источником ТОВ2 и ЛТВ4, а ПГЕ2 и простациклин образуются в окружающих тканях и кровеносных сосудах.
Воспалительные свойства эйкозаноидов
Некоторые эйкозаноиды, особенно ПГЕ2, вносят свой вклад в симптомы воспаления. Простагландин Е2 и простациклин расслабляют гладкие мышцы сосудов и сильно расширяют прекапиллярные артериолы, в результате чего наблюдается характерная краснота (или эритема), сопровождающая острое воспаление. Кроме того, возрастает приток крови к воспаленным тканям, что в свою очередь увеличивает потерю плазмы, которая обусловлена действием веществ, повышающих проницаемость сосудов (гистамин, брадикинин). Совместные
эффекты увеличенного кровотока и повышенной проницаемости сосудов приводят к опухоли или отеку (см. главу 7). Тромбоксан А2 является мощным вазоконстриктором, и его образование при остром воспалении, вероятно, необходимо для предупреждения кровотечений. Продукты липоксигеназы в основном слабо влияют на сосудистый тонус, но ЛТВ4, ЛТС4 и ЛТБ4 вызывают образование волдырей и расслабление сосудов кожи человека посредством неизвестных механизмов.
Лейкотриен В4 – один из наиболее мощных среди известных сегодня факторов хемотаксиса лейкоцитов. Его активность обнаруживается во многих системах in vitro. Показано также, что ЛТВ4 обусловливает маргинацию лейкоцитов в микроциркуляции и их накопление во внесосудистых тканях. На этих наблюдениях основывается теория о локальном образовании ЛТВ4 как о важном механизме местного контроля рекруитирования воспалительных лейкоцитов в поврежденные ткани.
Наряду с другими факторами хемотаксиса (например, С5а комплемента) ЛТВ4 вызывает высвобождение лизосомных ферментов, что вносит дегенеративный компонент во многие воспалительные заболевания. В клеточной реакции участвует и другой продукт липоксигеназы-12- ГОТЕ. Хемотаксическая активность 12-ГОТЕ слабее, чем у ЛТВ4, однако высокие концентрации 12-ГОЭТЕ могут определяться в коже больных псориазом, что, вероятно, связано с большим количеством ПМЯЛ, инфильтрирующих дерму при этом воспалительном заболевании.
Эйкозаноиды вносят определенный вклад в такие симптомы воспаления, как боль и лихорадка. Простагландин Е2 и простациклин усиливают боль, вызванную брадикинином и гистамином, сенсибилизируя афферентные С- волокна (т. е. индуцируют состояние гипер- алгезии). Такая повышенная чувствительность обусловливает восприятие нормальных (не болевых) стимулов как болезненных; например, кожа при солнечном ожоге легко травмируется (натирается) даже одеждой. Простагландин Е2 представляет собой сильный пирогенный фактор; его высокие концентрации определяются в спинномозговой жидкости больных с бактериальной или вирусной инфекцией, вирусным энцефалитом или пирогенным менингитом. Пирогенная активность интерлейкина-1 (эндогенный пироген) опосредуется образованием ПГЕ2 (см. главы 15 и 19).
Таким образом, эйкозаноиды (например,
ПГЕ2, простациклин, ЛТВ4 и 12-ГОЭТЕ) продуцируются при воспалении и обладают высокой воспалительной активностью. Влияние противовоспалительных препаратов на метаболизм арахидоновой кислоты подтверждает роль эйкозаноидов как медиаторов воспаления. Ингибиторы синтеза простагландинов, такие как препараты, подобные ацетилсалициловой кислоте, обладают противовоспалительным, аналгезирующим и жаропонижающим действием. Аналогично этому препараты, снижающие липоксигеназную или циклооксигеназную активность, подавляют активацию лейкоцитов (см. главы 23 и 24).
Еще по теме Роль эйкозаноидов в воспалении:
- Модели иммунного острого воспаления . Локальная реакция Шварцмана – местное воспаление кожи
- Эйкозаноиды Дж. А. Салмон, Г. А. Хигс (J. A. Salmon, G. A. Higgs)
- Номенклатура эйкозаноидов
- Эйкозаноиды при анафилаксии дыхательных путей
- Биосинтез и метаболизм эйкозаноидов. Доступность предшественников жирных кислот
- Тромбоциты и воспаление
- Накопление мононуклеарных фагоцитов в местах воспаления
- Часть 3 Воспаление
- ВОСПАЛЕНИЕ ПРИДАТКОВ
- Накопление клеток и воспаление
- ВОСПАЛЕНИЕ
- Действие на медиаторы воспаления
- Воспаление
- Часть 1. Клетки, участвующие в воспалении
- Воспаление
- ВОСПАЛЕНИЕ ПРИДАТКОВ МАТКИ.
Источник
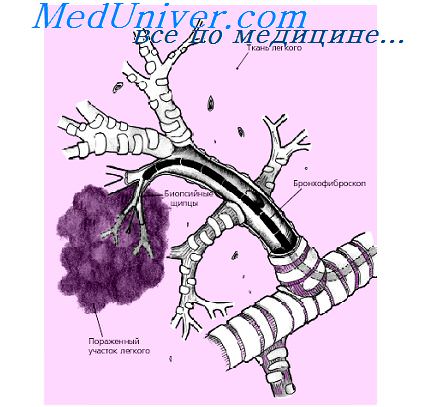
Эйкозаноиды. Воспаление бронхов и выделение эйкозаноидов.Среди БАВ, выделяемых различными клетками воспаления, большую роль играют эйкозаноиды,- продукты обмена арахидоновой кислоты. Клетки начинают синтез эйкозаноидов под воздействием различных веществ (аллергенов, токсинов, инфекционных агентов), при этом происходит стимуляция липидного метаболизма, активация фосфолипаз приводит к высвобождению в свободном виде арахидоновой кислоты из фосфолипидов клеточных мембран, а затем под влиянием циклоогксигеназных систем – простагландины, простациклины и тромбоксан. Гранулы тучных клеток содержат ферменты, запускающие каскад превращений арахидоновой кислоты. Легкие богаты простагландинами и принимают активное участие не только в их синтезе, но и в метаболизме, регулируя воспалительные реакции и тонус бронхов, поддерживая в норме баланс между различными группами простагландинов, которые имеют разнонаправленное физиологическое действие.
Установлено, что простагландины групп F2 и Д2, а также тромбоксан А2 вызывают бронхоспатическую реакцию и другие проявления, сопутствующие воспалению, а простагландины группы Е и простациклин – бронходилатацию. У больных БА даже в межприступный период в плазме крови повышено содержание метаболитов простагландина F и снижен уровень простагландина Е2. Найдена прямая связь между уровнем простагландина F2a в крови больных БА и степенью выраженности и длительностью бронхоспазма и установлена роль этого простагландина в развитии неспецифической гиперреактивности бронхов и усилении действия различных БАВ, причем эти эффекты потенцируются лейкотриенами, особенно лейкотриеном Д4. Это позволяет говорить о каскадном действии изначально малых количеств БАВ, а компенсаторное повышение выделения простациклина и его метаболитов эндотелием легочных сосудов, несмотря на его бронходилатирующее действие, не только не устраняет бронхообстрикцию, но даже может ее усугубить из-за неблагоприятного влияния на микроциркуляцию за счет потенцирования воспалительных изменений и образования отека. У больных БА найдено повышение содержания в бронхоальвеолярном лаваже лейкотриенов В4 и тромбоксана А2, образование которых также повышается при активации тромбоцитов и, в свою очередь, стимулирует их агрегацию, влияя на состояние микроциркуляции. Медленно действующее вещество анафилаксии, представляющее собою смесь цистеиновых лейкотриенов, участвует в бронхоспастической реакции, развитии отека и повышении сосудистой проницаемости, потенцируя действие гистамина, и обладает в сотни раз более активным действием, чем гистамин, причем наиболее сильным действием обладает цистеиновый лейкотриен Д4. Продукты 15-липооксигеназы, выделяющиеся, в основном активированными эозинофилами, усиливают ранний астматический ответ на гистамин у больных БА. – Также рекомендуем “Серотонин. Функции серотонина при воспалении бронхов.” Оглавление темы “Воспаление бронхов.”: |
Источник
1. Tabas I, Glass CK. Anti-inflammatory therapy in chronic disease: challenges and opportunities. Science. 2013 Jan 11; 339(6116):166-72. doi:10.1126/science.1230720.
2. Scrivo R, Vasile M, Bartosiewicz I, Valesini G. Inflammation as «common soil» of the multifactorial diseases. Autoimmun Rev. 2011 May;10(7):369-74. doi:10.1016/j.autrev.2010.12.006. Epub 2010 Dec 30.
3. Martin P, Nunan R. Cellular and molecular mechanisms of repair in acute and chronic wound healing. Br J Dermatol. 2015 Aug;173(2):370-8. doi:10.1111/bjd.13954. Epub 2015 Jul 14.
4. McInnes IB, Schett G. The pathogenesis of rheumatoid arthritis. N Engl J Med. 2011 Dec 8;365(23):2205-19. doi: 10.1056/NEJMra1004965.
5. Samadi AK, Bilsland A, Georgakilas AG, et al. A multi-targeted approach to suppress tumor-promoting inflammation. Semin Cancer Biol. 2015 Dec;35 Suppl:S151-84. doi:10.1016/j.semcancer.2015.03.006. Epub 2015 May 5.
6. Robinson WH, Lepus CM, Wang Q, et al. Low-grade inflammation as a key mediator of the pathogenesis of osteoarthritis. Nat Rev Rheumatol. 2016 Oct;12(10):580-92. doi:10.1038/nrrheum.2016.136. [Epub 2016 Aug 19]
7. Ridker PM, Lü scher TF. Anti-inflammatory therapies for cardiovascular disease. Eur Heart J. 2014 Jul 14;35(27):1782-91. doi:10.1093/eurheartj/ehu203. Epub 2014 May 26.
8. Minghetti L. Role of COX-2 in inflammatory and degenerative brain diseases. Subcell Biochem. 2007;42:127-41.
9. Kotas ME, Medzhitov R. Homeostasis, inflammation, and disease susceptibility. Cell. 2015 Feb 26;160(5):816-27.doi:10.1016/j.cell.2015.02.010.
10. Van Dyke TE, Kornman KS. Inflammation and factors that may regulate inflammatory response. J Periodontol. 2008 Aug;79(8 Suppl):1503-7. doi:10.1902/jop.2008.080239.
11. Nathan C, Ding A. Nonresolving inflammation. Cell. 2010 Mar 19;140(6):871-82. doi: 10.1016/j.cell.2010.02.029.
12. Freire MO, Van Dyke TE. Natural resolution of inflammation. Periodontol 2000. 2013 Oct;63(1):149-64. doi:10.1111/prd.12034.
13. Kumar H, Kawai T, Akira S. Pathogen recognition by the innate immune system. Int Rev Immunol. 2011 Feb;30(1):16-34. doi:10.3109/08830185.2010.529976.
14. Martinon F, Tschopp J. NLRs join TLRs as innate sensors of pathogens. Trends Immunol. 2005 Aug;26(8):447-54.
15. Serhan CN. Resolution phase of inflammation: novel endogenous anti-inflammatory and proresolving lipid mediators and pathways. Annu Rev Immunol. 2007;25:101-37.
16. Braga TT, Agudelo JS, Camara NO. Macrophages During the Fibrotic Process: M2 as Friend and Foe. Front Immunol. 2015 Nov 25;6:602. doi:10.3389/fimmu.2015.00602. eCollection 2015.
17. Насонов ЕЛ, Александрова ЕН, Авдеева АС, Рубцов ЮП. Т-регуляторые клетки при ревматоидном артрите. Научно-практическая ревматология. 2014;52(4):430–7. [Nasonov EL, Aleksandrova EN, Avdeeva AS, Rubtsov YuP. T-regulatory cells in rheumatoid arthritis. Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2014;52(4):430–7. (In Russ.)]. DOI:10.14412/1995-4484-2014-430-437
18. Crean D, Godson C. Specialised lipid mediators and their targets. Semin Immunol. 2015 May;27(3):169-76. doi: 10.1016/j.smim. 2015.05.002. Epub 2015 Jun 3.
19. Weylandt KH. Docosapentaenoic acid derived metabolites and mediators – The new world of lipid mediator medicine in a nutshell. Eur J Pharmacol. 2016 Aug 15;785: 108-15. doi:10.1016/j.ejphar.2015.11.002.Epub 2015 Nov 10.
20. Dennis EA, Cao J, Hsu YH, et al. Phospholipase A2 enzymes: physical structure, biological function, disease implication, chemical inhibition, and therapeutic intervention. Chem Rev. 2011 Oct 12;111(10): 6130-85. doi:10.1021/cr200085w. Epub 2011 Sep 12.
21. Dennis EA, Norris PC. Eicosanoid storm in infection and inflammation. Nat Rev Immunol. 2015 Aug;15(8):511-23. doi:10.1038/nri3859. Epub 2015 Jul 3.
22. Buczynski MW, Dumlao DS, Dennis EA. Thematic Review Series: Proteomics. An integrated omics analysis of eicosanoid biology. J Lipid Res. 2009 Jun;50(6):1015-38. doi:10.1194/jlr.R900004-JLR200. Epub 2009 Feb 24.
23. Newcomer ME, Gilbert NC. Location, location, location: compartmentalization of early events in leukotriene biosynthesis. J Biol Chem. 2010 Aug 13;285(33):25109-14. doi:10.1074/jbc.R110.125880. Epub 2010 May 27.
24. Korbecki J, Baranowska-Bosiacka I, Gutowska I, Chlubek D. Cyclooxygenase pathways. Acta Biochim Pol. 2014;61(4): 639-49. Epub 2014 Oct 23.
25. Ueno N, Takegoshi Y, Kamei D, et al. Coupling between cyclooxygenases and terminal prostanoid synthases. Biochem Biophys Res Commun. 2005 Dec 9;338(1):70-6. Epub 2005 Aug 29.
26. Ganesh T. Prostanoid receptor EP2 as a therapeutic target. J Med Chem. 2014 Jun 12;57(11):4454-65. doi:10.1021/jm401431x. Epub 2013 Dec 4.
27. Chen C. COX-2’s new role in inflammation. Nat Chem Biol. 2010 Jun;6(6):401-2. doi:10.1038/nchembio.375.
28. Harizi H. Epigenetic regulations of inflammatory cyclooxygenase-derived prostanoids: molecular basis and pathophysiological consequences. Mediators Inflamm. 2015;2015:841097. doi:10.1155/2015/841097. Epub 2015 Apr 6.
29. Brzozowski T, Konturek PC, Konturek SJ, et al. Role of prostaglandins in gastroprotection and gastric adaptation. J Physiol Pharmacol. 2005 Sep;56 Suppl 5:33-55.
30. Ellinsworth DC, Shukla N, Fleming I, Jeremy JY. Interactions between thromboxane AВ, thromboxane/prostaglandin (TP) receptors, and endothelium-derived hyperpolarization. Cardiovasc Res. 2014 Apr 1;102(1):9-16. doi:10.1093/cvr/cvu015. Epub 2014 Jan 26.
31. Sellers MM, Stallone JN. Sympathy for the devil: the role of thromboxane in the regulation of vascular tone and blood pressure. Am J Physiol Heart Circ Physiol. 2008 May;294(5):H1978-86. doi:10.1152/ajpheart.01318.2007. Epub 2008 Feb 29.
32. Gryglewski RJ. Prostacyclin among prostanoids. Pharmacol Rep. 2008 Jan-Feb; 60(1):3-11.
33. Smith WL, Garavito RM, DeWitt DL. Prostaglandin endoperoxide H synthases (cyclooxygenases)-1 and -2. J Biol Chem. 1996 Dec 27;271(52):33157-60.
34. Chen L, Yang G, Grosser T. Prostanoids and inflammatory pain. Prostaglandins Other Lipid Mediat. 2013 Jul-Aug;104-105:58-66. doi:10.1016/j.prostaglandins.2012.08.006. Epub 2012 Sep 3.
35. Rossitto M, Ujjan S, Poulat F, BoizetBonhoure B. Multiple roles of the prostaglandin D2 signaling pathway in reproduction. Reproduction. 2015 Jan;149(1):R49-58. doi: 10.1530/REP-14-0381. Epub 2014 Sep 30.
36. Le Loupp AG, Bach-Ngohou K, Bettan A, et al. Dual role for prostaglandin D2 in intestinal epithelial homeostasis. Med Sci (Paris). 2015 Jun-Jul;31(6-7):617-21. doi:10.1051/medsci/20153106014. Epub 2015 Jul 7.
37. Basu S. Bioactive eicosanoids: role of prostaglandin F(2α) and FВ-isoprostanes in inflammation and oxidative stress related pathology. Mol Cells. 2010 Nov;30(5):383-91. doi:10.1007/s10059-010-0157-1. Epub 2010 Nov 18.
38. Fan C, Katsuyama M, Wei H, et al. Molecular mechanisms underlying PGF2alpha-induced hypertrophy of vascular smooth muscle cells. Yakugaku Zasshi. 2010 Feb;130(2):211-4.
39. Kapadia R, Yi JH, Vemuganti R. Mechanisms of anti-inflammatory and neuroprotective actions of PPAR-gamma agonists. Front Biosci. 2008 Jan 1;13:1813-26.
40. Malmsten CL. Prostaglandins, thromboxanes, and leukotrienes in inflammation. Am J Med. 1986 Apr 28;80(4B):11-7.
41. Samuelsson B, Dahlen SE, Lindgren JA, et al. Leukotrienes and lipoxins: structures, biosynthesis, and biological effects. Science. 1987 Sep 4;237(4819):1171-6.
42. Mashima R, Okuyama T. The role of lipoxygenases in pathophysiology; new insights and future perspectives. Redox Biol. 2015 Dec;6:297-310. doi:10.1016/j.redox.2015.08.006. Epub 2015 Aug 7.
43. Kanaoka Y, Boyce JA. Cysteinyl leukotrienes and their receptors; emerging concepts. Allergy Asthma Immunol Res. 2014 Jul;6(4):288-95. doi:10.4168/aair.2014.6.4.288. Epub 2014 May 27.
44. Noguchi K, Okubo M. Leukotrienes in nociceptive pathway and neuropathic/inflammatory pain. Biol Pharm Bull. 2011;34(8): 1163-9.
45. Feltenmark S, Gautam N, Brunnström A, et al. Eoxins are proinflammatory arachidonic acid metabolites produced via the 15-lipoxygenase-1 pathway in human eosinophils and mast cells. Proc Natl Acad Sci U S A. 2008 Jan 15;105(2):680-5. doi:10.1073/pnas.0710127105. Epub 2008 Jan 9.
46. Jin J, Zheng Y, Boeglin WE, Brash AR. Biosynthesis, isolation, and NMR analysis of leukotriene A epoxides: substrate chirality as a determinant of the cis or trans epoxide configuration. J Lipid Res. 2013 Mar;54(3):754-61. doi:10.1194/jlr.M033746. Epub 2012 Dec 13.
47. Claesson HE, Griffiths WJ, Brunnström A, et al. Hodgkin Reed-Sternberg cells express 15-lipoxygenase-1 and are putative producers of eoxins in vivo: novel insight into the inflammatory features of classical Hodgkin lymphoma. FEBS J. 2008 Aug;275(16):4222-34. doi:10.1111/j.1742-4658.2008.06570.x. Epub 2008 Jul 18.
48. Nigam S, Zafiriou MP, Deva R, et al. Structure, biochemistry and biology of hepoxilins: an update. FEBS J. 2007 Jul;274(14):3503-12. Epub 2007 Jul 2.
49. Pace-Asciak CR. Pathophysiology of the hepoxilins. Biochim Biophys Acta. 2015 Apr;1851(4):383-96. doi:10.1016/j.bbalip.2014.09.007. Epub 2014 Sep 19.
50. Douda D, Grasemann H, Pace-Asciak C, Palaniyar N. A lipid mediator hepoxilin A3 is a natural inducer of neutrophil extracellular traps in human neutrophils. Mediators Inflamm. 2015;2015:520871. doi:10.1155/2015/520871. Epub 2015 Feb 16.
51. Panigrahy D, Kaipainen A, Greene ER, Huang S. Cytochrome P450-derived eicosanoids: the neglected pathway in cancer. Cancer Metastasis Rev. 2010 Dec;29(4):723-35. doi:10.1007/s10555-010-9264-x.
52. Capdevila JH, Falck JR, Harris RC. Cytochrome P450 and arachidonic acid bioactivation. Molecular and functional properties of the arachidonate monooxygenase. J Lipid Res. 2000 Feb;41(2):163-81.
53. Makita K, Falck JR, Capdevila JH. Cytochrome P450, the arachidonic acid cascade, and hypertension: new vistas for an old enzyme system. FASEB J. 1996 Nov;10(13): 1456-63.
54. Oni-Orisan A, Alsaleh N, Lee CR, Seubert JM. Epoxyeicosatrienoic acids and cardioprotection: the road to translation. J Mol Cell Cardiol. 2014 Sep;74:199-208. doi:10.1016/j.yjmcc.2014.05.016. Epub 2014 Jun 2.
55. Deng Y, Theken KN, Lee CR. Cytochrome P450 epoxygenases, soluble epoxide hydrolase, and the regulation of cardiovascular inflammation. J Mol Cell Cardiol. 2010 Feb;48(2):331-41. doi:10.1016/j.yjmcc.2009.10.022. Epub 2009 Nov 3.
56. Chandrasekharan JA, Sharma-Walia N. Lipoxins: nature’s way to resolve inflammation. J Inflamm Res. 2015 Sep 30;8:181-92. doi:10.2147/JIR.S90380. eCollection 2015.
57. Trostel J, Garcia GE. Endogenous Inhibitors of Kidney Inflammation. J Nephrol Res. 2015 Oct;1(2):61-68.
58. Gilroy DW. The role of aspirin-triggered lipoxins in the mechanism of action of aspirin. Prostaglandins Leukot Essent Fatty Acids. 2005 Sep-Oct;73(3-4):203-10.
59. Brzozowski T, Konturek PC, Pajdo R, et al. Physiological mediators in nonsteroidal antiinflammatory drugs (NSAIDs)-induced impairment of gastric mucosal defense and adaptation. Focus on nitric oxide and lipoxins. J Physiol Pharmacol. 2008 Aug;59 Suppl 2:89-102.
60. Serhan CN. Pro-resolving lipid mediators are leads for resolution physiology. Nature. 2014 Jun 5;510(7503):92-101. doi:10.1038/nature13479.
61. Headland SE, Norling LV. The resolution of inflammation: Principles and challenges. Semin Immunol. 2015 May;27(3):149-60. doi:10.1016/j.smim.2015.03.014. Epub 2015 Apr 22.
62. Serhan CN, Dalli J, Colas RA, et al. Protectins and maresins: New pro-resolving families of mediators in acute inflammation and resolution bioactive metabolome. Biochim Biophys Acta. 2015 Apr;1851(4):397-413. doi:10.1016/j.bbalip.2014.08.006. Epub 2014 Aug 17.
63. Serhan CN, Dalli J, Karamnov S, et al. Macrophage proresolving mediator maresin 1 stimulates tissue regeneration and controls pain. FASEB J. 2012 Apr;26(4):1755-65. doi:10.1096/fj.11-201442. Epub 2012 Jan 17.
64. Zurier RB, Burstein SH. Cannabinoids, inflammation, and fibrosis. FASEB J. 2016 Jul 19. pii: fj.201600646R. [Epub ahead of print]
65. Rouzer CA, Marnett LJ. Endocannabinoid oxygenation by cyclooxygenases, lipoxygenases, and cytochromes P450: cross-talk between the eicosanoid and endocannabinoid signaling pathways. Chem Rev. 2011 Oct 12;111(10):5899-921. doi:10.1021/cr2002799. Epub 2011 Sep 19.
66. Turcotte C, Chouinard F, Lefebvre JS , Flamand N. Regulation of inflammation by cannabinoids, the endocannabinoids 2-arachidonoyl-glycerol and arachidonoylethanolamide, and their metabolites. J Leukoc Biol. 2015 Jun;97(6):1049-70. doi:10.1189/jlb.3RU0115-021R. Epub 2015 Apr 15.
67. Hermanson DJ, Gamble-George JC, Marnett LJ, Patel S. Substrate-selective COX-2 inhibition as a novel strategy for therapeutic endocannabinoid augmentation. Trends Pharmacol Sci. 2014 Jul;35(7):358-67. doi:10.1016/j.tips.2014.04.006. Epub 2014 May 18.
68. Новиков АА, Александрова ЕН, Диатроптова МА, Насонов ЕЛ. Роль цитокинов в патогенеза ревматоидного артрита. Научно-практическая ревматология. 2010; 48(2):71-82. [Novikov AA, Aleksandrova EN, Diatroptova MA, Nasonov EL. Role of cytokines in the pathogenesis of rheumatoid arthritis. Nauchno-prakticheskaya revmatologiya = Rheumatology Science and Practice. 2010;48(2):71-82. (In Russ.)]. DOI:10.14412/1995-4484-2010-1420
69. Sommerfelt RM, Feuerherm AJ, Skuland T, Johansen B. Cytosolic phospholipase A2 modulates TLR2 signaling in synoviocytes. PLoS One. 2015 Apr 20;10(4):e0119088. doi:10.1371/journal.pone.0119088. eCollection 2015.
70. Yousefi B, Jadidi-Niaragh F, Azizi G, et al. The role of leukotrienes in immunopathogenesis of rheumatoid arthritis. Mod Rheumatol. 2014 Mar;24(2):225-35. doi:10.3109/14397595.2013.854056.
71. Stanczyk J, Kowalski ML. The role of cyclooxygenase and prostaglandins in the pathogenesis of rheumatoid arthritis. Pol Merkur Lekarski. 2001 Nov;11(65):438-43.
72. Sakata D, Yao C, Narumiya S. Prostaglandin E2, an immunoactivator. J Pharmacol Sci. 2010;112(1):1-5. Epub 2010 Jan 6.
73. Akaogi J, Nozaki T, Satoh M, Yamada H. Role of PGE2 and EP receptors in the pathogenesis of rheumatoid arthritis and as a novel therapeutic strategy. Endocr Metab Immune Disord Drug Targets. 2006 Dec;6(4):383-94.
74. Hikiji H, Takato T, Shimizu T, Ishii S. The roles of prostanoids, leukotrienes, and platelet-activating factor in bone metabolism and disease. Prog Lipid Res. 2008 Mar;47(2):107-26. doi:10.1016/j.plipres.2007.12.003. Epub 2008 Jan 8.
75. Wang MJ, Huang Y, Huang RY, et al. Determination of role of thromboxane A2 in rheumatoid arthritis. Discov Med. 2015 Jan; 19(102):23-32.
76. Tuncer S, Banerjee S. Eicosanoid pathway in colorectal cancer: Recent updates. World J Gastroenterol. 2015 Nov 7;21(41):11748-66. doi:10.3748/wjg.v21.i41.11748.
77. Gui H, Tong Q, Qu W, et al. The endocannabinoid system and its therapeutic implications in rheumatoid arthritis. Int Immunopharmacol. 2015 May;26(1):86-91. doi:10.1016/j.intimp.2015.03.006. Epub 2015 Mar 16.
78. Hashimoto A, Hayashi I, Murakami Y, et al. Antiinflammatory mediator lipoxin A4 and its receptor in synovitis of patients with rheumatoid arthritis. J Rheumatol. 2007 Nov;34(11): 2144-53. Epub 2007 Oct 1.
79. Fukuda S, Kohsaka H, Takayasu A, et al. Cannabinoid receptor 2 as a potential therapeutic target in rheumatoid arthritis. BMC Musculoskelet Disord. 2014 Aug 12;15:275. doi:10.1186/1471-2474-15-275.
80. Arnardottir HH, Dalli J, Norling LV, et al. Resolvin D3 Is Dysregulated in Arthritis and Reduces Arthritic Inflammation. J Immunol. 2016 Aug 17. pii: 1502268. [Epub ahead of print]
81. Zhang W, Ouyang H, Dass CR, Xu J. Current research on pharmacologic and regenerative therapies for osteoarthritis. Bone Res. 2016 Mar 1;4:15040. doi:10.1038/boneres.2015.40. eCollection 2016.
82. He W, Pelletier JP, Martel-Pelletier J, et al. Synthesis of interleukin 1beta, tumor necrosis factor-alpha, and interstitial collagenase (MMP-1) is eicosanoid dependent in human osteoarthritis synovial membrane explants: interactions with antiinflammatory cytokines. J Rheumatol. 2002 Mar;29(3):546-53.
83. Wang P, Guan PP, Guo C, et al. Fluid shear stress-induced osteoarthritis: roles of cyclooxygenase-2 and its metabolic products in inducing the expression of proinflammatory cytokines and matrix metalloproteinases. FASEB J. 2013 Dec;27(12):4664-77. doi:10.1096/fj.13-234542.Epub 2013 Aug 20.
84. Gosset M, Berenbaum F, Levy A, et al. Mechanical stress and prostaglandin E2 synthesis in cartilage. Biorheology. 2008;45 (3-4):301-20.
85. Laufer S. Role of eicosanoids in structural degradation in osteoarthritis. Curr Opin Rheumatol. 2003 Sep;15(5):623-7.
86. Marcouiller P, Pelletier JP, Guevremont M, et al. Leukotriene and prostaglandin synthesis pathways in osteoarthritic synovial membranes: regulating factors for interleukin 1beta synthesis. J Rheumatol. 2005 Apr;32(4):704-12.
87. Martel-Pelletier J, Mineau F, Fahmi H, et al. Regulation of the expression of 5-lipoxygenase-activating protein/5-lipoxygenase and the synthesis of leukotriene B(4) in osteoarthritic chondrocytes: role of transforming growth factor beta and eicosanoids. Arthritis Rheum. 2004 Dec;50(12):3925-33.
88. Benabdoune H, Rondon EP, Shi Q, et al. The role of resolvin D1 in the regulation of inflammatory and catabolic mediators in osteoarthritis. Inflamm Res. 2016 Aug;65(8): 635-45. doi:10.1007/s00011-016-0946-x. Epub 2016 Apr 7.
89. La Porta C, Bura SA, Negrete R, Maldonado R. Involvement of the endocannabinoid system in osteoarthritis pain. Eur J Neurosci. 2014 Feb;39(3):485-500. doi: 10.1111/ejn.12468.
90. Burston JJ, Sagar DR, Shao P, et al. Cannabinoid CB2 receptors regulate central sensitization and pain responses associated with osteoarthritis of the knee joint. PLoS One. 2013 Nov 25;8(11):e80440. doi:10.1371/journal.pone.0080440. eCollection 2013.
91. Sheibanie AF, Tadmori I, Jing H, et al. Prostaglandin E2 induces IL-23 production in bone marrow-derived dendritic cells. FASEB J. 2004 Aug;18(11):1318-20. Epub 2004 Jun 4.
92. Haroon N. Ankylosis in ankylosing spondylitis: current concepts. Clin Rheumatol. 2015 Jun;34(6):1003-7. doi:10.1007/s10067-015-2956-4.
93. Tan S, Wang R, Ward MM. Syndesmophyte growth in ankylosing spondylitis. Curr Opin Rheumatol. 2015 Jul;27(4):326-32. doi:10.1097/BOR.0000000000000179.
94. de Vlam K, Lories RJ, Luyten FP. Mechanisms of pathologic new bone formation. Curr Rheumatol Rep. 2006 Oct;8(5):332-7.
95. Каратеев АЕ, Эрдес ШФ. Применение нестероидных противовоспалительных препаратов при анкилозирующем спондилите: долго и упорно! Терапевтический архив. 2014;(11):123-7. [Karateev AE, Erdes ShF. The use of nonsteroidal antiinflammatory drugs in ankylosing spondylitis: long and hard! Terapevticheskii arkhiv. 2014;86(11):123-7. (In Russ.)] .
96. Brune K, Patrignani P. New insights into the use of currently available non-steroidal anti-inflammatory drugs. J Pain Res. 2015 Feb 20;8:105-18. doi:10.2147/JPR.S75160. eCollection 2015.
97. Diaz-Gonzalez F, Sanchez-Madrid F. NSAIDs: learning new tricks from old drugs. Eur J Immunol. 2015 Mar;45(3):679-86. doi:10.1002/eji.201445222. Epub 2015 Jan 21.
98. Vecchio AJ, Malkowski MG. The structural basis of endocannabinoid oxygenation by cyclooxygenase-2. J Biol Chem. 2011 Jun 10;286(23):20736-45. doi:10.1074/jbc.M111.230367. Epub 2011 Apr 13.
99. Vecchio AJ, Simmons DM, Malkowski MG. Structural basis of fatty acid substrate binding to cyclooxygenase-2. J Biol Chem. 2010 Jul 16;285(29):22152-63. doi:10.1074/jbc.M110.119867. Epub 2010 May 12.
100. Xu S, Rouzer CA, Marnett LJ. Oxicams, a class of nonsteroidal anti-inflammatory drugs and beyond. IUBMB Life. 2014 Dec; 66(12):803-11. doi:10.1002/iub.1334. Epub 2014 Dec 23.
101. Gates BJ, Nguyen TT, Setter SM, Davies NM. Meloxicam: a reappraisal of pharmacokinetics, efficacy and safety. Expert Opin Pharmacother. 2005 Oct;6(12):2117-40.
102. Каратеев АЕ. Мелоксикам: «золотая середина» нестероидных противовоспалительных препаратов. Терапевтический архив. 2014;86(5):99-105. [Karateev AE. Meloxicam: «the Golden mean» nonsteroidal anti-inflammatory drugs. Terapevticheskii arkhiv. 2014;86(5):99-105. (In Russ.)].
103. Schoenfeld P. Gastrointestinal safety profile of meloxicam: a meta-analysis and systematic review of randomized controlled trials. Am J Med. 1999 Dec 13;107(6A): 48S-54S.
104. Asghar W, Jamali F. The effect of COX-2selective meloxicam on the myocardial, vascular and renal risks: a systematic review. Inflammopharmacology. 2015 Feb;23(1):1-16. doi:10.1007/s10787-014-0225-9. Epub 2014 Dec 17.
105. Iyer JP, Srivastava PK, Dev R, et al. Prostaglandin E(2) synthase inhibition as a therapeutic target. Expert Opin Ther Targets. 2009 Jul;13(7):849-65. doi:10.1517/14728220903018932.
106. Mbalaviele G, Pauley AM, Shaffer AF, et al. Distinction of microsomal prostaglandin E synthase-1 (mPGES-1) inhibition from cyclooxygenase-2 inhibition in cells using a novel, selective mPGES-1 inhibitor. Biochem Pharmacol. 2010 May 15;79(10):1445-54. doi:10.1016/j.bcp.2010.01.003. Epub 2010 Jan 11.
107. O’Byrne PM. Asthma treatment: antileukotriene drugs. Can Respir J. 1998 JulAug;5 Suppl A:64A-70A.
108. Cingi C, Muluk N, Ipci K, Sahin E. Antileukotrienes in upper airway inflammatory diseases. Curr Allergy Asthma Rep. 2015 Nov; 15(11):64. doi:10.1007/s11882-015-0564-7.
109. Kulkarni SK, Singh VP. Licofelone: the answer to unmet needs in osteoarthritis therapy? Curr Rheumatol Rep. 2008 Jan;10(1):43-8.
110. Bertolini A, Ottani A, Sandrini M. Dual acting anti-inflammatory drugs: a reappraisal. Pharmacol Res. 2001 Dec;44(6):437-50.
111. Raynauld JP, Martel-Pelletier J, Bias P, et al. Protective effects of licofelone, a 5-lipoxygenase and cyclo-oxygenase inhibitor, versus naproxen on cartilage loss in knee osteoarthritis: a first multicentre clinical trial using quantitative MRI. Ann Rheum Dis. 2009 Jun;68(6):938-47. doi:10.1136/ard.2008.088732. Epub 2008 Jul 23.
112. Blake D, Robson P, Ho M, et al. Preliminary assessment of the efficacy, tolerability and safety of a cannabis-based medicine (Sativex) in the treatment of pain caused by rheumatoid arthritis. Rheumatology (Oxford). 2006 Jan;45(1):50-2. Epub 2005 Nov 9.
113. Elati A, Weeks AD. The use of misoprostol in obstetrics and gynaecology. BJOG. 2009 Oct;116 Suppl 1:61-9. doi:10.1111/j.1471-0528.2009.02329.x.
114. Linet OI, Ogrine FG. Efficacy and safety of intracavernosal alprostadil in men with erectile dysfunction. The Alprostadil Study Group. N Engl J Med. 1996 Apr 4;334(14):873-7.
115. Woodward DF, Wang JW, Poloso NJ. Recent progress in prostaglandin F2α ethanolamide (prostamide F2α) research and therapeutics. Pharmacol Rev. 2013 Jul 26;65(4):1135-47. doi:10.1124/pr.112.007088. Print 2013.
116. LeVarge BL. Prostanoid therapies in the management of pulmonary arterial hypertension. Ther Clin Risk Manag. 2015 Mar 31;11:535-47.doi:10.2147/TCRM.S75122. eCollection 2015.
117. Cholkar K, Gilger BC, Mitra AK. Topical delivery of aqueous micellar resolvin E1 analog (RX-10045). Int J Pharm. 2016 Feb 10;498(1-2):326-34. doi:10.1016/j.ijpharm.2015.12.037. Epub 2015 Dec 17.
Источник
