Стадии изменения кровообращения в очаге воспаления
Стадии расстройства микроциркуляции:
1. Кратковременный спазм артериол:результат рефлекторного возбуждения вазоконстрикторов на воздействие флогогена (несколько сек-мин).
2. Артериальная гиперемия:увеличение притока артериальной крови и кровенаполнения ткани. Способствует усилению оксигенации тканей, снижению степени ацидоза, активации обмена веществ.
3. Венозная гиперемия:сопровождается замедлением тока крови, расширением просвета посткапилляров и венул. В механизме выделяют 3 группы факторов:
нарушения реологических свойств крови;
изменения сосудистой стенки;
тканевые изменения.
4. Предстаз:периодические маятникообразные движения крови «вперёд ↔ назад» в результате механического препятствия оттоку крови по посткапиллярам, венулам и венам агрегатами форменных элементов крови в просвете сосуда и пристеночными микротромбами.
5. Стаз:возникает в результате закрытия просвета микрососудов агрегатами клеток изнутри и сдавления экссудатом снаружи. Является завершающей стадией сосудистых изменений.
Экссудация
Экссудация (от лат.exsudatio- выпотевание) – компонент воспаления, включающий в себя триаду: сосудистые реакции и изменения кровообращения в очаге воспаления; выход жидкой части крови из сосуда (собственно экссудацию); эмиграцию (выход лейкоцитов в очаг воспаления и развитие фагоцитарной реакции).
Основная причинаэкссудации – увеличение проницаемости стенок микрососудов вследствие множества процессов, повреждающих их стенку.
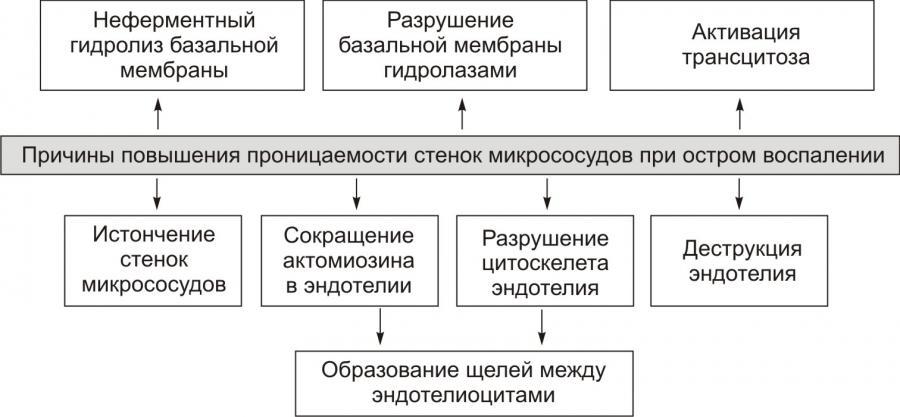
Рис. 9. – Причины повышения проницаемости стенок микрососудов
при остром воспалении (по П.Ф. Литвицкому, 2002)
Основные факторы механизма экссудации:
1) повышение проницаемости сосудов (венул и капилляров) в результате воздействия медиаторов воспаления и в ряде случаев самого воспалительного агента – ведущий фактор;
2) увеличение кровяного (фильтрационного) давления в сосудах очага воспаления вследствие гиперемии;
3) возрастание осмотического и онкотического давления в воспаленной ткани в результате альтерации и начавшейся экссудации и, возможно, снижение онкотического давления крови из-за потери белков при обильной экссудации.
Виды экссудата
1. Серозный экссудат: состоит из полупрозрачной жидкости, богатой белком (до 2-3%), и немногочисленных клеток, в том числе форменных элементов крови (ФЭК).
2. Фибринозный экссудат: содержит большое количество фибриногена и фибрина.
3. Гнойный экссудат:мутная густая жидкость, содержащая до 6-8% белка и большое количество различных форм лейкоцитов, микроорганизмов, погибших клеток повреждённой ткани.
4. Геморрагический экссудат:содержит большое количество белка и эритроцитов, а также другие ФЭК.
5. Гнилостный (ихорозный) экссудат: любой вид экссудата может приобрести гнилостный (ихорозный) характер при внедрении в очаг воспаления гнилостной микрофлоры (анаэробы).
6. Смешанные формыэкссудата могут быть самыми разнообразными (например, серозно-фибринозный, гнойно-фибринозный, гнойно-геморрагический и др.).
Значение процесса экссудации в очаге воспаления
Адаптивное:
транспорт медиаторов воспаления
доставка иммуноглобулинов в очаг воспаления
удаление из крови метаболитов и токсинов
задержка и/или фиксация в очаге воспаления флогогена и продуктов его действия на ткань
Патогенное:
сдавление, смещение органов и тканей экссудатом
возможность излияния экссудата в полости тела и сосуды
формирование абсцессов, развитие флегмон
Эмиграция (emigratio, от лат.emigrare – выселяться, переселяться) – выход лейкоцитов из сосудов в ткань.Осуществляется путем диапедеза через стенку венул и является ключевым событием патогенеза воспаления.
Стадии процесса эмиграции лейкоцитов в очаге воспаления:
1. краевое стояние лейкоцитов;
2. адгезия к эндотелию и проникновения через сосудистую стенку;
3. направленное движение лейкоцитов в очаге воспаления.
На стадии краевого стояния(маргинации) условно выделено четыре последовательных этапа.
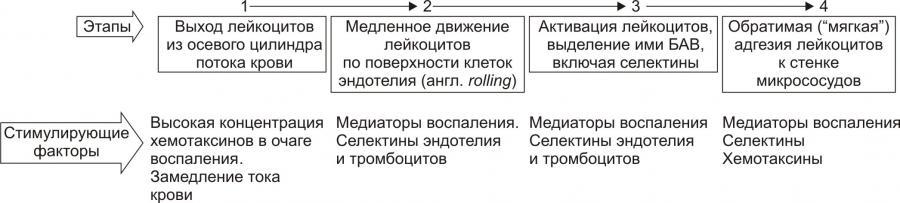
Рис. 10. -Этапы стадии краевого стояния лейкоцитов и факторы, стимулирующие краевое стояние (по П.Ф. Литвицкому, 2002)
В стадии адгезии и выхода лейкоцитов выделяют 2 этапа: устойчивой («плотной») адгезии (1) и прохождения лейкоцитов через стенку микрососуда (2).

Рис. 11. -Этапы стадии устойчивой адгезии и прохождения лейкоцитов через стенку микрососуда; факторы, стимулирующие адгезию (по П.Ф. Литвицкому, 2002)
Значение эмиграции лейкоцитов в очаг воспаления:
поглощение и деструкция флогогенного фактора;
поглощение и деструкция поврежденных клеток и неклеточных структур;
синтез и выделение медиаторов воспаления;
поглощение и «процессинг» антигенов и презентация последних лимфоцитам;
развитие иммунных и/или аллергических реакций.
Источник
Развитие воспаления всегда связано с изменением периферического кровообращения.
Этот процесс можно рассматривать во времени и пространстве. В первом случае речь идет об изменениях периферического кровообращения, происходящих в одном конкретном месте при развитии воспаления, а во втором – об особенностях кровообращения в разных участках воспалительных очагов.
Стадии изменения кровообращения при воспалении
Последовательность (стадии) изменений кровообращения в очаге воспаления следующая:
- артериолярный спазм;
- артериальная гиперемия;
- венозная гиперемия;
- застой.
Артериолярный спазм
Временное сужение сосудов вызвано действием воспалительных этиологических агентов: они вызывают возбуждение гладкой мускулатуры сосудосуживающих нервов и артериол.
![]() Артериолярный спазм
Артериолярный спазм
Спазм кратковременен, потому что первичное действие патогенных агентов быстро прекращается. Кроме того, норадреналин, медиатор симпатической иннервации артериол, быстро разрушается из-за повышения уровня моноаминоксидазы в воспаленных тканях.
Биологическая нацеленность на спазм артериол в организме заключается в подавлении дальнейшего распространения патогенного агента.
Артериальная гиперемия
Гиперемия развивается в следствии действия биологически активных веществ: сначала высвобождается гистамин (в течение 5-30 минут), затем хинины (в течение 1-8 часов), а затем – простагландины и другие медиаторы.
Эти медиаторы снижают мышечный тонус прекапиллярного сфинктера и артериол и тем самым способствуют их расширению. Кроме того, в условиях ацидоза и расслоения чувствительность α-адренорецепторов к сосудосуживающему действию адреналина на прекапиллярные сфинктеры снижается. Артериальная гиперемия развивается как в результате прямого сосудистого, так и аксонального рефлекса.
Увеличивается приток артериальной крови к очагу воспаления. По мере повышения артериального давления открываются ранее нефункционирующие капилляры. Вены расширяются, и в результате удаляется вся притекающая кровь.
![]() Повышение артериального давления
Повышение артериального давления
При воспалительной артериальной гиперемии диаметр капилляров и вен увеличивается больше, чем когда артериальная гиперемия не связана с воспалением. Часто эти сосуды расширяются неравномерно – местами появляются варикозные выросты, что способствует «краевому положению» и эмиграции лейкоцитов.
По мере увеличения числа функционирующих капилляров линейная скорость кровотока и, в частности, объемная скорость увеличиваются. Увеличение линейной скорости кровотока увеличивает количество кислорода в венозной крови, и, таким образом, артериовенозный кислородный промежуток уменьшается.
Однако из-за увеличенного объема кровотока количество кислорода, получаемого тканями, увеличивается, что аналогично объему кровотока, умноженному на артериовенозную разницу в кислороде.
Сильная артериальная гиперемия наблюдается при остром воспалении кожи. Вызывает характерное для воспаления местное покраснение.
Венозная гиперемия
По мере прогрессирования воспаления артериальная гиперемия переходит в венозную. Биологически активные вещества, ацидоз, лизосомы лейкоцитов и бактериальные ферменты разрушают венозные и мелкие венозные десмосомы – волокна эластичной и коллагеновой соединительной ткани, окружающие капилляры и вены.
Лизосомные ферменты действуют как непосредственно на коллагеназу сосудистой стенки, так и опосредованно – они влияют на участие образующихся веществ (катионных белков, простагландинов). Катионные белки высвобождают гистамин из тучных клеток в периваскулярном пространстве. В результате капилляры и вены теряют тонус и расширяются под действием артериального давления. Уменьшается скорость кровотока, способствует переносу жидкой части крови к месту воспаления (экссудации).
Постепенно меняется расположение элементов формы в кровотоке. При артериальной гиперемии элементы формы располагаются в основном в центре кровеносного сосуда, но на стенках есть плазма и несколько лейкоцитов. Теперь это разделение исчезает. Кроме того, в кислой среде элементы плесени и стенки сосудов набухают, просвет сосудов сужается.
В первые минуты после смены начинают образовываться тромбы. В результате повреждения стенки формоэлементов и сосудов высвобождаются и активируются факторы свертывания (I, II, III, V, VII, X, XII и др.), Ускоряется свертывание крови. Тромбоз дополнительно затрудняет венозный отток и усиливает прохождение жидкой части крови к тканям, поэтому кровь продолжает сгущаться, образуются агрегаты эритроцитов и сгустки. По мере ускорения свертывания крови фибрин и глобулины откладываются в лимфатических сосудах, и образуются конгломераты лимфоцитов, что затрудняет возврат лимфы из места воспаления.
По мере перехода жидкой части крови и элементов формы к месту воспаления (эмиграции) давление жидкости в воспаленных тканях увеличивается. Мелкие вены и лимфатические сосуды еще сильнее сдавливаются, в результате чего прогрессируют нарушения оттока крови и лимфы («магический круг» патогенеза).
Таким образом, переходу артериальной гиперемии в венозную способствуют два фактора:
- внутрисосудистые факторы – набухание и агрегация формоэлементов, положение края лейкоцитов, тромбообразование, загустение крови, набухание эндотелия, нарушения структуры вен и мелких вен;
- внесосудистые факторы (факторы экссудата) – лимфатическое подавление экссудатом.
Описанная венозная гиперемия (застой) была названа Конгеймом истинной воспалительной гиперемией. Выраженно часто встречается у пациентов с хроническим воспалением: оттенок воспаления синеватый.
Стазислокальное прекращение кровотока
Венозная гиперемия, скопление элементов формы, шлак и застой в очаге воспаления возникают в основном в капиллярах, венах и мелких венах, поэтому обычно говорят о застойных явлениях (венозных) и истинном застое капилляров.
![]() Застой капилляров
Застой капилляров
Перед остановкой кровотока часто возникают колебательные движения крови – во время систолы кровь движется вперед, во время диастолы – назад. Когда пульсовая волна проходит через расширенные артериолы во время систолы, возникает так называемый капиллярный пульс.
Ионы водорода и калия повышают возбудимость нервных рецепторов в месте воспаления. Эти ионы, осмотически активные вещества, полипептиды (брадикинин), гистамин, а также механические факторы (экссудат, расширенные кровеносные сосуды и лимфатические сосуды) раздражают рецепторы чувствительных нервов и вызывают местные клинические признаки воспаления, боли. Капиллярные импульсы также механически раздражают рецепторы и вызывают пульсирующую боль, например, у пациентов с панаридозом, пульпитом и другими острыми воспалениями.
В дополнение к маятниковым движениям, которые происходят в сердечном ритме, на стадии венозной гиперемии происходят другие изменения кровотока – закупорка капилляров агрегатами состава, промывание тромба, сжатие открытия или закрытия просвета капилляров, региональное расширение капилляров и т. д. Эти нарушения не являются синхронными.
Однако наблюдаемые изменения кровообращения при развитии воспаления не всегда постоянны. Спазм артериол часто не обнаруживается. Острое воспаление после легкого ожога в основном характеризуется артериальной гиперемией, тогда как сразу после сильного кислотного ожога наблюдается застой. При хроническом воспалении кожи обычно наблюдаются признаки венозной гиперемии, отека и цианоза.
Если посмотреть на клинически выраженное очаговое воспаление в пространстве, наиболее выраженное повреждение ткани находится в центре очага (зона альтерации) – тромбоз сосудов, некроз тканей, гнойные тела, микрофаги, а также могут быть обнаружены наиболее серьезные отеки.
Зона альтерации окружена тканями с высокой концентрацией биологически активных веществ, в которых возникают тяжелые нарушения кровообращения – венозный застой и венозная гиперемия. Затем, по направлению к периферии, следует самая широкая область – артериальная гиперемия, которая вызывает покраснение от источника воспаления.
В области артериальной гиперемии концентрация биологически активных веществ ниже. Зона микрофага по направлению к периферии окружена зоной макрофагов и фибробластов.
Продолжение статьи
- Часть 1. Этиология и патогенез воспаления. Классификация.
- Часть 2. Особенности обмена веществ при воспалении.
- Часть 3. Физико – химические изменения. Роль нервной и эндокринной систем в развитии воспаления.
- Часть 4. Изменения в периферическом кровообращении при воспалении.
- Часть 5. Экссудация. Экссудат и транссудат.
- Часть 6. Эмиграция лейкоцитов. Хемотаксис.
- Часть 7. Фагоцитоз. Асептическое и острое воспаление.
- Часть 8. Распространение. Последствия. Принципы лечения воспаления.
Источник

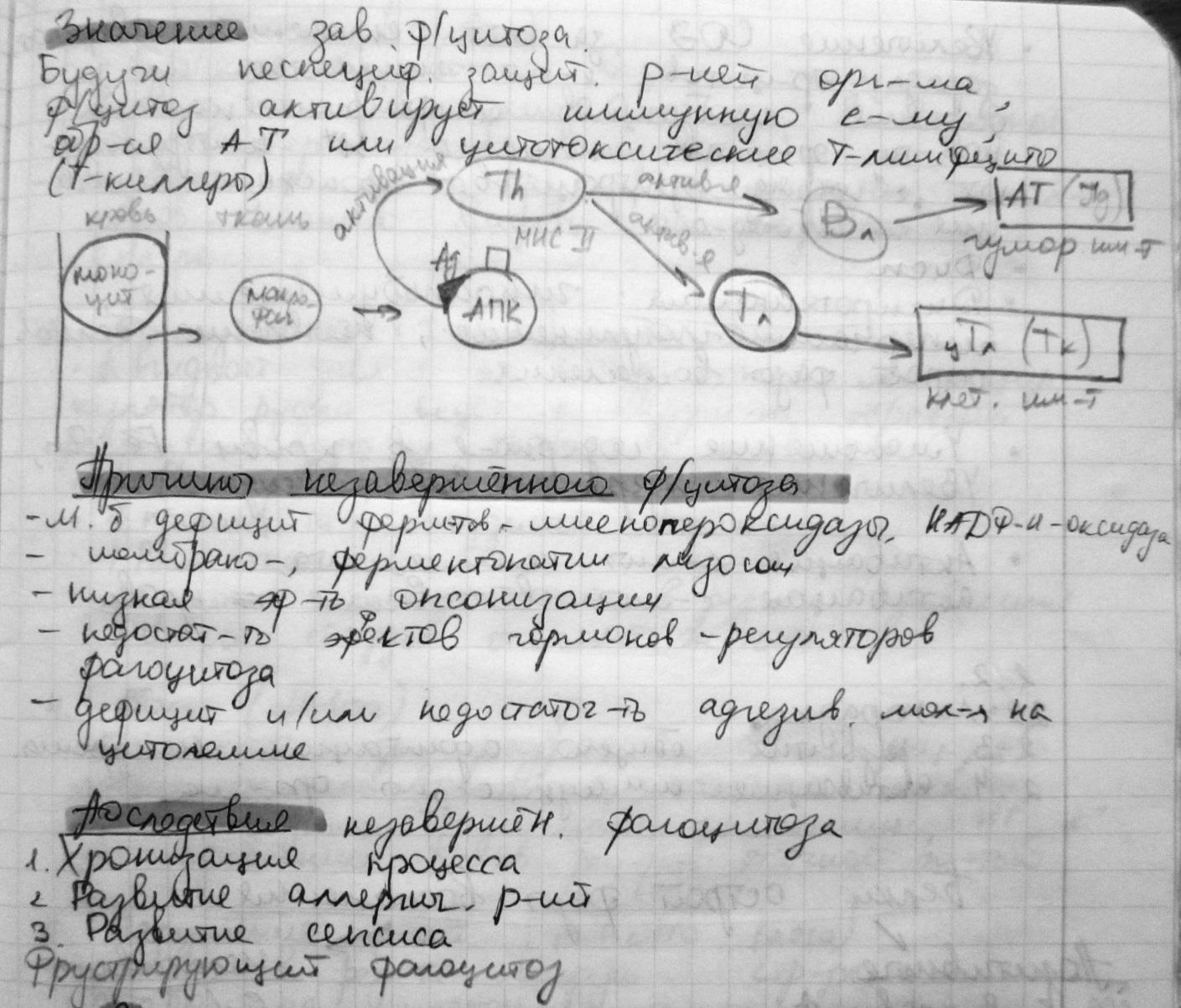
37. Механизм экссудации и эмиграции лейкоцитов в очаге воспаления. Фагоцитоз (виды, стадии, механизмы, значение). Причины незавершенного фагоцитоза.
Выход жидкой части крови в интерстиций очага – собственно экссудация происходит вследствие резкого повышения проницаемости гистогематического барьера и как следствие усиления процесса фильтрации и микровезикулярного транспорта. Выход жидкости и растворенных в ней веществ осуществляется в местах соприкосновения эндотелиальных клеток. Щели между ними могут увеличиваться при расширении сосудов и округлении эндотелиальных клеток. Кроме того, клетки эндотелия способны “заглатывать” мельчайшие капельки жидкости (микропиноцитоз), переправлять их на противоположную сторону и выбрасывать в близлежащую среду (экструзия).
Результат экссудации -заполнение интерстициальных пространств и очага В. экссудатом. Экссудат отличается от трансудата тем, что содержит большее количество белков (не менее 30 г/л), протеолитических ферментов, иммуноглобулинов. Если проницаемость стенки сосудов нарушена незначительно, то в экссудат проникают альбумины и глобулины. При сильном нарушении проницаемости из плазмы в ткань поступает белок с большей молекулярной массой (фибриноген). При первичной, а затем и вторичной альтерации проницаемость сосудистой стенки увеличивается на столько, что через нее начинают проникать не только белки, но и клетки. При венозной гиперемии этому способствует расположение лейкоцитов вдоль внутренней оболочки мелких сосудов и более или менее прочное их прикрепление к эндотелию (феномен краевого стояния лейкоцитов).
Раннюю транзиторную реакцию роста проницаемости сосудов обуславливает действие гистамина, ПГЕ, лейкотриена Е4, серотонина, брадикинина. Действие экзогенных этиологических факторов механической (травма, ранение), термической или химической природы, вызывая первичную альтерацию, приводит к длительной реакции роста проницаемости. В результате действия этиологического фактора происходит некроз эндотелиалльных клеток на уровне артериол небольшого диаметра, капилляров и венул, что ведет к стойкому возрастанию их проницаемости. Отсроченная и стойкая реакция роста проницаемости микрососудов развивается в очаге В. через часы или сутки от его начала. Она характерна для В., вызванного ожогами, излучением и аллергическими реакциями отсроченного (замедленного) типа.
Биологический смысл экссудации как компонента В. состоит в отграничении очага В. через сдавление кровеностных и лимфатических микрососудов вследствие интерстиналльного отека, а также в разведении флогогенов и факторов цитолиза в очаге В. для предотвращения избыточной вторичной альтерации.
Виды экссудатов: серозный, гнойный, геморрагический, фиброзный, смешанный экссудат
Этапы миграции лейкоцитов. (Лекция 5)



38. Пролиферация (механизмы формирования). Значение воспаления. Роль реактивности организма при воспалении. Принципы профилактики и терапии воспаления.
Пролиферация характеризуется увеличением числа стромальных и паренхиматозных клеток и образованием межклеточного вещества. Направлена на восстановление поврежденных и замещение разрушенных тканевых элементов.
Пролиферация и завершение процесса.
По мере очищения очага В. наступает пролиферация (от лат. proliferatio – размножение) – интенсификация деления фибробластов и образования ими стромы соединительной ткани. Продуктивную или пролиферативную стадию В. иногда называют стадией репарации. Пролиферацию завершает инволюция рубца, то есть уничтожение и элиминация лишних коллагеновых структур. Основные клеточные эффекторы пролиферации – это активированные мононуклеарные фагоциты, фибробласты и иммунокомпетентные клетки. Фибробласты в очаге В. образуют и высвобождают коллаген и энзимколлагеназу, образуют фибронектин, определяющий миграцию, пролиферацию и адгезию фибробластов. Мононуклеары и лимфоциты секретируют цитокины как стимулирующие, так и подавляющие эти функции фибробластов. Нейтрофилы, как клеточные эффекторы В., влияют на пролиферацию, секретируя тканеспецифические ингибиторы, взаимодействующие по принципу обратной связи.
Одновременно с процессом пролиферации идет процесс активного погашения воспалительного процесса – ингибицией ферментов, дезактивацией В., детоксикацией и выведением токсических продуктов. Активность клеток В. тормозится разными механизмами. Что касается ингибиторов, важнейшую роль играют 2-макроглобулин, -антихимотрипсин, антитромбин III и 2-антиплазмин. Они являются главными ингибиторами кининобразующих ферментов крови и таким образом устраняют их влияние: расширение и повышение проницаемости сосудов. Кроме того, она являются главными ингибиторами системы коагуляции, фибринолиза и комплемента, ингибируют элластазу и коллагеназу лейкоцитов и тем самым предохраняют от разрушения элементы соединительной ткани. В прекращении разрушительных влияний при В. важную роль играет устранение свободных радикалов. Внутри клеток свободные радикалы нейтрализуют супероксиддисмктаза, а в экстрацеллюлярной фазе – церулоплазмин, катализирую реакцию НО2+НО2-Н2О+О2.
Изменения взаимоотношение между клетками. Они перестают вырабатывать одни медиаторы и начинают синтезировать другие. Теперь на тот же медиатор клетка может дать совсем другой ответ, потому что на ее поверхности появляются совсем другие рецепторы, а прежние проникают внутрь (интернализация).
В инактивации клеток В., кроме местных факторов, большую роль играют также и общие факторы, в том числе эндокринные. Гормон коры надпочечников кортизол тормозит синтез вазоактивных веществ в клетках, вызывает лимфопению, уменьшает число базофилов и эозинофилов. Кроме того, он стабилизирует мембраны лизосом, угнетает выработку ИЛ-1. Фагоцитарной активности к концу В. возрастает. Благодаря этому зона В. освобождается от некротизированный клеток, чуждых и токсических веществ.
Таким образом, в конце В., в деле его завершения решающую роль играют две клетки: фибробласт и эндотелиоцит. Два процесса совершаются в этот период: заселение зоны фибробластами и неоангиогенез, т.е. образование новых кровеносных и лимфатических сосудов.
При небольших повреждениях тканей, при ранах, заживающих первичным натяжением, воспалительный процесс заканчивается полным восстановлением. При гибели больших массивов клеток дефект замещается соединительной тканью с последующим образованием рубца. Этим В. обычно и заканчивается. В некоторых случаях наблюдается избыточное образование рубцовой ткани, которая может деформировать орган и нарушать его функцию.
Условия, необходимые для начала пролиферации:
1.Действие противовоспалительных медиаторов.
2.Полная деструкция и устранение флогогенного агента.
3.Нормальное функционирование лимфатической системы.
4.Совместная работа Макрофаг+лимфоцит
5.На смену нейтрофилам в очаг воспаления должны прийти макрофаги.
ЗНАЧЕНИЕ ВОСПАЛЕНИЯ ДЛЯ ОРГАНИЗМА
Как и при других типических процессах, вредное и полезное сочетается в неразрывной связи. В нем сочетается и мобилизация защитных сил организма, и явления повреждения, “полома”. Организм защищается от воздействия чуждых и вредных ему факторов путем отграничения воспалительного очага от всего организма, формирования вокруг очага В. своеобразного барьера с односторонней проницаемостью. Локализация очага В. препятствует распространению инфекции. За счет экссудации снижается концентрация токсических веществ в самом очаге В. Воспаленная зона не только фиксирует, но и поглощает токсические вещества, обеспечивает их детоксикацию. В очаге В. создаются также и неблагоприятные условия для жизни м/о.
Вторая противоположная заключается в том, что В. являясь эволюционно выработанным защитным процессом, в то же самое время оказывает повреждающее влияние на организм, всегда несет в себе элемент разрушения. Борьба с “агрессором” в зоне В. неизбежно сочетается с гибелью собственных клеток. В некоторых случаях начинает преобладать альтерация, что приводит к гибели ткани или целого органа. Экссудация может вызвать нарушение питания ткани, ее ферментативное расплавление, гипоксию и общую интоксикацию.
ВЛИЯНИЕ РЕАКТИВНОСТИ ОРГАНИЗМА НА РАЗВИТИЕ ВОСПАЛЕНИЯ
Воспаление – всегда местная реакция сосудов, нервов, тканей на повреждение. Однако, характер (выраженность, распространенность, темпы развития) процесса зависит от состояния организма, его резистентности и реактивности.
В зависимости от реактивности организма выделяют:
нормергическую форму развития воспаления (протекает «мягко», с хорошо выраженными местными признаками и общими проявлениями);
гиперергическую форму (протекает «бурно», с хорошо выраженными явлениями альтерации и экссудации, может развиваться «некротическое» воспаление типа феномена Артюса);
гипоергическую форму (воспаление со слабо выраженными местными и общими проявлениями). Положительное гипоергическое воспаление развиваются в организме с высокой резистентностью. Отрицательное гипоергическое воспаление (течет длительно и вяло) формируется в ослабленном организме (старческом возрасте, при голодании).
Характер и интенсивность реакций различных уровней организации организма зависят от их реактивности и резистентности.
При опухолевых заболеваниях системы крови (гемобластозы в виде различных лейкозов и гематосарком и др.) воспаление ослаблено, а при агранулоцитозе и панмиелофтизе развивается некротическое воспаление.
При сахарном диабете отмечают затяжные гнойно-септические воспалительные процессы.
При пищевом (белковом) голодании воспаление ослаблено, а рубцевание в ране происходит медленно и слабо.
При различных видах авитаминозов выявляют разные деструктивные процессы в очаге воспаления. В частности, при дефиците витамина А усиливаются процессы альтерации и некроза, при авитаминозе С развиваются геморрагические изменения, при авитаминозе В усиливаются дегенеративные явления и т.д.
ПРИНЦИПЫ ПРОФИЛАКТИКИ ВОСПАЛЕНИЯ
Они направлены на предупреждение травматизации разных уровней организации организма.
Для этого используют такие методы, способы и средства, которые обеспечивают повышение адаптации и резистентности кожи, слизистых оболочек и других тканей и органов к действию разных флогогенных раздражителей (биологических, химических, физических). Например, рекомендуют различные виды и способы закаливания организма (в частности, к холоду, гипоксии, физическим нагрузкам), а также использование, как правило, внутрь различных адаптогенов, особенно растительного происхождения, и др.
12.15. ПРИНЦИПЫ ТЕРАПИИ ВОСПАЛЕНИЯ
Для лечения воспаления используют все известные принципы: этиотропный, патогенетический, саногенетический и симптоматический.
Этиотропная терапия направлена на ликвидацию или ослабление неблагоприятных условий, но главное – на прекращение влияния флогогенного фактора или уменьшение силы и/или длительности его повреждающего действия на клеточно-тканевые структуры организма. Последнее, в частности, достигается путем:
• устранения травмирующего инородного тела, например занозы, путем извлечения из тканей;
• уничтожения или ослабления действия патогенных вирусов, грибов, паразитов путем использования бактерицидных или бактериостатических медикаментозных и немедикаментозных средств;
• нейтрализации повреждающих факторов (кислот, щелочей и других химических соединений) и т.д.
Патогенетическая терапия заключается в блокировании или разрыве основного, ведущих и второстепенных звеньев патогенеза воспаления, осуществляемых следующими способами:
• ослабление избыточных процессов альтерации и экссудации посредством использования способов и средств, уменьшающих расстройства регионарного кровообращения (особенно микроциркуляции) и метаболизма;
•ускорение очищения очага воспаления от погибших клеточно-тканевых структур, микроорганизмов и токсинов посредством использования хирургических или гидролитических средств;
•снижение гипоксии и её негативных последствий, для чего используют различного строения и механизма действия антиги-поксанты или средства, улучшающие насыщение тканей кислородом;
• уменьшение гипоксемии посредством восстановления местного кровообращения и улучшения насыщения гемоглобина кислородом;
• торможение синтеза и действия медиаторов воспаления первого порядка (гистамина, серотонина, кининов и др.);.
• снижение образования и действия свободных радикалов и перекисей с помощью неферментных и ферментных антиоксидантов.
Саногенетическая терапия направлена на активизацию защитных, компенсаторных и приспособительных реакций и механизмов, направленных на ускорение и улучшение восстановления нарушенных морфологии, метаболизма и функций тканей очага воспаления посредством стимуляции адаптивных, иммунных и пролиферативных реакций и механизмов. В частности, этого достигают назначением способов и средств, нормализующих и активизирующих:
• образование медиаторов воспаления 2-го порядка (основное значение которых заключается в стимуляции процессов репаративной регенерации);
• специфический и неспецифический, клеточный и гуморальный иммунитет (образование и активность микро- и макрофагов, иммунных антител и других бактерицидных и бактериостатических веществ);
• состояние местного кровообращения и микроциркуляции;
• метаболические процессы;
• состояние антиоксидантной системы;
• процессы пролиферации и др.
Симптоматическая терапия заключается в предупреждении, ослаблении и ликвидации неприятных местных и общих симптомов, возникающих в организме в ответ на вызванные воспалением повреждения клеточно-тканевых структур. Этого достигают применением различных медикаментозных и немедикаментозных способов и средств, уменьшающих выраженность и длительность разнообразных как эмоционально негативных ощущений, так и патологических общих и местных изменений (плохое настроение, страх, ухудшение общего состояния, боль, нарушения в виде гипо- и диссомнии, нарушения аппетита в виде ано-, гипо- и дисорексий, другие расстройства как регуляторных, так и исполнительных систем организма: нервной, эндокринной, иммунной, сердечно-сосудистой, дыхательной, пищеварительной, детоксицирующей, выделительной и др.).
Смысл и цель использования при воспалении различных лечебных воздействий – усиление защитных, компенсаторных и приспособительных реакций и ослабление реакций и механизмов повреждения клеточно-тканевых структур.
Воспаление целесообразно не подавлять, а разумно, адекватно характеру и степени возникших в организме нарушений, регулировать или оптимизировать его основные процессы. При лечении воспаления необходимо бороться либо за общее (снижение и ликвидация интоксикации), либо за местное (если оно определяет исход заболевания), либо сначала бороться за местное, затем за общее или наоборот.
Соседние файлы в предмете [НЕСОРТИРОВАННОЕ]
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
- #
Источник
