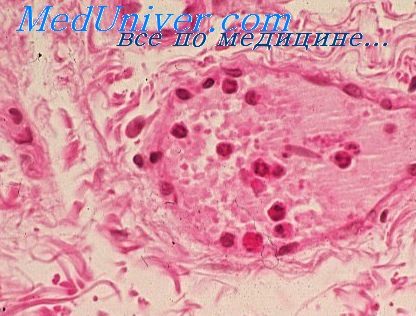
Типы воспаления и его роль в иммунном ответе
Иммунная система. ВоспалениеИммунная система и процесс воспаления участвуют в защите организма от проникающих в него микроорганизмов, отвечая на повреждение. Однако неадекватная активация этих систем приводит к широкому спектру воспалительных нарушений. Воспаление характеризуется следующими признаками: • расширением сосудов, ведущим к покраснению тканей; Физиология воспалительного процесса обладает некоторыми сходными характеристиками с физиологией повреждения. Реакции, которые они опосредуют, имеют цель обеспечить ответ организма на вторжение микроорганизмов, стресс или увеличение местного кровотока в области повреждения, обеспечивая тем самым миграцию в эту область лейкоцитов и других форменных элементов крови. Реакции обеспечивают выполнение большого количества важных процессов: возникновение боли в попытке уменьшить степень повреждения, изменение местной среды для уменьшения концентрации повреждающих веществ и миграцию лейкоцитов для уничтожения микроорганизмов.
Кроме того, многие аутакоиды, выделяемые в ответ на повреждение или инфекцию, вызывают увеличение сосудистой проницаемости, приводящее к отеку, и обеспечивают процесс регенерации и защиты ткани, который в случае неадекватности может приводить к изменению функции ткани. Ключевой дополнительной характеристикой иммунного ответа является способность лимфоцитов распознавать чужеродные белки (антигены), которые могут быть поверхностными белками на патогенах или, у некоторых людей, совершенно безвредными белками (такими как пыльца растений или чешуйки кожи животных), вызывающими аллергические реакции. Лимфоциты образуются из стволовых клеток костного мозга, затем в тимусе развиваются Т-лимфоциты, а в костном мозге — В-лимфоциты. Т-лимфоциты имеют на своей поверхности антигенные Т-клеточные рецепторы. Т-лимфоциты специфически распознают антигены, ассоциированные с главным комплексом гистосовместимости (HLA-антигены), на антигенпрезентирующих клетках — макрофагах и дендритных клетках. В случае активации Т-лимфоцитов посредством антигена через Т-клеточные рецепторы продуцируются растворимые белки, называемые цитокинами, которые передают сигнал Т-лимфоцитам, В-лимфоцитам, моноцитам/макрофагам и другим клеткам. Т-лимфоциты классифицируют на два подвида: – Также рекомендуем “В-лимфоциты. Причины начала воспаления” Оглавление темы “Препараты влияющие на иммунную систему”: |
Источник
Оглавление темы “Селезенка. Лимфатические узлы. Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Механизмы, контролирующие иммунную систему.”: Стадии иммунного ответа. Формы иммунного ответа. Воспаление. Ранний защитный воспалительный ответ.Ранний защитный воспалительный ответ призван препятствовать внедрению и распространению возбудителя, по возможности быстро удалять его из организма. Ранний защитный воспалительный ответ разыгрывается в течение первых 4 сут после внедрения возбудителя. Ранний защитный ответ против внедрившихся в организм патогенных микроорганизмов обеспечивается факторами врожденного иммунитета, к которым относятся фагоцитирующие клетки крови и тканей, естественные киллеры, циркулирующие в крови белковые молекулы, обладающие защитными свойствами (компоненты системы комплемента и др.), а также межклеточные медиаторы — цитокины. Ранний воспалительный ответ стимулирует последующий специфический иммунный ответ, влияет на его форму, способствуя развитию наиболее эффективного против конкретного микроорганизма специфического иммунного ответа.
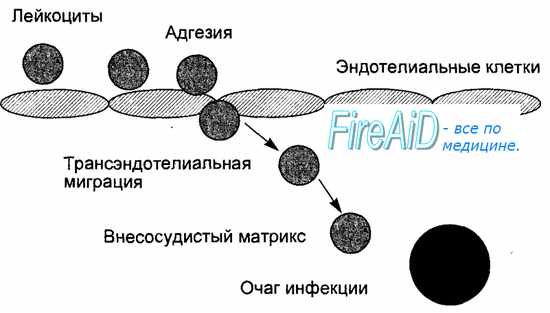
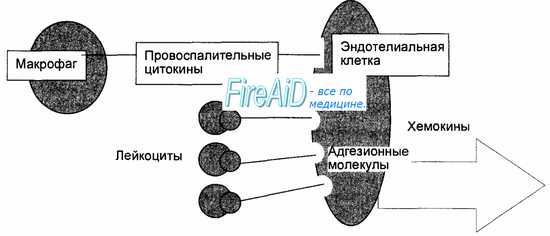
Ранний воспалительный ответ начинается с привлечения лейкоцитов из кровяного русла в очаг инфекции с последующей их активацией для удаления возбудителя (рис. 8.6). Мобилизация лейкоцитов в очаг инфекции стимулируется провоспалительными цитокинами, а опосредуется адгезионными молекулами на поверхности лейкоцитов и эндотелиальных клеток, а также молекулами хемокинов и их рецепторами. Провоспалительные цитокины (туморнекротизирующий фактор—ТНФ, интерлейкин-1 — ИЛ-1) продуцируются и секретируются макрофагами при фагоцитозе возбудителя. Под действием этих цитокинов на поверхности эндотелиальных клеток, появляются адгезионные молекулы вначале для нейтрофилов, а затем для моноцитов и лимфоцитов, ответственные за прилипание лейкоцитов к эндотелию сосудов. Кроме того, активированные цитокинами эндотелиальные клетки продуцируют хемокины, достигающие высокой концентрации на уровне очага инфекции (рис. 8.7). Этим обеспечивается прочная адгезия лейкоцитов к эндотелиальным клеткам с последующей их трансэндотелиальной миграцией и выходом в ткани в направлении очага инфекции (см. рис. 8.6). Таким образом, ранний воспалительный ответ проявляется инфильтрацией очага инфекции фагоцитирующими клетками, где эти клетки получают дополнительные сигналы активации от микробных продуктов и компонентов (липополисахарид клеточной стенки бактерий), от компонентов активированной системы комплемента и от провоспалительных цитокинов, в том числе, от гамма-интерферона, продуцируемого и секретируемого активированными естественными киллерами. Активированные фагоцитирующие клетки приобретают повышенную способность убивать захваченных микробов, что способствует удалению возбудителя. Активированные под влиянием провоспалительных цитокинов эндотелиальные клетки продуцируют молекулы вазодилататоров, под действием которых усиливается местный кровоток, повышается проницаемость сосудов для макромолекул фибриногена, который, покидая сосуды, превращается в фибрин, что способствует ограничению очага инфекции. В случае попадания в организм небольшого количества низковирулентных возбудителей ранний воспалительный ответ подавляет очаг инфекции.
Удаление из кровяного русла попавших в кровь единичных бактериальных клеток является функцией системы комплемента. Большая часть компонентов комплемента синтезируются гепатоцитами и мононуклеарными фагоцитами. Компоненты комплемента (С1, С2, СЗ, С4, С5, С6, С7, С8, С9, факторы В и D) содержатся в крови в неактивной форме. При попадании в кровяное русло бактерий на их поверхности каскад ферментативных реакций ведет к последовательной активации компонентов системы комплемента («альтернативный путь активации») с формированием мембран-атакующего комплекса (С5—С9), вызывающего лизис бактерий. В процессе активации системы комплемента накапливаются фрагменты, которые опосредуют разные биологические эффекты: привлечение лейкоцитов в очаг инфекции или воспаления (хемотаксис) — фрагмент С5а, усиление фагоцитоза (опсонизацию) — СЗb, индукцию синтеза и секреции медиаторов воспаления — С3а, С5а. (При развитии специфического иммунного ответа и появлении в кровяном русле комплексов антиген—антитело другой каскад ферментативных реакций ведет к активации системы комплемента — «классический путь активации») – Также рекомендуем “Представление антигена. Распознавание антигена. Взаимодействие Т-хелперов ( Тh1 ) с антигенпредставляющими клетками.” |
Источник
Лекция 13
ВОСПАЛЕНИЕ
• Воспаление — один из самых распространенных общепатологических процессов и лежит в основе многих заболеваний (воспалительные заболевания). Неудивительно поэтому, что со времен Гиппократа взгляды на воспаление исторически отражали взгляды на сущность болезни вообще. Поэтому воспаление испытало груз всех течений в медицине — гуморализма, целлюляризма, нервизма, физиологизма, а в конце XX столетия — влияние достижений иммунологии, генетики и молекулярной биологии.
ИСТОРИЧЕСКАЯСПРАВКА
Клинические признаки воспаления были впервые описаны римским энциклопедистом Цельсом 2000 лет назад. Он относил к ним красноту (rabor), припухлость ткани — опухоль (tumor), жар (calor) и боль (dolor). В начале нашей эры греческий врач Гален дополнил эти четыре признака пятым — нарушением функции (functio laesa).
В довирховский период все многочисленные исследования воспаления проводились путем визуальных наблюдений, хотя и предпринимались попытки выделения различных его форм — катаральное, флегмонозное, гнойное, острое, хроническое воспаление (К.Рокитанский, 1846). Р.Вирхов в “целлюлярной патологии” (1858) смог раскрыть механизмы каждого из классических признаков воспаления: краснота и жар связаны с воспалительной гиперемией, припухлость — со скоплением в ткани экссудата, боль — с повреждением (альтерацией) ткани. Отстаивая свою нутритивную (питательную) теорию воспаления, Р.Вирхов противопоставляет паренхиматозный тип воспаления отделительному (экссудативному).
Важным этапом изучения воспаления в XIX веке явились исследования Ю.Конгеймом (1878) сосудистого компонента воспалительной реакции, позволившие выдвинуть сосудистую теорию воспаления. Подтверждением этой теории послужило открытие А.С.Шкляревским краевого стояния лейкоцитов и В.В.Подвысоцким (1899) межэндотелиальной миграции лейкоцитов в очаге воспаления.
К концу прошлого столетия сущность воспалительной реакции стала достаточно ясной: это защитно-приспособительная реакция, а назначение ее заключается как в уничтожении агента, вызвавшего повреждение, так и в восстановлении поврежденной ткани. Такое толкование воспаления определяет необходимость изучения его в филогенезе. Этот труд взял на себя Л.И.Мечников, показавший, что основой воспалительной реакции является фагоцитоз, осуществляющийся с помощью клеточных “цитаз”, названных впоследствии лизосомами. Появляется фагоцитарная теория воспаления И.И.Мечникова (1892), наиболее аргументированная в “Сравнительной патологии воспаления” (1917). Теория Мечникова убеждает в совершенствовании механизмов воспаления по мере эволюции организмов, но она касается лишь фагоцитоза, направленного на уничтожение повреждающего агента; репаративная функция воспаления, ее эволюционное совершенствование оказались вне поля зрения исследователя. Репаративный компонент воспаления был раскрыт лишь в середине нашего столетия исследователями, показавшими роль медиации и клеточной рецепции в кинетике воспалительного процесса.
H.Dale и P.Laidow (1909) первыми открыли первый медиатор воспаления гистамин, a V.Menkin (1948) выделяет из экссудата вещество — лейкотаксин, влияющий на состояние сосудистой стенки и движение лейкоцитов в очаг воспаления. В дальнейшем среди медиаторов воспаления были выделены биогенные амины, плазменные системы, производные арахидоновой кислоты, кислородные радикалы и гидропероксидазы липидов, а также многочисленные медиаторы нейтрофилов, моноцитов, лимфоцитов и фибробластов [Серов В.В., Пауков B.C., 1995].
Эти исследования позволили дать наиболее полное, раскрывающее сущность процесса, определение воспаления.
СУЩНОСТЬИЭТИОЛОГИЯВОСПАЛЕНИЯ
• Воспаление — наиболее древняя и сложная сосудисто-мезенхимальная реакция на повреждение, направленная не только на ликвидацию повреждающего агента, но и на восстановление поврежденной ткани.
Уникальность воспаления в его многоликости. Биологическое его назначение — сохранение вида. Как категория медицинская, воспаление — это и проявление болезни, и патологический процесс, направленный на устранение повреждающего начала и репарацию, т.е. на исцеление от болезни.
Этиология воспаления многообразна. Оно может быть вызвано разнообразными эндогенными и экзогенными биологическими (вирусы, бактерии, грибы, животные-паразиты, антитела и иммунные комплексы), физическими (лучевая и электрическая энергия, высокие и низкие температуры, пыли и аэрозоли, различные травмы) и химическими (химические вещества, в том числе лекарства, токсины, яды) факторами.
Определение воспаления предусматривает тесную его связь как с иммунитетом (становление иммунитета осуществляется “посредством воспаления” — достаточно вспомнить постинфекционный иммунитет), так и с регенерацией (третья фаза воспаления — фаза репарации). Связь воспаления с иммунитетом и регенерацией хорошо объясняет ставшее аксиомой положение: иммунологический гомеостаз — это структурный гомеостаз.
ВОСПАЛЕНИЕИИММУНИТЕТ –
КИНЕТИКАВОСПАЛИТЕЛЬНОГОПРОЦЕССА
Сопряжение воспаления с иммунитетом для репарации обеспечивается участием всех систем защиты организма в уникальной реакции терминальных сосудов и соединительной ткани, которая составляет сущность воспаления.
Как известно, защиту организма определяют неспецифические факторы и иммунологическая реактивность, или иммунный ответ.
Неспецифическиефакторызащитыииммунологическая реактивность [поПетровуР.В., 1982]
| Неспецифические факторы защиты | Иммунологическая реактивность (иммунный ответ) |
| Фагоцитоз Система комплемента Интерферон Лизоцим Пропердин Гидролитические фрагменты Бактерицидные субстанции тканей Непроницаемость покровов | Антитела Гиперчувствительность немедленного типа(ГНТ) Гиперчувствительность замедленного типа(ГЗТ) Иммунологическая память Иммунологическая толерантность Идиотипы — антиидиотипы Фагоцитоз Система комплемента |
В становлении иммунитета при воспалении велика роль как фагоцитоза, так и системы комплемента. Место фагоцитоза, осуществляемого полиморфно-ядерными лейкоцитами (ПЯЛ) и моноцитарными фагоцитами (макрофаги), в системе иммунитета определяется тем, что, несмотря на неспецифичность самого акта фагоцитоза, фагоциты, особенно макрофаги, принимают участие в очищении антигенов, переработке их в иммуногенную форму, которую воспринимает Т-хелпер. Место макрофагов в
системе иммунитета определяется и участием в кооперации Т- и В-лимфоцитов, необходимой для становления иммунного ответа. Поэтому фагоцитоз дополняет формы реакций иммунологической реактивности. Система комплемента участвует в специфических реакциях, присоединяя свои компоненты к молекулам антител, что обеспечивает лизис антигенных субстанций, против которых выработаны антитела. Из этого следует, что комплемент как один из неспецифических факторов защиты принимает участие в иммунном ответе, поэтому он, как и фагоцитоз, дополняет формы иммунологической реактивности. Как видно, включение иммунного ответа при воспалении обеспечивается двумя клеточными системами неспецифической защиты: системой моноцитарных фагоцитов, а также плазменной системой — системой комплемента.
Кинетика воспалительной реакции для достижения конечной цели — элиминации повреждающего агента и репарации ткани — характеризуется сменой взаимоотношений клеточных систем защиты между собой и с системой соединительной ткани, что определяется медиаторной регуляцией. Из этого, однако, не следует, что в воспалительной реакции участвуют лишь ПЯЛ, макрофаги, лимфоциты и фибробласты. Клетки — носители вазоактивных аминов (лаброциты, базофилы, тромбоциты), как и сдерживающие их функциональную активность эозинофилы, имеют огромное значение для развития собственно сосудистой реакции воспаления. Но они непричастны к основному назначению воспалительной реакции — элиминации повреждающего начала и репарации повреждения. Как цепная, в значительной мере саморегулирующаяся, воспалительная реакция укладывается в универсальную схему: повреждение → медиация → рецепция → клеточная кооперация → клеточные трансформации → репарация (схема 16). Воспалительная реакция определяет и последовательно развивающиеся фазы: 1) повреждения, или альтерации, 2) экссудации, 3) пролиферации и дифференцировки клеток.
Схема 16. Клеточныесистемызащитыикинетика воспалительнойреакции
Повреждение (альтерация) — обязательный компонент воспаления. Это изначально то, на что возникает сосудисто-мезенхимальная реакция, составляющая сущность воспаления. Можно ли считать альтерацию фазой воспаления? Вопрос этот не решается однозначно. Одни современные патологи [Robbins S. et al., 1981] не выделяют альтерацию как таковую, подменяя ее нарушениями микроциркуляции и реологических свойств крови. А.М.Чернух в монографии “Воспаление” (1979) первой стадией воспаления называет сосудистую, выделяя в ней Две фазы. Д.С.Саркисов и В.Н.Галанкин (1988) рассматривают альтерацию как неспецифический компонент воспаления, причем не всегда обязательный (В.Н.Галанкин) для развития последующей экссудации и пролиферации. Иными словами, допускается возможность развития воспаления без повреждения, причем альтерация в такой ситуации подменяется функциональной недостаточностью полиморфно-ядерных лейкоцитов. Эта позиция, даже условно допускаемая, исключает понимание воспаления как сосудисто-мезенхимальной реакции на повреждение.
Многие патологи [Огруков А.И., 1972; Серов В.В., Пауков B.C., 1995; Cottier H., 1980] отстаивают необходимость выделения альтеративной фазы воспаления, характеризующей инициальные процессы (дистрофия, некроз) и выделение медиаторов. Вероятно, у патологоанатома есть все основания для сохранения этой фазы, имеющей конкретное морфологическое и биохимическое выражение.
■ Следует заметить, что сохранение альтеративной фазы воспалительной реакции не оправдывает выделения альтеративной формы воспаления, при которой сама сосудисто-мезенхимальная реакция на повреждение практически отсутствует. Поэтому необходимо согласиться с большинством современных патологов в том, что признание альтеративного воспаления, выделяемого классической патологией прошлого, противоречит сути воспалительной реакции в ее современном толковании.
Повреждение и медиация — неразрывные компоненты морфогенеза воспаления, поскольку медиаторы “рождаются” в самом повреждении (альтерации).
Принято выделять плазменные (циркулирующие) медиаторы, представленные прежде всего калликреин-кининовой системой, системой комплемента и системой свертывания крови, а также клеточные (локальные) медиаторы, связанные со многими клетками: лаброцитами, тромбоцитами, базофилами, ПЯЛ, макрофагами, лимфоцитами, фибробластами и др. Однако и плазменные, и клеточные медиаторы тесно взаимосвязаны и работают при воспалении как аутокаталитическая система, использующая принципы “обратной связи”, “дублирования”, “необходимого разнообразия” и “антагонизма”.
Эти принципы системы позволяют циркулирующим медиаторам обеспечить повышение сосудистой проницаемости и активацию хемотаксиса ПЯЛ для фагоцитоза, а внутрисосудистую коагуляцию в отводящих из очага воспаления сосудах — для отграничения возбудителя и самого очага воспаления (барьерная функция очага воспаления). При этом основные этапы сосудистой реакции — повышение проницаемости, активация хемотаксиса ПЯЛ и фактора Хагемана — дублируются несколькими медиаторами. Те же принципы системы в аутокаталитической реакции клеточных медиаторов обеспечивают не только повышение сосудистой проницаемости, фагоцитоз и вторичную деструкцию, но и включение иммунного ответа для элиминации повреждающего агента и продуктов повреждения и, наконец, репарацию ткани путем пролиферации и дифференцировки клеток в очаге воспаления.
Наиболее ярко принцип дублирования выражен среди клеток — носителей вазоактивных веществ — лаброцитов, базофилов, тромбоцитов, а антагонистические начала — между этими клетками и эозинофильными лейкоцитами: медиаторы лаброцитов и базофилов стимулируют хемотаксис эозинофилов, последние же способны инактивировать эти медиаторы и фагоцитировать гранулы лаброцитов (схема 17). Среди клеток, несущих медиаторы сосудистой проницаемости, возникает “антагонистическое равновесие”, определяющее своеобразие морфологии сосудистой фазы воспаления, особенно при аллергических реакциях.
Клеточные медиаторы — лейкокины, монокины (интерлейкин-1), лимфокины (интерлейкин-2) и фиброкины — являются локальными регуляторами кооперации клеток на “поле” воспаления — ПЯЛ, макрофага, лимфоцита и фибробласта [Серов ВВ., Шехтер А.Б., 1981]. Другими словами, клеточные медиаторы определяют последовательность и долю участия в воспалении фагоцитарной и иммунной систем, с одной стороны, и системы соединительной ткани — с другой.
“Дирижером” ансамбля клеточных медиаторов следует считать монокины макрофагов (схема 18). Макрофаги, поддерживаемые медиаторной ауторегуляцией, способны управлять с помощью монокинов дифференцировкой гранулоцитов и моноцитов из стволовой клетки, пролиферацией этих клеток, т.е. являются регуляторами фагоцитоза. Макрофаги не только влияют на функциональную активность Т- и В-лимфоцитов, принимают участие в их кооперации, но и секретируют 6 первых компонентов комплемента, т.е. являются посредниками привлечения иммунной системы в воспалительную реакцию. Макрофаги индуцируют рост фибробластов и синтез коллагена, т.е. являются стимуляторами завершающей фазы репаративной реакции при воспалении. Вместе с тем сами макрофаги испытывают регулярное влияние лимфокинов и фиброкинов, т.е. теснейшим образом связаны в локальной клеточной регуляции с лимфоцитом и фибробластом [Серов В.В., Шехтер А.Б., 1981; Маянский А.Н., Маянский Д.Н., 1983].
Клеточная рецепция играет огромную роль в локальной клеточной регуляции при воспалении. С нею связаны межклеточное взаимодействие и привлечение в очаг воспаления компонентов иммунных реакций, так как у всех эффекторных клеток воспаления обнаружены Fc-рецепторы иммуноглобулинов и С-рецепторы комплемента. Становятся понятными неразрывная связь и неравнозначное во времени сопряжение фагоцитарной системы, иммунной системы и системы соединительной ткани в реализации конечной цели воспалительной реакции (схема 19).
Схема 19. Межклеточноевзаимодействиепривоспалении
Варианты этого сопряжения, зависящие от особенностей как повреждающего агента, так и организма, реагирующего на повреждение, должны, вероятнее всего, определять развитие той или иной формы воспаления. Так, гнойное воспаление (вид экссудативного воспаления) отражает, вероятно, особую форму сопряжения функционально несостоятельной системы ПЯЛ с макрофагами. При этом макрофаги, усиленно фагоцитирующие распадающиеся ПЯЛ, становятся устойчивыми к возбудителю. В.Е.Пигаревский (1978), изучающий это особое взаимоотношение двух систем фагоцитоза, называет его резорбтивной клеточной резистенцией. Как видно, оно отражает вторичную несостоятельность фагоцитарной функции макрофагов при первичной несостоятельности фагоцитоза ПЯЛ.
Первичная и избирательная несостоятельность системы моноцитарных фагоцитов, разобщение ее с системой ПЯЛ лежат в основе гранулематозного воспаления (вид продуктивного воспаления). Фагоцитарная недостаточность макрофагов определяет образование из них эпителиоидных и гигантских клеток, теряющих фагоцитарные функции. Фагоцитоз подменяется отграничением, персистенцией возбудителя. Незавершенный фагоцитоз делает незавершенной и несовершенной саму воспалительную реакцию. Она становится выражением реакции гиперчувствительности замедленного типа (ГЗТ).
Очевидно также, что наследственные дефекты каждой из систем защиты, как и системы самой соединительной ткани, делают дефектной и воспалительную реакцию как по форме ее проявления и течению, так и по возможности реализации конечной цели. Достаточно вспомнить наследственную недостаточность бактерицидных систем ПЯЛ и моноцитов, наиболее ярко представленную при хронической гранулематозной болезни детей, наследственные и врожденные иммунные дефициты и фатальность развивающейся при них гнойной инфекции, врожденную несостоятельность соединительной ткани и упорство хронического воспаления. Нельзя не сказать и о наследственных дефицитах системы комплемента, особенно СЗ- и С5-компонентов ее. Эти дефициты проявляются либо рецидивирующей гнойной инфекцией, либо волчаночноподобным синдромом. При воспалении, особенно вызываемом различными агентами, появляются как циркулирующие в крови, так и локальные гетерологичные иммунные комплексы, при хроническом течении воспаления они могут быть и аутологичными. Так, при воспалении возникают иммунокомплексные реакции — наиболее частые среди реакций гиперчувствительности немедленного типа (ГНТ).
ВОСПАЛЕНИЕИГИПЕРЧУВСТВИТЕЛЬНОСТЬ –ИММУННОЕВОСПАЛЕНИЕ
Связь воспаления и иммунных реакций в сенсибилизированном организме известна давно, со времени формирования C.F.Pirquet и B.Schick (1905) самого понятия “аллергия”. Тот же C.F.Pirquet предложил выделять среди аллергических реакций немедленную (ускоренную) и замедленную (растянутую) формы. Однако лишь после работ R.Rossle (1914) и А.И.Абрикосова (1933) стала понятна гиперергическая сущность аллергического воспаления. Ими было показано, что для гиперергического воспаления характерны не только выраженная экссудация, но и дистрофические и некротические (фибриноидный некроз) изменения соединительной ткани, микротромбы в сосудах, кровоизлияния.
Потребовалось несколько десятков лет поисков и находок иммунологии и морфологии для того, чтобы показать, что немедленная и замедленная аллергия в своей основе имеет иммунопатологические реакции, а последние представлены своеобразным воспалением, которое не без оснований стали называть иммунным [ Струков А.И., 1979]. Важно отметить, что характер иммунного воспаления, т.е. морфология реакций гиперчувствительности, целиком зависит от особенностей иммунопатологического механизма (подробнее см. лекцию 17 “Реакции гиперчувствительности”).
КЛАССИФИКАЦИЯВОСПАЛЕНИЯ
Классификация воспаления учитывает характер течения процесса и морфологические формы в зависимости от преобладания экссудативной или пролиферативной фазы воспаления.
По характеру течения воспаление подразделяют на острое, подострое и хроническое.
Следует заметить, что критерии выделения подострого воспаления весьма условны. О хроническом воспалении говорят тогда, когда оказывается несостоятельной репаративная фаза. Поэтому хроническое воспаление и является основным проявлением дисрегенерации (подробнее см. лекцию 16 “Воспаление, регенерация и дисрегенерация”).
По преобладанию фазы воспаления различают экссудативное и пролиферативное (продуктивное) воспаление; каждое из них подразделяется на несколько видов.
О несостоятельности выделения альтеративной формы воспаления уже упоминалось. Не обосновано и бытующее еще деление воспаления на “банальное” и “специфическое”, так как любая форма воспаления, развивающаяся в результате воздействия того или иного повреждающего агента, может быть названа специфической. Недостаточно оправдано и выделение геморрагического вида экссудативного воспаления, критерии отличия которого от кровоизлияния практически отсутствуют.
Многие вопросы, касающиеся классификации воспаления, его взаимодействия с другими реакциями организма, биологической сущности — состоятельность защитно-приспособительной реакции, клинического значения и др., подлежат дальнейшему изучению и обсуждению.
Источник