Трансформирующий фактор роста воспаление
Иммунная Т-клетка (красная) атакуют раковую клетку
Ученые расшифровали ключевую стратегию раковых клеток, которая позволяет им перехитрить иммунную систему и повысить шансы на их выживание. Для этого раковые клетки используют смертельный “двуликий белок”, который напоминает двуликую фигуру в древнеримской мифологии.
Рак генетически запрограммирован на выживание любой ценой, даже если это означает убийство хозяина, как это слишком часто бывает, когда злокачественная опухоль становится метастатической. Главным инструментом опухоли является цитокин под названием TGF-β1 или просто TGF-β( Трансформирующий ростовой фактор бета, TGF-beta), который иммунобиологи из Швейцарии окрестили “двуликим белком”.
Название этого белка происходит от его сложной биологической роли, он может как подавлять, так и способствовать росту опухолей человека. Одна из его ключевых ролей – подавление активности Т-клеток, убивающих рак.
————————————————————————————————–
Обнаружен белок, стимулирующий рост рака и подавляющий иммунитет
О том, как вы можете дополнительно улучшить противораковую активность своего иммунитета, читайте в статье: Как повысить иммунитет с помощью NK-клеток натуральных киллеров
————————————————————————————————–
Доктор Сара Даймлоу, иммунобиолог из Университета Базеля, и группа исследователей пролили новый свет на клеточные эффекты TGF-β. Это открытие может проложить путь к новым методам лечения, которые нацелены на вредные свойства белка, не стирая его преимущества.
“Многие типы опухолей продуцируют TGF-β в больших количествах, и это связано с метастазированием и плохим прогнозом пациента”,- указала Сара Даймлоу, подчеркнув, что “опухолевая активность TGF-β включает нарушение клеточного цикла, повышенное образование внеклеточного матрикса, ангиогенез и, самое главное, ингибирование противоопухолевого Т-клеточного иммунитета.”
Как бы широко ни казалось влияние белка, сложность TGF-β еще глубже, что и обнаружили ученые. Этот белок не только подавляет противоопухолевую активность Т-клеток, но и другие противораковые возможности иммунной системы, что позволяет TGF-β в одиночку повреждать практически все грани противоопухолевого арсенала организма. Например, TGF-β подавляет активность противораковых естественных киллеров NK-клеток.
Схема, показывающая, как TGF-β опухоли блокирует иммунитет и помогает раку
Среди основных ролей TGF-β, помогающих опухолям, это активация процесса ангиогенеза, прорастания кровеносных сосудов. Новые кровеносные сосуды позволяют опухоли подключаться к кровоснабжению своего хозяина, из которого рак собирает питательные вещества для поддержки своего роста и пролиферации.
В основе своего исследования Сара Даймлоу и ее группа ученых проанализировали образцы жидкости, выделенной различными метастатическими опухолями человека. Они также отслеживали, как эти жидкости, которые в большом количестве содержат TGF-β, влияют на иммунные CD4+ Т-клетки. И они обнаружили, что секретируемый опухолью TGF-β нарушает метаболизм и митохондриальную активность CD4+ Т-клеток. TGF-β дополнительно блокировал выработку интерферона-гамма, ключевой противоопухолевой молекулы.
“Наши результаты, имеющие последствия для всего противоопухолевого иммунитета человека, предполагают, что TGF-β непосредственно воздействует на метаболизм Т-клеток, тем самым уменьшая функцию Т-клеток через метаболический паралич“, – заключила команда ученых.
Исследователи также обнаружили, что эти негативные эффекты, вызванные TGF-β, проявляются во всем разнообразии раковых опухолей. В выводах своей работы ученые предлагают разработать небольшую молекулу, которая избирательно блокирует TGF-β, генерируемый опухолью, и ее влияние на CD4+ Т-клетки.
Источник информации: https://stke.sciencemag.org
———————————————————————————————–
Дополнительная информация КОД ЖИЗНИ
Негатив. Белок TGF-b способен:
- Активировать вирус Эпштейн-Барр
- Увеличить окислительный стресс и количество свободных радикалов
- Уменьшить пользу витамина D, блокируя рецепторы к нему
- Снизить плотность костей
- Увеличить местное воспаление и фиброз тканей
- Стимулирует производство воспалительных клеток Th17 (аутоиммунные заболевания)
- Снижает возможность регенерации мышц
- Уменьшает / нарушает медленный сон
ПОЛЬЗА. Что понижает активность TGF-b
- Препараты – Гамма-и Альфа-агонисты PPAR (лекарства против метаболического синдрома и атеросклероза) (источник)
- Активация рецептора витамина D
- Солнечные лучи (в клетках кожи)
- Белок KLOTO (и)
- Куркумин(и)
- Масло семян черного тмина – у крыс (и)
- Оливковое масло первого отжима (и)
- Апигенин
- Кверцетин(и)
- Берберин
- Астрагал
- Цинк
- Силимарин (Расторопша) и т.д.
ОПАСНО. Что увеличивает активность TGF-b
- Гипоксия (низкий уровень кислорода в теле)
- Психологический стресс (через адреналин и дофамин)
- Раны и ожоги
- Гормон роста
- Сигаретный дым
- Прогестерон
- Соматостатин
- Тучные клетки (активированные) и т.д.
————————————————————————————————-
Обнаружен белок, стимулирующий рост рака и подавляющий иммунитет
Как повысить иммунитет с помощью NK-клеток натуральных киллеров
Чага способствует замедлению старения, борется с раковыми клетками и улучшает иммунитет
33 способа улучшить работу своих митохондрий и сохранить здоровье
————————————————————————————————–
Источник
Интерлейкин-13 (IL-13). Трансформирующий фактор роста (TGF)IL-13 (12 кДа) принадлежит к Th2 цитокиновому семейству и структурно родственен с IL-4, принадлежащим к семейству а-спиральных протеинов. IL-13 и IL-4 являются продуктом активированных Тп2-клеток, тучных клеток, базофилов, NK-клеток и ДК. Оба цитокина являются функционально активными по отношению к широкому ряду типов клеток, таких как макрофаги, NK, эозинофилы и тучные клетки. IL-4 и IL-13 синергично обеспечивают созревание ДК, индуцированное бактериальными продуктами или провоспалительными медиаторами (такими как TNF или CD40L). Трансформирующий фактор роста (TGF). Семейство включает три родственных цитокина с мощными иммунорегуляторными белками, которые, действуя на процесс воспаления, корректируют его как позитивно, так и негативно [462]. TGF-B регулирует ангиогенез, хемотаксис, пролиферацию фибробластов и деградацию матриксных белков (например коллаген и фибронектин). Многие типы клеток продуцируют TGF-B: макрофаги, Т- и В-лимфоциты, эритроциты и фибробласты. Важно, что TGF-B также продуцируется регуляторными Т-клетками, которые снижают модуляцию функции Тп1 и других клеток иммунной системы. TGF-B ингибирует функцию Т- и В-клеток путем снижения продукции TNF-a и IL-1 моноцитами периферической крови, и непосредственно ингибирует созревание ДК. После контакта с микробами эффекторы врожденного иммунитета продуцируют воспалительные медиаторы, регулируют костимуляторную молекулярную экспрессию на АПК, тем самым, позволяя им эффективно стимулировать Т-клетки. АПК осуществляют взаимодействие между врожденным и приобретенным иммунитетом. ДК обладают наиболее мощным потенциалом среди АПК. На периферии незрелые ДК, благодаря контакту с воспалительными стимулами, подвергаются процессу созревания, мигрируют в регионарные лимфатические узлы и индуцируют адаптивный иммунитет.
ДК примируют наивные Т-клетки, презентируя экзогенные антигены в комплексе с МНС молекулами. Дендритные клетки, культивируемые в присутствии ИММП, продуцировали более высокий уровень цитокинов TNF-a, IL-6, IL-12, INF-y и IL-1 p по сравнению с незрелыми ДК. Высокий уровень TNF-a (733 пкг/мл) определялся при добавлении в среду культивирования этого же цитокина, а также при использовании в качестве индуктора созревания ДК Иммуновак-ВП-4 и ГМДП (711 пкг/мл, 613 пкг/мл), соответственно. ДК, стимулированные Иммуновак-ВП-4, продуцировали максимальное количество IL-6 и IL-12. ГМДП также стимулировал продукцию этих цитокинов, при этом незначительно уступая активирующему влиянию Иммуновак-ВП-4. ДК, обработанные ГМДП или Иммуновак-ВП-4, продуцировали практически одинаковое количество IL-ip. ДК под воздействием всех исследованных иммуномодуляторов синтезировали приблизительно одинаковое количество INF-y ACO по стимулирующему действию уступал Иммуновак-ВП-4 и ГМДП, однако уровень цитокинов при культивировании ДК в присутствии АСО также был более высоким по сравнению с незрелыми ДК. Уровень IL-12, продуцируемого ДК, при культивировании их с Иммуновак-ВП-4 был в 142 раза выше, ГМДП — в 50 раз, АСО — в 21,2 раза, а TNF-a — в 30,4 раза выше по сравнению с незрелыми ДК. – Также рекомендуем “Уровни цитокинов дендритных клеток при активации. Продукция цитокинов дендритными клетками (ДК)” Оглавление темы “Противоопухолевый иммунитет”:
|
Источник
Содержание | Следующая статья | Предыдущая статья
А.В. Чуров, Е.К. Олейник, В.М. Олейник
Трансформирующий фактор роста β (TGFβ) является многофункциональным иммунорегуляторным цитокином. Его противовоспалительная активность играет важную роль в иммунной супрессии при опухолевом росте. В обзоре представлены сведения об участии TGFβ в регуляции дифференцировки и функционирования CD4+ регуляторных T-клеток, которые ингибируют функции эффекторов противоопухолевого иммунного ответа и способствуют формированию толерантности к опухолеассоциированным антигенам. (Цитокины и воспаление. 2009. Т. 8, № 3. С. 11-15.)
Ключевые слова: TGFβ, иммуносупрессия, регуляторная Т-клетка, Foxp3.
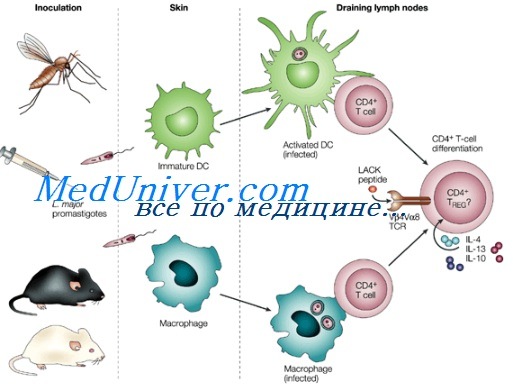
По современным представлениям в онкогенезе могут возникать иммунные дисфункции, индуцированные опухолью, которые препятствуют развитию эффективного иммунного ответа к опухолеассоциированным антигенам и способствуют формированию иммуносупрессии [46, 58]. Одним из механизмов иммуносупрессии в онкогенезе является противовоспалительная активность трансформирующего фактора роста β (TGFβ) [13, 21]. Функция TGFβ в иммунной системе связана с активностью регуляторных CD4+ Т-лимфоцитов (TReg). TGFβ оказывает стимулирующее воздействие на дифференцировку TReg-клеток на периферии, является эффекторным цитокином этих клеток и обусловливает их супрессорные свойства [43, 52]. В настоящее время TReg-лимфоциты рассматриваются в качестве основных индукторов иммуносупрессии в онкогенезе. Предполагается, что TReg-клетки ингибируют функции иммуноцитов, участвующих в противоопухолевом иммунном ответе, и обеспечивают развитие толерантности к опухолевым антигенам [23, 59]. В обзоре обобщены сведения о функциональной взаимосвязи TGFβ и TReg-клеток в регуляции противоопухолевого иммунитета и основных механизмах индукции Т-регуляторной активности с участием TGFβ.
Общая характеристика TGFβ и его функций
Рассматриваемый цитокин существует в 3-х изоформах: TGFβ1, TGFβ2 и TGFβ3. В иммунной системе наиболее распространен TGFβ1 (далее TGFβ) [29, 52]. Продуцентами TGFβ являются гранулоциты, все виды лимфоцитов, а также макрофаги и дендритные клетки. Фактор секретируется клетками преимущественно в неактивной форме, получившей название латентный TGFβ [29]. Свое биологическое действие TGFβ оказывает при связывании с рецепторами на мембране клетки. Идентифицировано два типа сигнальных рецепторов к TGFβ: TGFβRI и TGFβRII. При передаче сигнала активная форма TGFβ связывается с TGFβRII, что приводит к формированию гетеромерного комплекса TGFβRII/TGFβRI. В цитоплазме комплекс TGFβRII/TGFβRI взаимодействует с белками семейства Smad, которые обеспечивают передачу сигнала в ядро [29, 52].
TGFβ является плейотропным иммунорегуляторным цитокином. На его активность оказывают влияние такие факторы, как стадия дифференцировки и тип клеток-мишеней, а также определенные цитокины и костимуляторные мембранные молекулы. Известно, что TGFβ регулирует функции В-лимфоцитов, NK-клеток, дендритных клеток (ДК), макрофагов, тучных клеток и гранулоцитов, но наибольшее влияние оказывает на Т-клетки [29, 52]. Этот цитокин обладает антипролиферативным действием на Т-клетки: блокирует секрецию IL-2 Т-лимфоцитами, усиливает активность ингибиторов клеточного цикла (p15, p21, p27) и снижает экспрессию гена c-myc, контролирующего нормальную пролиферацию клеток. TGFβ регулирует также процессы дифференцировки Т-клеток, препятствует развитию цитотоксических CD8+-лимфоцитов, Т-хелперов 1 и 2 [29]. В последние годы было показано, что TGFβ стимулирует дифференцировку популяции Т-хелперов 17, которые характеризуются секрецией провоспалительного цитокина IL-17. По-видимому, эту роль TGFβ выполняет совместно с IL-6. Функция Т-хелперов 17 в настоящее время изучается. Предполагают, что эти клетки участвуют в санации организма от патогенов, которые не являются мишенями для T-хелперов 1 и 2 [12, 44]*[T1] . Таким образом, TGFβ обладает широким спектром биологического действия, оказывает супрессорное влияние на клетки иммунной системы, подавляет развитие процессов воспаления.
TGFβ как стимулятор дифференцировки CD4+ TReg-клеток в онкогенезе
При опухолевом росте происходит увеличение численности CD4+ TReg-клеток в периферической крови, среди инфильтрирующих опухоль лимфоцитов, а также в регионарных лимфатических узлах [22, 30, 31, 33, 36]. Аккумуляция TReg-клеток в организме коррелирует с развитием супрессии опухолеспецифичного иммунного ответа [5].
Механизмы, ведущие к увеличению содержания TReg-клеток при опухолевом росте, мало изучены. В то же время установлено, что с развитием различных типов опухолей ассоциирована повышенная продукция TGFβ [3, 28]. Было показано, что TGFβ, секретируемый клетками опухоли, может стимулировать образование CD4+ TReg-клеток в результате конверсии наивных CD4+CD25–-лимфоцитов [32].
Способность TGFβ стимулировать Т-регуляторную активность установлена в ряде исследований [38, 49, 55]. TGFβ может индуцировать дифференцировку CD4+ TReg-клеток при активации наивных (CD4+CD45RA+) клеток периферической крови. Фенотип TReg-лимфоцитов, которые образуются в присутствии TGFβ, характеризуется экспрессией CD25, CTLA-4, CD122, GITR, CD103 и транскрипционного фактора FoxP3 (forkhead box P3). Такие TReg-клетки способны активно пролиферировать в ответ на стимуляцию аллоантигенами и в присутствии IL-2, секретируют цитокины – ингибиторы (TGFβ, IL-10), а также проявляют иммуносупрессорную активность в отношении цитотоксических Т-лимфоцитов (ЦТЛ) [38, 49].
TReg-клетки, дифференцирующиеся в результате конверсии CD4+CD25–-предшественников, в значительном объеме секретируют TGFβ в функционально активной форме. Количество TGFβ, секретируемого этими клетками, существенно увеличивается в присутствии IL-2, а использование моноклональных антител к TGFβ оказывает ингибирующее действие на их супрессорную активность [55]. В процессе дифференцировки TReg-клеток TGFβ защищает их от апоптоза [49, 55], что согласуется с данными о способности цитокина снижать экспрессию FasL Т-клетками [16], а также усиливать экспрессию антиапоптотического фактора BCL-XL [8]. Для конверсии CD4+CD25– Т-клеток в присутствии TGFβ необходима стимуляция через Т-клеточный рецептор [7, 38, 55]. Возможно, это связано с тем, что наивные CD4+CD25– Т-клетки характеризуются низкой экспрессией TGFβRII, значительно возрастающей после стимуляции через Т-клеточный рецептор [9].
В процессе развития TReg-лимфоцитов важную роль играет транскрипционный фактор FoxP3. В настоящее время FoxP3 считается одним из наиболее специфических маркеров TReg-клеток. Увеличение численности FoxP3+ TReg-клеток ассоциировано с неблагоприятным прогнозом при опухолевом росте [5, 48]. Было показано, что TGFβ может индуцировать экспрессию FoxP3 CD4+CD25–-лимфоцитами мыши с образованием TReg-клеток, которые проявляют супрессорную активность [7, 15]. Подобным образом TGFβ индуцирует экспрессию FoxP3 и в лимфоцитах человека [15]. Способность TGFβ стимулировать дифференцировку FoxP3+ TReg-клеток, по-видимому, связана с кооперативным действием IL-2. Терапия некоторых видов опухолей с использованием IL-2 способствует значительному увеличению численности клеток с фенотипом CD4+CD25+FoxP3+ в периферической крови [1, 45]. У мышей IL-2, вместе с TGFβ, необходим для стимуляции дифференцировки CD25+FoxP3+ TReg-клеток из наивных CD4+CD25– лимфоцитов. Действуя совместно, IL-2 и TGFβ способствуют индукции фенотипа, ассоциированного с TReg-клетками, усиливают экспрессию FoxP3 и мембранных маркеров CD25, CTLA-4, GITR [56].
Динамика экспрессии другого маркера TReg-клеток – CTLA-4 также связана с супрессорной активностью TGFβ. Известно, что CTLA-4 конститутивно экспрессируется у CD4+CD25+ Т-лимфоцитов [9]. По мнению Zheng S.G. et al. CTLA-4 участвует в процессах дифференцировки адаптивных TReg-клеток. Авторы полагают, что TGFβ усиливает экспрессию CTLA-4 у CD4+CD25–-клеток, а коэкспрессия TGFβ и CTLA-4, в свою очередь, является необходимым условием для индукции FoxP3 и формирования TReg-клеток с фенотипом CD4+CD25+FoxP3+ [57]. CTLA-4, вероятно, имеет большое значение для функционирования TReg-клеток, поскольку стимуляция через CTLA-4 приводит к усилению продукции TGFβ TReg-клетками [35], а также индуцирует увеличение экспрессии мембраносвязанного TGFβ и TβRII у CD4+CD25+ TReg-лимфоцитов [9].
Конверсия CD4+CD25–-лимфоцитов, видимо, не является единственным механизмом активации TReg с участием TGFβ. По всей вероятности, TGFβ может стимулировать пролиферацию TReg-клеток опосредованно, в результате функционирования незрелых ДК. В онкогенезе опухолевые клетки секретируют различные иммуносупрессорные факторы (TGFβ, IL-10, VEGF и др.), которые ингибируют дифференцировку ДК и приводят к нарушению их созревания [4, 50, 58]. Незрелые ДК характеризуются низкой экспрессией молекул-костимуляторов (CD80, CD86) и антигенов MHC II, а также секретируют TGFβ в биологически активной форме [10, 18, 37]. Ghiringhelli F. et al. [17] предполагают, что в процессе опухолевого роста TGFβ+-ДК аккумулируются в регионарных лимфоузлах, где избирательно стимулируют пролиферацию клеток с фенотипом CD4+CD25+FoxP3+. При этом, механизм индукции пролиферации TReg-клеток связан с межмолекулярными взаимодействиями между TGFβ и TGFβRII [18]. TReg-лимфоциты характеризуются высокой конститутивной экспрессией сигнального рецептора TGFβRII [9] с чем, вероятно, и связано селективное воздействие TGFβ на пролиферацию этих клеток.
TGFβ – медиатор супрессорной активности CD4+ TReg-клеток в онкогенезе
TReg-клетки играют важную роль в супрессии иммунного ответа к опухолеассоциированным антигенам [59]. Уменьшение численности TReg-клеток, а также снижение их функциональной активности (например, в результате применения моноклональных антител к CD25 или CTLA-4) может приводить к индукции эффективного противоопухолевого иммунитета [5].
Содержание | Следующая статья | Предыдущая статья
Источник
