Тучные клетки при воспалении
Тучные клетки и гистамин. Роль гистамина в воспалении бронхов.Тучные клетки бывают разных видов и от этого зависят морфологические изменения, сопровождающие их дегрануляцию: если в коже тучные клетки выделяют интактные гранулы, которые могут быть фагоцитированы фибробластами, то в легких гранулы тучных клеток растворяются внутриклеточно, и часть мембран гранул вместе с клеточной мембраной формируют каналы, через которые содержимое гранул выделяется наружу. Специфические морфологические, биохимические и функциональные черты тучных клеток диктуются специфическим микроокружением: так, тучные клетки кожи после стимуляции морфином in vitro выделяют медиаторы воспаления, а тучные клетки легких, сердца и желудочно-кишечного тракта – нет. Конечно, гетерогенность тучных клеток выходит далеко за рамки ответа на опиаты. Кроме антигензависимой дегрануляции тучных клеток, связанной с реакцией ГНТ, существует большое количество либераторов гистамина (токсины, ферменты, лекарства, различные макромолекулы и др.), вызывающих дегрануляцию тучных клеток неиммунологическим путем. Гистамин считается своеобразным маркером тучной клетки, но последняя выделяет большое количество медиаторов, среди которых лейкотриены С4, Д4, Е4, простагландин Д гепарин, триптаза, причем не исключается, что гистамин и другие цитокины играют роль в генезе хронического воспаления при БА, выделяясь в небольшом количестве даже в фазе ремиссии. Имеются данные об активации тучноклеточной триптазой латентной коллагеназы, что, в итоге, приводит к повреждению соединительной ткани легких. Не исключено, что различные стимуляторы выделения БАВ, воздействуя на тучные клетки, могут избирательно потенцировать выделение или синтез de novo тех или иных медиаторов: так, местное воздействие на слизистую бронхов аденозинмонофосфата достоверно повышает выделение тучными клетками вторичного медиатора-простагландина Д2, но не первичных медиаторов (гистамина и триптазы).
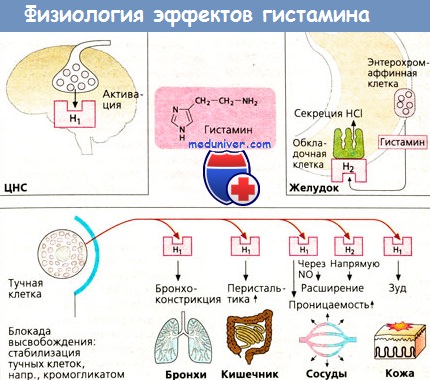
Выделены разные группы больных атопической БА с одинаково повышенным уровнем гистамина и достоверно отличавшихся по уровню гистаминазы; причем эти группы больных отличались также по клинической картине болезни; больные с более высокой активностью гистаминазы были старше, имели более длительный анамнез заболевания и более тяжелое его течение. Участие гистамина в патологических процессах в легких, как органе-мишени, не всегда сопровождается повышением уровня гистамина в крови. Показано, что в ряде случаев уровень гистамина крови после провокации аллергеном был тем меньше, чем большей была гиперреактивность бронхов. Найдено повышение содержания гистамина в конденсате влаги выдыхаемого воздуха и в мокроте больных БА и хроническим бронхитом. В.А. Гончарова и соавт. считают, что из целого ряда БАВ, выявленных в конденсате влаги выдыхаемого воздуха (серотонин, гистамин, ацетилхолин, катехоламины), у больных БА наиболее информативно повышение уровня гистамина. У больных БА с хроническим бронхитом в ряде случаев продуцентами гистамина могут быть содержащиеся в бронхиальном дереве различные бактерии, а не тучные клетки. Вместе с тем, выделяющийся в легких свободный гистамин ответственен за начало ранней стадии воспаления. У больных БА гистамин не является, возможно, главным медиатором, но все же принимает участие в развитии отека слизистой и бронхоспазма. У некоторых больных гистамин реализует свое действие не только прямым влиянием на бронхи, но также путем усиления генерации фагоцитами активных форм кислорода. Активация тучных клеток может зависеть от тяжести течения БА. Rankin J. et al. не нашли повышения уровня гистамина в содержимом бронхоальвеолярного лаважа у больных легкой БА, в отличие от больных тяжелой БА. Гистамин повышает капиллярную проницаемость, повреждает капиллярную стенку и усиливает деполимеризацию основного вещества соединительной ткани. Получены данные о повышении гистамином посткапиллярного сопротивления на фоне относительно постоянного значения сопротивления артериальной части сосудистого русла, что приводит к росту капиллярного гидростатического давления и усилению процессов фильтрации в легочный интерстиций. Действуя на Н1-рецепторы бронхов гистамин вызывает бронхоконстрикцию, а действие гистамина на Н1-рецепторы сосудов малого круга вызывает их сужение. Повышение давления в системе легочной артерии под влиянием гистамина связано с увеличением проницаемости гладкомышечных клеток для внеклеточного кальция и мобилизации внутриклеточного кальция. Возможно, легочная гипертензия, возникающая при гипоксической гипоксии, опосредуется тучными клетками, выделяющими гистамин. Гистамин модулирует активность многих клеток, принимающих участие в иммунном воспалении, и оказывает влияние на клеточные иммунные реакции. Через Н1-рецепторы реализуется провоспалительный эффект гистамина, а все ингибирующие эффекты гистамина на функцию лимфоцитов и противовоспалительное действие реализуются через Н2-рецепторы, и не исключается, что одновременная стимуляция Н1 и Н2-рецепторов на иммунокомпетентных клетках приводит к развитию супрессорной активности, а дефект Н2-рецепторов при аллергических заболеваниях может иметь генерализованный характер и приводить к повышению функциональной активности Н1-рецепторов, усилению воспалительных реакций и увеличению выхода гистамина из тучных клеток. Высказывается предположение, что в ряде случаев для больных БА повышенный уровень гистамина может иметь положительное значение: благодаря существованию двух функционально противоположных типов гистаминовых рецепторов гистамин через отрицательную обратную связь играет роль ограничителя аллергического воспаления, а патологические изменения, вызванные гистамином, возникают лишь при нарушении гомеостатического механизма регуляции через систему Н1 и Н2-рецепторов, т.е. при сдвиге механизмов контроля. Считается, что у больных аллергическими болезнями, в том числе при БА, гистамининдуцированная супрессия иммунного ответа нарушается из-за уменьшения Н2-позитивных Т-лимфоцитов, вырабатывающих HSF (гистамин-индуцированный фактор супрессии). Несмотря на многообразие действия гистамина и его роль “маркера” тучных клеток, не всегда просто выяснить его значение в патогенезе легочных заболеваний, поскольку в организме гистамин высвобождается при любой травме и находится также вне тучных клеток, являясь постоянной составной частью почти всех органов, тканей, жидких сред и выделений. Помимо тучных клеток, существенную роль в выделении гистамина могут играть базофилы, различающиеся по своей плотности и наличию в них гистамина: несмотря на небольшое содержание в крови, базофилы могут становиться многочисленными в зоне воспаления и играть важную роль в поздней фазе аллергических реакций, а также получены данные о повышенном выходе гистамина из базофилов под действием ФАТ. Существенная роль в генезе различных видов воспаления взаимодействия “тучная клетка – эозинофил” дополняется не менее важной осью “тучная клетка – нейтрофил”: медиаторы тучных клеток влияют на выделение нейтрофилами свободных радикалов кислорода, а активированные нейтрофилы стимулируют выделение гистамина из тучных клеток. Сейчас считается, что тучные клетки играют центральную роль в возникновении бронхообструкции в течение ранней астматической реакции, выделяя гистамин, простагландин Д2, цистеиновые ЛТ, ферменты (триптаза, протеаза), не только вызывающие спазм гладкой мускулатуры бронхов, но также влияющие на сосудистую проницаемость, усиливающие деятельность железистого аппарата бронхов, и разрыхляющие соединительнотканный матрикс. Привлечение различными тучноклеточными медиаторами, такими как ИЛ-3, ИЛ-4, ИЛ-5, нейтрофильный хемотаксический фактор, ФАТ, гранулоцитарно-макрофагальный колониестимулирующий фактор других клеток воспаления, приводит к развитию персистирующей воспалительной реакции в бронхах больных БА, что типично для хронического течения этой болезни, а активация протеазами тучных клеток разных коллагеназ приводит к нарушениям соединительной ткани и способствует не только хронизации воспаления, но и формированию необратимых морфологических изменений. – Также рекомендуем “Эйкозаноиды. Воспаление бронхов и выделение эйкозаноидов.” Оглавление темы “Воспаление бронхов.”: |
Источник
Тучные клетки и базофилы при воспалении легких.Несмотря на то, что вопросы происхождения тучных клеток и базофилов у экспериментальных животных достаточно изучены, происхождение этих клеток у человека остается не вполне ясным. Если у животных установлено, что процессы дифференцировки стволовой клетки в базофилы происходят под влиянием IL-3,4,9,10, a IL-3 является фактором роста для тучных клеток, то зрелые тучные клетки легких не экспрессируют рецепторы для 1L-3, и нет данных о влиянии IL-3 на тучные клетки человека. Однако получены строгие доказательства участия IL-3 в созревании и росте базофилов человека (так же как и эозинофилов). GM-CSF и IL-5 могут замещать IL-3, но их эффекты реализуются через рецептор для IL-3. С другой стороны, лейкоцитарный интерферон способен угнетать IL-3-зависимую дифференцировку базофилов. Процессы дифференцировки тучных клеток и базофилов тесно связаны с экспрессией FceRI и развитием гранул, содержащих гистамин. Возможно, в этом процессе принимает участие IL-9. Тучные клетки имеют различную форму. Клеточная мембрана образует множество складок и выступов. Цитоплазма содержит множество гранул, митохондрии и эндопламатический ретикулум, но мало рибосом и неразвитый аппарат Гольджи. В дополнение ко многочисленным гранулам тучные клетки легких человека содержат различное количество жировых телец. Активация тучных клеток приводит к образованию каналов, по которым содержимое гранул выбрасывается наружу. Базофил периферической крови имеет типично круглую форму с многочисленными гранулами. По сравнению с тучными клетками базофилы содержат меньшее количество гранул, но они более крупные и не содержат некоторых веществ, характерных для тучных клеток. Связывание IgE с базофилом приводит к его активации, движению гранул к мембране клетки и последующей дегрануляции. В отличие от тучных клеток нет данных о формировании в базофилах каналов дегрануляции.
Поверхностные маркеры н рецепторы. Тучные клетки и базофилы экспрессируют большой спектр поверхностных антигенов и рецепторов. Оба типа клеток имеют как общие, так и индивидуальные маркеры. Большинство из них присутствует на клетках, находящихся в состоянии покоя, однако часть антигенов и рецепторов появляется на клетках обоих типов лишь при их активации. В отличие от других Fc-рецепторов FceRI с высокой аффинностью связывают свободные IgE на тучных клетках и базофилах. Но активирует клетки не мономерная форма IgE-антител, а только их аггрегаты, образовавшиеся в результате “сшивки” при взаимодействии с поливалентным антигеном. Сигнал активации от этих рецепторов заставляет тучные клетки и базофилы секретировать содержимое гранул и запускать местный воспалительный ответ. Мгновенно происходит дегрануляция этих клеток с выбросом гистамина и серотонина, которые вызывают местное усиление кровотока и повышение проницаемости сосудов с быстрым накоплением жидкости в окружающих тканях и притоком гранулоцитов из кровяного русла. Такой быстрый воспалительный ответ может быть защитным, так как способствует быстрой мобилизации фагоцитов и антител в очаг инфекции. Однако известно, что аналогичные реакции лежат в основе патогенеза аллергии анафилактического типа. Гистамин и серотонин -короткоживущие молекулы, их действие кратковременно. Но местное воспаление далее поддерживается последующей продукцией теми же клетками других молекул, в том числе лейкотриенов – вазоактивных метаболитов арахидоновой кислоты. На сигнал активации тучные клетки отвечают также синтезом и секрецией ряда цитокинов: IL-4, TNF-a, которые вносят существенный вклад в поддержание местной воспалительной реакции. Основные растворимые факторы и медиаторы, продуцируемые тучными клетками и базофилами, представлены в таблице. В воздухоносных путях тучные клетки выполняют защитные функции. Они способствуют рекрутированию гранулоцитов и других воспалительных клеток-эффекторов к местам внедрения инфекционных агентов, к местам депозиции антигенов, усиливают ток лимфы в региональные лимфоузлы от места внедрения антигена. Медиаторы, секретируемые тучными клетками, вызывают спазм гладкой мускулатуры бронхов, усиление секреции слизи, что способствует более эффективному удалению массы возбудителей при кашле. Активация тучных клеток и базофилов играет одну из ключевых ролей в патогенезе многих заболеваний, например бронхиальной астмы. Ранее уже были рассмотрены мембранные маркеры активации этих клеток. Ниже перечислены факторы, приводящие к активации базофилов и тучных клеток. – Также рекомендуем “Аллергические заболевания, легочный фиброз, опухоли. Макрофаги.” Оглавление темы “Клетки крови и воспаление легких.”: |
Источник
Тучные клетки (син.: гепариноциты, лаброциты, мастоциты, тканевые базофилы) — одна из основных клеточных форм соединительной ткани; характеризуются наличием в цитоплазме обильной метахроматической зернистости и способностью вырабатывать, хранить и выделять биологически активные вещества (гепарин, гистамин и др.).
Тучные клетки и их гранулы впервые описаны в 1877 г. П. Эрлихом; в 1902 — 1906 гг. А. А. Максимов подробно исследовал Тучные клетки у различных животных. В наст. время Тучные клетки выявлены у многих позвоночных животных, в т. ч. у всех млекопитающих. Тучные клетки описаны в большинстве органов, однако наиболее часто они локализуются в рыхлой волокнистой соединительной ткани около мелких сосудов, под эпителием и вблизи желез кожи, слизистых и серозных оболочек, в капсуле и трабекулах паренхиматозных органов, в лимфоидных органах, перитонеальной жидкости.

Рис. 1. Схематическое изображение тучных клеток в рыхлой неоформленной соединительной ткани: 1 — фибробласт; 2 — эозинофильные лейкоциты; 3 — макрофаги: 4 —тучные клетки.

Рис. 2. Электронограмма тучной клетки. 1 — ядро; 2 — цитоплазма; 3 — незрелые гранулы с зернистой структурой; 4 — зрелые гранулы; 5 — отростки цитоплазматической мембраны; х 25 000.
Количество, распределение и структура Тучных клеток имеют видовые, индивидуальные и возрастные особенности. Размеры Т. к. у человека варьируют от 3,5 до 14 мкм, они бывают веретенообразной или округлой формы (рис. 1). Цитоплазматическая мембрана (плазмолемма) образует складки и микроворсинки. Ядро обычно округлое или овальное. В цитоплазме (см.) расположены мембранные и немембранные органеллы. К мембранным органе л лам относятся эндоплазматическая сеть (см. Эндоплазматический ретикулум), комплекс Гольджи (см. Гольджи комплекс), митохондрии и лизосомы; к немембранным — рибосомы, центриоли, макротрубочки и микрофиламенты. Большая часть цитоплазмы занята гранулами, количество, размеры, структура, хим. состав и тинкториальные свойства к-рых имеют видовые особенности и зависят от степени их зрелости и функционального состояния клетки. Диаметр гранул варьирует от 0,3 до 2 мкм. Основу их составляет комплекс гепарина (см.) и основных белков, к к-рому присоединен гистамин (см.), а у ряда животных серотонин (см.) и дофамин (см. Катехоламины). В Т. к. при участии ферментов арилсульфатазы, сульфат-аденилил-трансферазы синтезируется гепарин — сульфатированный гликозаминогликан. Слабо сульфатированный гепарин локализуется в молодых клетках и обусловливает ортохроматическую окраску гранул; сильно сульфатированный гепарин находят в зрелых клетках, он обусловливает их мета хроматическую окраску (см. Метахромазия). В гранулах могут содержаться и другие гликозаминогликаны — хондроитинсульфаты (см. Хондроитинсерные кислоты), гиалуроновые кислоты (см.), а также гликопротеиды (см.). Кроме основных белков, в Т. к. представлены протеолитические ферменты (химаза и триптаза), а также оксид азы (см.), декарбоксилазы (см.), фосфатазы (см.) и другие. Т. к. могут синтезировать гистамин при участии фермента гистидиндекарбоксилазы, а также поглощают его извне. Гранулы могут иметь фибриллярную, пластинчатую, сетчато-зернистую и кристаллоидную структуру. В формировании гранул Т. к., в частности синтезе белков, участвует эндоплазматическая сеть, а также комплекс Гольджи (см. Гольджи комплекс), где образуются гликозаминогликаны и их комплексы с белками. Вначале в области комплекса Гольджи появляются небольшие (около 70 нм), окруженные мембраной плотные програнулы, к-рые объединяются в вакуоли с общей мембраной. Затем расположенные внутри мембраны програнулы сливаются, образуя рыхлую структуру. В процессе созревания гранулы происходит уплотнение ее содержимого, что определяет полиморфизм структуры гранул в зависимости от степени их зрелости. Зрелые гранулы отличаются от незрелых большей электронной плотностью и гомогенностью (рис. 2).

Рис. 3. Электронограмма тучной клетки в очаге асептического воспаления: 1 — гранула в межклеточном пространстве; 2 — отростки цитоплазмы тучной клетки; 3 — гранулы в цитоплазме; X 50 000.
Одним из способов секреции (выделения) биологически активных веществ Т. к. является дегрануляция (рис. 3), к-рая происходит путем экзоцитоза, являющегося переходной формой к апокриновому типу секреции (см. Железы). Секреция может быть также мерокриновой, т. е. вещества могут выделяться без дегрануляции, и реже голокриновой, сопровождающейся разрушением Т. к. Усиленная дегрануляция является показателем повышенной функциональной активности Т. к. и наблюдается при действии многих физических, химических и биологических факторов. Обычно дегрануляция сопровождается процессом восстановления гранул.
Происхождение Тучных клеток окончательно не установлено. Предполагают, что они развиваются из лимфоцитоподобного костномозгового предшественника. Популяция Т. к. обновляется медленно. Т. к. имеют низкую пролиферативную активность. В полностью гранулированных Т. к. митозы (см. Митоз) встречаются редко, чаще — в менее гранулированных клетках. Способность Т. к. к пролиферации связана с их секреторной активностью. Существует обратная зависимость между количеством Т. к. и базофилов в крови: так, у крыс, мышей при высоком содержании Т. к. базофилы в крови отсутствуют, у морских свинок, кроликов, птиц при малом содержании Т. к. в крови отмечается большое количество базофилов. Т. к. отличаются от базофилов крови происхождением, строением и функцией. Количество, структура и функциональная активность Т. к. зависят от возраста и нейрогормонального статуса организма. Отмечено влияние на Т. к. гормонов гипофиза (соматотропного, тиреотропного и адренокортикотропного), щитовидной железы (тироксина), поджелудочной железы (инсулина), половых гормонов (эстрогенов, прогестерона, тестостерона).
Функции Т. к. многообразны. Они участвуют в развитии воспаления, регуляции свертывания крови, жировом обмене, обеспечивают постоянство состава соединительной ткани, влияя на микроциркуляторное русло (см. Микроциркуляция), образование и проницаемость основного вещества, на размножение, миграцию и функцию фибробластов (см. Соединительная ткань), макрофагов (см.), эндотелиоцитов (см. Эндотелий), лейкоцитов (см.), а также на иммунные реакции.
Роль тучных клеток в аллергии
Тучные клетки, так же как и базофилы, являются основными клетками-мишенями аллергической реакции. Они вовлекаются в аллергическую реакцию посредством соединения фиксированных на клеточной мембране аллергических антител (реагинов), преимущественно принадлежащих к IgE (см. Иммуноглобулины), с аллергеном. Это приводит, по мнению И. С. Гущина, Б. Увнеса, Джонсона (A. R. Johnson) и Морана (N. С. Moran), к активации Т. к. и высвобождению из них разнообразных биологически активных веществ, к-рые, действуя на другие клетки и ткани, вызывают внешние проявления реакции гиперчувствительности немедленного типа, или химергической аллергической реакции (см. Медиаторы аллергических реакций). Таким образом, реакция Т. к. является обязательным и важнейшим звеном аллергических реакций, лежащих в основе анафилаксии (см.), неинфекционно-аллергической бронхиальной астмы (см.), аллергических ринитов (см. Ринит), конъюнктивитов (см.), отека Квинке (см. Квинке отек), крапивницы (см.) и других проявлений атопии (см.).
Имеются сведения, что Т. к. могут принимать участие и в реакциях гиперчувствительности замедленного типа, благодаря способности антигенспецифических Т-лимфоцитов при взаимодействии с антигеном выделять лимфокины (см. Медиаторы клеточного иммунитета), вызывающие в свою очередь активацию Т. к. и высвобождение из них медиаторов и других биологически активных веществ.
Избирательная фиксация IgE-антител на Тучных клетках объясняется присутствием в их цитоплазматической мембране специфических для IgE рецепторов (ок. 300 000 рецепторов на одну Т. к.). За связывание IgE с рецепторами ответственны участки в области С84-домена молекулы IgE. Рецептором для IgE является гликопротеид с мол. весом (массой) порядка 50 000. Для активации Т. к. необходимо соединение между собой соседних, расположенных на мембране Т. к., молекул IgE-антител молекулой антигена, к-рая должна иметь для этого не менее двух валентностей. Моновалентные антигены не активируют Т. к., но тормозят активацию, вызванную мульти-валентными антигенами. Связывание антигенными мостиками IgE-антител приводит к сближению последних на клеточной мембране и, соответственно, к сближению мембранных рецепторов IgE-антител, что является толчком к активации Т. к. Не исключено, что активация Т. к. осуществляется путем взаимодействия участков С83-домена, открывающихся в структурно измененной молекуле IgE-антитела, с участками клеточной мембраны, отличными от рецепторов для IgE.
По данным, полученным с помощью фазово-контрастной микроскопии, реакция сенсибилизированных Т. к. на антиген морфологически проявляется в увеличении их размера, «вскипании» клетки, к-рое сопровождается утратой цитоплазматических гранул в результате дегрануляции или гранулолизиса, потерей четкости очертаний клетки, что может быть принято за ее разрушение. Об отсутствии разрушения Т. к. при аллергической реакции свидетельствует то, что при дегрануляции из них не высвобождаются АТФ, лактат-дегидрогеназа и предварительно введенные в клетки радиоактивные калий (42K) или хром (51Cr), как это происходит при заведомо цитотоксических воздействиях.
Начальный этап аллергической реакции Т. к. состоит в активации фосфодиэстеразы при участии ионов Ca2+, поступающих в клетку из внеклеточной среды или находящихся внутри клетки и высвобождающихся из связанного состояния, далее происходит аутокаталитическая активация эстеразы, по-видимому, за счет разрушения этим ферментом ингибирующего белка. После активации наступает энергозависимая стадия реакции. Ионы Ca2+ активируют сократительные белки, что приводит к сближению и слиянию перигранулярных и цитоплазматической мембран, перемещению гранул и выходу их за пределы клетки (экзоцитозу). Сначала увеличиваются пространства между гранулами и пернгранулярными мембранами, затем перигранулярные мембраны сливаются друг с другом и с общей цитоплазматической мембраной. образуя вакуоли. Зоны слияния мембран в этих участках истончаются, в результате чего образуются участки повышенной проницаемости мембраны, или расплавляются, формируя видимые пути сообщения (поры), через к-рые гранулы выходят во внеклеточное пространство. Под воздействием низкой температуры. ингибиторов клеточного дыхания (см. Окисление биологическое) и гликолиза (см.), а также при отсутствии ионов Ca2+, высвобождение медиаторов блокируется. В последнее время сделана попытка терапевтического применения циннаризина (см.), оказывающего избирательное действие на трансмембранный перенос ионов Ca2+ в тучных клетках.
За счет образования видимых сообщений и зон повышенной проницаемости цитоплазматической мембраны содержащиеся во внеклеточной среде ионы Na+ усиленно поступают в вакуоли и вытесняют биогенные амины (см. Медиаторы аллергических реакций), соединенные ионной связью с белками гранулярного матрикса.
Наряду с высвобождением из Т. к. гистамина, серотонина, эозинофильного хемотаксического фактора — ECF-A (англ. eosinophilic chemotactic factor of anaphylaxis), нейтрофильного хемотаксического фактора — NCF (англ. neutrophil chemotactic factor), содержащихся в гранулах Т. к. в предсуществующей (предобразованной) форме, происходит активация ферментов и образуются такие медиаторы, как медленно реагирующая субстанция анафилаксии SRS-A (англ. slow-reacting substance of anaphylaxis), фактор, активирующий тромбоциты — PAP (англ. platelet activating’ factor), и липидные хемотаксичоские факторы.
Из фосфолипидов клеточной мембраны активированных Тучных клеток высвобождается арахидоновая кислота (см.). В результате окислительного превращения арахидоновой к-ты, катализируемого циклооксигеназой (циклооксигеназный путь), образуются простагландины и тромбоксаны (см. Простагландины). Окислительное превращение арахидоновой к-ты, катализируемое липокспгеназой (липоксигеназныи путь), приводит к образованию гидроксиэйкозатетраеновых к-т, обладающих гуморальной и клеточной активностью: они оказывают хемотаксическое действие на эозииофилы, усиливают сродство клеточных мембранных рецепторов к СЗЬ компоненту комплемента (см.), стимулируют активность аденилат- и гуанилатциклаз. Кроме того, в результате окислительного превращения арахидоновой к-ты по липоксигеназному пути образуются лейкотриены. Полагают, что лейкотриены С4 (ЛТС4), Дд (ЛТДл) и Е4 (JITEj) представляют собой SRS-A, поэтому ингибиторы лииоксигеиазы тормозят высвобождение SRS-A из тучных клеток и оказывают тем самым противоаллергическое действие.
Дегрануляция Т. к. и высвобождение из них медиаторов находятся под частичными контролем системы циклических нуклеотидов: циклического 3′,5′-АМФ (цАМФ) и циклического 3′,5′-гуанозинмоно-фосфата (цГМФ). Увеличение внутриклеточного содержания цАМФ ослабляет, а увеличение содержания цГМФ усиливает секрецию медиаторов. Однако в регуляции аллергической реакции Т. к. система аденилатциклаза — цАМФ имеет относительное значение. Аденилатциклаза Т. к. может быть стимулирована простагландинами Е (ПГЕ), гистамином и в значительно меньшей степени, чем в других клетках, стимуляторами Р-адренергических рецепторов. Противоаллергическое действие ингибиторов фосфодиэстеразы можно частично объяснить торможением выброса медиаторов из Т. к. за счет повышения содержания в клетках цАМФ.
Доказательство нецитотоксической природы дегрануляции Т. к. обосновало новый принцип подхода к контролю за аллергическими реакциями, состоящий в стабилизации этих клеток и торможении их функции. Противоаллергический препарат интал обладает стабилизирующим действием на Т. к. и тормозит высвобождение из них медиаторов в ответ на аллерген.
См. также Аллергия, Воспаление.
Библиогр.: Адо А. Д. Общая аллергология, М., 1978;
Виноградов В.В., Воробьева Н. Ф. Тучные клетки (Генез, структура, функции), Новосибирск, 1973;
Гущин И. С. Немедленная аллергия клетки, М., 1976; Елисеев В. Г. Соединительная ткань, с. 115, М., 1961; Серов В. В. и Шехтер А. Б. Соединительная ткань, с. 62, М., 1981; Хрущов Н. Г. Функциональная цитохимия рыхлой соединительной ткани, М., 1969; Юрина Н. А. и Радостина А. И. Тучные клетки и их роль в организме, М., 1977; Asboe-Hansen О. The mast cell, Int. Rev. Cytol., v. 3, p. 399, 1954; Boot J. R. a. o. The anti-allergic activity of Benoxaprofen [2-(4-Chloropheny])-a-Methyl-5-Benzoxazole acetic acidj-a lipoxygenase inhibitor, Int. Arch. Allergy, v. 67, p. 340, 1982; Fernex M. The mast-cell system, its relationship to atherosclerosis, fibrosis and eosinophils, Baltimore, 1968; Goetzl E. J. Mediators of immediate hypersensitivity derived from arachidonic acid, New Engl. J. Med., v. 303, p. 822, 1980; Ishizaka T. Membrane events in triggering mast cells for IgE-mediated histamine release, в кн.: Advanc. allerg. clin. immunol., ed. by A. Oehling a. о., p. 157, Oxford a. o., 1979; Laglinoff D. a. Chi E. Y. Cell biology of mast cells and basophils, в кн.: Cell biology of inflammation, ed. by G. Weiss manii, p. 217, Amsterdam — N. Y., 1980; Maximоw A. A. Bindegewebe und blutbildende Gewebe, Handb. d. mikr. Anat. d. Menschen, hrsg. v. W. Mollendorff, Bd 2, T. 1, S. 232, B., 1927; Rileу J. F. The mast cells, Edinburgh — L., 1959; Schauer A. Die Mastzelle, Stuttgart, 1964; Sedwick J. D., Holt P. G. a. Turner K. J. Production of a histamine-releasing lymphokine by antigen-or mitogen-stirnulated human peripheral T cells, Clin. exp. Immunol., v. 45, p. 409, 1981; Selye H. The mast cells, Washington, 1965; Velican C. a- Velican D. Histogenesis of mast cells, Folia histochem. cytochem., v. 1, p. 433, 1963; WassermanS. I. The lung mast cell, its physiology and potential relevance to defense of the lung, Environ. Hltii Perspect., v. 35, p. 153, 1980.
H. А. Юрина; И. С. Гущин (алл.).
Источник