В очаге острого воспаления нейтрофилы
Эффекты воспаления. Макрофаги и нейтрофилы при воспалении
а) Воспаление. При повреждении ткани независимо от его причины (бактерии, травма, химические агенты, тепло или любое другое явление) выделяется множество веществ, вызывающих существенные вторичные изменения в окружающих неповрежденных тканях. Весь комплекс этих тканевых изменений называют воспалением.
Воспаление характеризуется:
(1) расширением местных кровеносных сосудов с последующим избыточным местным кровотоком;
(2) увеличением проницаемости капилляров, что способствует утечке большого количества жидкости в интерстициальное пространство;
(3) часто — свертыванием жидкости в интерстициальном пространстве в связи с избытком фибриногена и других белков, вытекающих из капилляров;
(4) миграцией большого числа гранулоцитов и моноцитов в ткани;
(5) отеком тканевых клеток.
К тканевым продуктам, вызывающим эти реакции, относятся гистамин, брадикинин, серотонин, простагландины, несколько разных продуктов реакции системы комплемента, продукты реакции свертывающей системы крови и множество веществ, называемых лимфокинами, которые выделяются активированными Т-клетками (частью иммунной системы). Некоторые из этих веществ мощно активируют макрофагальную систему, и в течение нескольких часов макрофаги начинают уничтожать поврежденные ткани. Но иногда макрофаги повреждают еще живые тканевые клетки.
б) «Ограждающий» эффект воспаления. Одним из первых результатов воспаления является «ограждение» области повреждения от остальных тканей. Тканевые пространства и лимфатические сосуды в воспаленной области блокируются сгустками фибрина, поэтому через небольшой промежуток времени жидкость с трудом протекает через интерстиций. Этот процесс отгораживания задерживает распространение бактерий или токсических продуктов.
Интенсивность воспалительного процесса обычно пропорциональна степени повреждения ткани. Например, когда стафилококки проникают в ткани, они выделяют смертельно опасные клеточные токсины. В результате воспаление развивается быстро, гораздо быстрее, чем сами стафилококки могут размножиться и распространиться. Следовательно, для локальной стафилококковой инфекции характерно быстрое отгораживание, предохраняющее от распространения ее по телу.
Стрептококки, напротив, не вызывают такого интенсивного локального разрушения тканей. Следовательно, процесс отгораживания развивается медленно, на протяжении многих часов, в течение которых стрептококки успевают размножиться и мигрировать. В результате стрептококки часто проявляют гораздо более выраженную тенденцию к распространению в организме и развитию смертельных состояний, чем стафилококки, несмотря на то, что стафилококки гораздо более губительны для тканей.

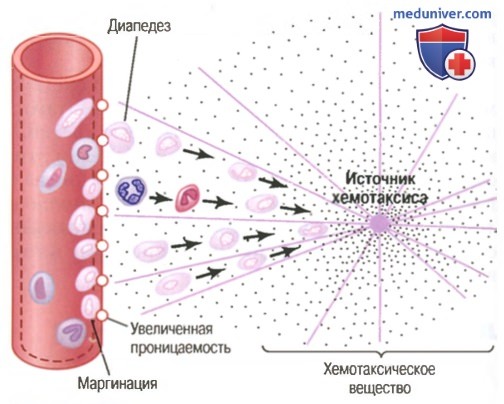
Движение нейтрофилов путем диапедеза через поры капилляров и путем хемотаксиса по направлению к области повреждения ткани
Реакции макрофагов и нейтрофилов во время воспаления
а) Тканевые макрофаги – первая «линия обороны» против инфекции. Тканевые макрофаги – первая «линия обороны» против инфекции. В течение нескольких минут после начала воспаления макрофаги, уже присутствующие в тканях, немедленно начинают свое фагоцитарное действие, будь то гистиоциты в подкожных тканях, альвеолярные макрофаги в легких, микроглия в мозге или др. При активации продуктами инфицирования и воспаления первым эффектом является быстрое увеличение каждого из макрофагов.
Затем многие из ранее неподвижных макрофагов отделяются от мест их прикрепления и становятся мобильными, формируя первую «линию обороны» против инфекции в течение примерно первого часа. Количество этих рано мобилизуемых макрофагов часто незначительно, но они спасают жизнь.
б) Вторжение нейтрофилов в воспаленную область является второй «линией обороны». В течение примерно первого часа после начала воспаления большое число нейтрофилов начинает внедряться в воспаленную область из крови. Этот процесс вызывается продуктами воспаленных тканей, которые инициируют следующие реакции:
(1) изменяют внутреннюю поверхность эндотелия капилляров, способствуя прилипанию нейтрофилов к стенкам капилляров в воспаленной области. Этот эффект, показанный на рисунке выше, называют маргинацией (или краевым стоянием лейкоцитов),
(2) ведут к разрыхлению сцеплений между эндотелиальными клетками капилляров и небольших венул, обеспечивая появление достаточно больших отверстий для прохождения нейтрофилов путем диапедеза непосредственно из крови в тканевые пространства;
(3) другие продукты воспаления вызывают хемотаксис нейтрофилов в направлении поврежденных тканей, как объяснялось ранее.
Таким образом, в течение нескольких часов после начала повреждения тканей область обильно заполняется нейтрофилами. Поскольку нейтрофилы крови — уже зрелые клетки, они готовы немедленно начать свои очистительные функции для уничтожения бактерий и удаления инородного материала.
– Также рекомендуем “Нейтрофилия. Защитные механизмы воспаления”
Оглавление темы “Клетки иммунитета. Виды иммунитета”:
1. Ретикулоэндотелиальная система. Макрофаги в лимфатических узлах
2. Альвеолярные макрофаги в легких. Клетки Купфера печени
3. Эффекты воспаления. Макрофаги и нейтрофилы при воспалении
4. Нейтрофилия. Защитные механизмы воспаления
5. Образование гноя. Эозинофилы и базофилы
6. Лейкопения. Лейкемии и его типы
7. Врожденный иммунитет. Приобретенный или адаптивный иммунитет
8. Типы приобретенного иммунитета. Лимфоциты в приобретенном иммунитете
9. Длительность жизни белых клеток крови. Нейтрофилы и макрофаги
10. Роль лимфоцитарных клонов. Происхождение клонов лимфоцитов
Источник
Участие нейтрофилов в возникновении и поддержании воспалительного процесса по существу является отражением их основной физиологической функции — фагоцитоза, в ходе которого высвобождаются вещества, способные вызвать воспалительную реакцию окружающих тканей, особенно если фагоцитоз по условиям патологического процесса протекает длительно, и факторы, вызывающие фагоцитоз, не могут быть устранены.
Поскольку при таких ревматических заболеваниях, как ревматоидный артрит или СКВ, существует хроническая гиперпродукция фагоцитируемого материала — иммунных комплексов и продуктов воспалительной деструкции тканей, роль нейтрофилов в усугублении и дальнейшем поддержании хронического воспаления особенно велика.
Процесс фагоцитоза начинается со связывания фагоцитируемого вещества с поверхностыми рецепторами нейтрофила, в результате чего происходит гиперполяризация мембраны клетки и местная” потеря ею ионов кальция. Вслед за этим происходит продукция нейтрофилами ранее малоизвестных активных дериватов кислорода, в том числе супероксидного аниона кислорода (O•) и особенно гидроксильного радикала (ОН•). Указанные продукты являются токсичными для микробов, что объясняет биологическую целесообразность их выработки в процессе фагоцитоза.
Однако при увеличенной продукции они способны вызывать также повреждение окружающих тканей организма. Следующим этапом является освобождение из фосфолипидов клеточной мембраны (под действием фермента фосфолипазы) арахидо новой кислоты, которая под влиянием циклооксигеназы окисляется в простагландины и другие химически близкие им вещества.
Одновременно совершается и собственно фагоцитирование, которое можно наблюдать под микроскопом: в нейтрофиле образуются выпячивания, охватывающие фагоцитируемый материал и погружающие его в цитоплазму, благодаря чему он оказывается лежащим внутриклеточно — в полости, называемой фагосомой.
В то же время происходят изменения в так называемой цитоскелетной системе («микромускулатура» клетки). Находящиеся в нейтрофиле микронити актина и миозина взаимодействуют с расположенным под плазмолеммой актинсвязывающим белком, после чего они конденсируются и контактируют с микротубулярной системой клетки. Лишь вслед за этим с фагосомой сливаются постоянно находящиеся в цитоплазме нейтрофилов специфические и азурофильные гранулы, а содержащиеся в них деструктивные ферменты приходят в соприкосновение с фагоцитированным веществом и начинается его внутриклеточное «переваривание».
Все описанные процессы происходят весьма быстро. В частности, освобождение ферментов из азурофильных гранул в фагосому может произойти через несколько секунд после взаимодействия с веществом, подвергающимся фагоцитозу.
Таким образом, нейтрофилы продуцируют 3 группы активных медиаторов воспаления.
1. Токсичные дериваты кислорода, активно взаимодействующие с тканями организма.
2. Производные арахидоновой кислоты, среди которых наиболее активны эндопероксиды (нестабильные простагландины Ga и Н2), тромбоксан А2, простациклин и гидроксигептадекатриеновая кислота. Эти вещества, являющиеся химически нестабильными и, следовательно, весьма активными, способны вызывать многие кардинальные признаки воспаления, в том числе накопление новых нейтрофилов (из-за присущих данным веществам хемотаксических свойств)[1].
Аккумуляция нейтрофилов вновь ведет к выработке нестабильных простагландинов, благодаря этому может возникать своеобразный порочный круг, ведущий к хронизации воспаления. Продукция нестабильных простагландинов сопроводи ется также дополнительным образованием из молекулярнс кислорода свободных кислородных радикалов, способствующ тканевой деструкции, а тем самым и поддержанию воспалительно процесса. В то же время стабильные простагландины (Е2 и F, тромбоксан Вз), в которые быстро превращаются их нестабильные предшественники, вопреки прежнему мнению, не являются первиными медиаторами воспаления.
В. Samuelsson и соавт. (1979) описали новый класс медиан ров воспаления, являющихся также метаболитами арахидоновой кислоты, — так называемые лейкотриены. Один из них (лейкотриен С), по-видимому, химически идентичен описанному ранее SRSA.
3. Деструктивные ферменты, содержащиеся в гранулах нейтрофилов и поступающие в процессе фагоцитоза не только в фагосому, но и внеклеточно. Возможно их повреждающее влияние и ткани организма. К таким ферментам относятся содержащиес в азурофильных гранулах нейтральные протеазы, миелопероксида за, а также собственно лизосомные ферменты — кислые гидрола зы, которым особенно свойственно повреждающее влияние н ткани. К ферментам, характерным для специфических нейтро фильных гранул, относятся лизоцим и лактоферрин.
Обилие медиаторов воспаления в нейтрофилах и их взаимно усиливающее влияние во многом объясняют важнейшую роль этих клеток при большинстве воспалительных процессов, в том числе у больных ревматическими болезнями. Не случайно G. Weissmanr (1979) назвал нейтрофилы секреторными органами ревматоидного воспаления.
В организме существуют антагонисты некоторых рассмотренных медиаторов, с помощью которых, по-видимому, ограничивается возможный поврежденный эффект фагоцитоза на окружающие ткани. Так, активность протеаз угнетается азмакроглобулином и a1-антитрипсином, а активность свободных радикалов кислорода — медьсодержащим белком церулоплазмином и особенно широко распространенным в организме ферментом супероксиддисмутазой, уничтожающей свободные супероксидные анионы кислорода и тем самым препятствующей образованию еще более токсичного гидроксильного радикала.
Оценивая роль нейтрофилов в развитии воспаления, следует иметь в виду их высокое содержание в периферической крови, откуда они могут быстро и в больших количествах поступать в зону воспаления. Эти клетки являются короткоживущими — они распадаются через несколько часов. Поэтому при выраженных.
[1] Нейтрофилы являются важным, но отнюдь не единственным источником простагландинов. Последние синтезируются также макрофагами, тромбоцитами, синовиальными клетками. воспалительных процессах повышенная потребность в нейтрофилах вследствие их усиленного распада в очагах воспаления приводит к увеличению продукции нейтрофилов в костном мозге, что проявляется увеличением соотношения лейко: эритро и индекса сдвига нейтрофилов при анализе миелограммы. Отражением этого процесса в периферической крови иногда бывает нейтрофильный лейкоцитоз.
Опубликовал Константин Моканов
Источник
Одним из подвидов гранулоцитарных лейкоцитов являются нейтрофилы. Созревают они в красном костном мозге. Как связаны между собой нейтрофилы и воспаление, какую роль они играют в защите организма?
Коротко о нейтрофильных гранулоцитах
Эти клетки белой крови достаточно крупные, имеют диаметр около 10 мкм. Свое название они получили из-за наличия в цитоплазме клетки зернистых гранул. Гранулы содержат особые антибактериальные ферменты, способные разрушать оболочку бактерий, внедрившихся при воспалении. При лабораторных исследованиях для определения количества клеток, мелкие зерна в виде пыли обрабатывают красителями, они окрашиваются в фиолетово-розовый цвет.
Зрелые нейтрофилы – большая группа, составляющая 2/3 от количества всех клеток лейкоцитов. При этом большее их количество находится в костном мозге, остальные распределяются по другим органам. И только небольшая часть (1%), достигая периферической крови, через несколько часов проникает в ткани. Продолжительность их жизни зависит от количества микроорганизмов в очаге воспаления.
Процесс образования нейтрофильных клеток лейкоцитов в костном мозге составляет примерно 5 суток. Затем они перемещаются по сосудистому руслу в течение 8–10 часов. За это время клетки, при столкновении с чужеродным агентом, уничтожают вредоносные частицы в очаге поражения.
Функции нейтрофилов при заболевании
Основная функция – защита организма при инфицировании. Нейтрофильные гранулоциты крови очень подвижны. В очаге поражения они выделяют особые ферменты, которые способствуют рассасыванию отмирающих тканей. Передвигаясь по сосудам, они находят инфицированное место, проникают сквозь стенки капилляров, поглощают и растворяют патогенные бактерии.
Для работы нейтрофилы, используют энергию, а получать ее могут даже без участия кислорода. Это дает Клетки крови возможность выполнять функции в очаге, где нарушено кровообращение. Нейтрофильные клетки лейкоцитов выделяют фермент лизосом, который способствует размягчению тканей в инфицированном очаге. Клетки захватывают вредоносные частицы и «переваривают» их.
Кроме того, они способны оказывать влияние на иммунитет. Гранулы выделяют в кровь регуляторное вещество, которое другие клетки воспринимают как сигнал для защиты организма. А также нейтрофилы содержат особые вещества, которые влияют на процесс свертывания крови.
Работа нейтрофильных лейкоцитов более всего распространяется на бактерии и грибки, на вирусы они реагируют слабо. Один нейтрофил способен уничтожить около семи микробов. Жизнь клеток продолжается от нескольких часов до нескольких суток, затем они нейтрализуются печенью и селезенкой.
Классификация нейтрофильных гранулоцитов
Исходя из формы ядра, нейтрофилы состоят из трех видов гранулоцитарных клеток: сегментоядерные, палочкоядерные и юные. В костном мозге всегда есть некоторое количество нейтрофилов. При патологических изменениях и по требованию организма происходит их выброс в кровь.
Начиная с зарождения и до полного созревания, нейтрофилы проходят шесть стадий развития. Одновременно организм может иметь клетки разных стадий созревания. Для постановки диагноза важным показателем есть соотношение четырех видов друг с другом в результатах анализов крови. По степени зрелости можно назвать следующие группы: миелоциты → метамиелоциты → палочкоядерные → сегментоядерные.
При наличии воспаления первыми начинают борьбу самые старшие клетки. Обычно их количества достаточно для нейтрализации бактерий в очаге. При серьезном воспалении функцию могут выполнять палочкоядерные, и даже совсем несозревшие клетки.
Образование полностью созревших клеток происходит только в костном мозге. Юные клетки у человека здорового в крови не присутствуют. Если болезнь приобретает осложненную форму, прежде всего, гибнут сегментоядерные клетки. При этом новые формы не успевают созревать, кровь наполняют незрелые нейтрофилы, изменяется формула лейкоцитов. Учитывая соотношение старших и молодых клеток, происходит сдвиг формулы в ту или другую сторону.
Нормы и аномалии нейтрофилов
Допустимый уровень нейтрофильных клеток у взрослых варьируют от 45 до 70% от уровня лейкоцитов. Для женщин и мужчин значения нормы практически одинаковы. Показатели отличаются у разных возрастных групп. В процессе роста у детей содержание нейтрофильных клеток изменяется. После шести лет лейкоцитарная формула у детей сравнивается с данными анализов у взрослых.
Состояние, когда нейтрофилы повышены, именуют нейтрофилией или нейтрофилез. Показатели умеренны, если литр крови содержит не более 10 миллиардов клеток, повышены, если их от 10 миллиардов до 20. Цифры от 20 до 60 свидетельствуют о тяжелой нейтрофилии. Нарушения формулы крови могут быть вызваны некоторыми патологиями:
- образование гнойного воспаления – ангина, перитонит, аппендицит, пиелонефрит, сепсис;
- отравление алкоголем или другими токсинами, действующими на костный мозг;
- разложение тканей в очаге новообразований;
- некрозы при ожоге, а также патология тканей во время инсульта или инфаркта.
Количество нейтрофилов держится выше нормы, какое-то время после патологического процесса. Чуть повышены нейтрофилы могут быть у беременных, после тяжелой физической нагрузки, а также после сытной трапезы.
Нейтропения свидетельствует о сниженном уровне нейтрофилов. Численность их колеблется от 1,5 до 0,5 миллиарда в зависимости от степени нейтропении. Такое положение наблюдается при недостаточной выработке клеток костным мозгом, гибели клеток при наличии тяжелого воспаления. Понижение нейтрофилов может быть связано с лучевой и химиотерапией, анемией или недостатком витаминов.
Некоторые рекомендации
Нейтрофилия и нейтропения не рассматриваются как заболевание. Но сдвиг формулы в одну или другую сторону, важный показатель для постановки диагноза. Лекарства для нормализации уровня нейтрофилов в крови нет. Врач должен установить причину нарушений, принять меры и назначить лечение для устранения обнаруженной патологии.
После лечения воспаления показатели сами приходят к нормальным цифрам. Если причина кроется в приеме лекарств, врач должен пересмотреть назначения, отменить неэффективные препараты или заменить другими. При недостаточном поступлении или усваивании питательных веществ, витаминов, минералов следует сбалансировать питание, начать прием витаминных и минеральных комплексов.
Источник
