Воспаление мягких тканей при переломах лечение
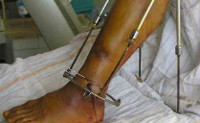
Посттравматический остеомиелит – это гнойное воспаление всех элементов кости, возникшее в результате травмы. Как правило, вызывается золотистым стафилококком, попадающим в рану непосредственно в момент повреждения, во время операции или последующих перевязок. Обычно протекает хронически, но возможно и острое течение. Проявляется повышением температуры, лейкоцитозом, болями и признаками воспаления в области травмы. При хроническом течении образуются свищи. Диагноз выставляется с учетом клинических данных и результатов рентгенографии. Лечение – антибиотикотерапия, вскрытие и дренирование гнойных очагов.
Общие сведения
Посттравматический остеомиелит (от лат. osteon кость + myelos костный мозг + itis воспаление) – одно из самых серьезных осложнений, возникающих после открытых повреждений скелета и операций на костях. По различным данным в 15-49% случаев развивается после открытых переломов и в 3% случаев – после хирургических вмешательств. Может выявляться у лиц любого пола и возраста. Вероятность возникновения увеличивается при тяжелых повреждениях с разрушением костей и обширным повреждением мягких тканей, интенсивном микробном загрязнении, несвоевременной или неадекватной хирургической обработке, наличии сопутствующих травм и заболеваний, снижающих сопротивляемость организма и утяжеляющих общее состояние больного.

Посттравматический остеомиелит
Причины
Причинами развития посттравматического остеомиелита при открытых переломах являются обширные поражения окружающих кость мягких тканей, интенсивное загрязнение раны, недостаточно радикальная или слишком поздняя первичная хирургическая обработка и отсутствие дренажа для оттока содержимого. Кроме того, вероятность нагноения возрастает в случаях, когда кость расположена близко к коже и плохо защищена мягкими тканями (например, передневнутренняя боковая поверхность большеберцовой кости).
Послеоперационный остеомиелит связан с инфицированием раны в процессе операции. Предполагается, что увеличение количества нагноений после хирургических вмешательств в последние годы обусловлено широким распространением остеосинтеза, а также появлением новых штаммов болезнетворных микроорганизмов, устойчивых к действию антибиотиков.
Факторами, увеличивающими риск развития остеомиелита после операций, являются:
- чрезмерная травматизация мягких тканей
- нестабильный или недостаточный остеосинтез
- коррозия металлоконструкций
- наличие очагов скрытой инфекции в организме пациента.
Разновидностью данной формы остеомиелита является спицевой остеомиелит – локальное нагноение кости при установке аппарата Илизарова или наложении
скелетного вытяжения
.
Патанатомия
Все виды посттравматического остеомиелита являются не местным процессом, а заболеванием всего организма, поскольку возникают под влиянием комбинации общих и местных факторов и вызывают поражение различных органов и систем, в том числе – расположенных далеко от гнойного очага. При остеомиелите воспаляются все элементы кости: костный мозг, надкостница и компактное вещество, а также окружающие мягкие ткани, однако первичное воспаление обусловлено попаданием патогенных микроорганизмов в костный мозг.
У больных с открытыми повреждениями костей при нагноении зона воспаления, как правило, ограничивается областью перелома, иногда развиваются краевые остеомиелиты. При обширных дефектах кожи и многооскольчатых переломах наблюдаются обширные гнойные процессы, захватывающие как всю кость, так и окружающие мягкие ткани. При посттравматическом остеомиелите воспаление локализуется в области хирургического вмешательства, гнойный процесс распространяется по ходу металлоконструкции (штифта, гвоздя, пластины).
Классификация
В современной травматологии и ортопедии выделяют следующие разновидности посттравматического остеомиелита:
- Собственно посттравматический – развивающийся при открытых переломах.
- Огнестрельный – возникающий после огнестрельных ранений.
- Посттравматический – развивающийся после операций.

КТ стопы. Посттравматический хронический остеомиелит пяточной кости с наличием секвестра (красная стрелка) и свищевого хода (синяя стрелка).
Симптомы посттравматического остеомиелита
Для патологии характерно хроническое течение (хронический остеомиелит). Наблюдается повышение температуры, по анализам крови выявляется нарастающий лейкоцитоз. Область раны отечна, гиперемирована, болезненна, из раны выделяется гной. После вскрытия и дренирования воспалительные явления стихают, количество гнойного отделяемого уменьшается, в области послеоперационной раны формируется свищ без тенденции к самостоятельному заживлению. При остром варианте посттравматического остеомиелита отмечаются интенсивные боли, повышение температуры до фебрильных цифр, явления общей интоксикации, значительный отек, ускорение СОЭ, выраженный лейкоцитоз и нарастающая анемия.
Диагностика
Диагноз выставляется врачом-травматологом на основании клинических симптомов. Первые рентгенологические признаки появляются лишь спустя месяц после начала заболевания. На снимках выявляется изъеденность концов костных отломков, секвестры и очаги деструкции, а также остеопороз вокруг металлоконструкций (при их наличии). При огнестрельном остеомиелите наблюдается сужение костномозгового канала, более выраженные периостальные наслоения и зона остеосклероза. Возможно наличие костных полостей. В окружающих мягких тканях иногда видны металлические осколки.

МРТ стопы. Остеомиелит таранной и большеберцовой кости с наличием обширной зоны деструкции костной ткани.
Лечение посттравматического остеомиелита
Основной задачей лечения является полная ликвидация гнойного очага и устранение воспаления. Основной метод лечения оперативный – вскрытие и дренирование. Вопрос об удалении металлоконструкций решается в индивидуальном порядке. При локализованных формах возможно сохранение остеосинтеза. При нагноении по ходу внутрикостных штифтов показано их удаление с последующим монтажом аппарата Илизарова. Во время хирургического вмешательства используют внутривенное или внутрикостное введение антибиотиков.
Для обеспечения устойчивого оттока устанавливают системы активного дренирования, производят постоянную аспирацию раневого отделяемого. Область нагноения орошают нитрофурановыми препаратами или антибиотиками. Все лечебные мероприятия осуществляют на фоне антибиотикотерапии, проводимой с учетом чувствительности возбудителя. При обширных очагах нагноения и выраженной общей интоксикации антибиотики вводят внутривенно или внутриартериально. Применяют иммобилизацию и УВЧ-терапию.
Прогноз и профилактика
Прогноз при посттравматическом остеомиелите зависит от тяжести поражения, своевременности и достаточной радикальности лечения, возраста больного, наличия сопутствующих травм и заболеваний и т. д. Исходом может стать костный дефект, ложный сустав, укорочение или угловая деформация конечности. Возможно образование длительно незаживающих свищей. Из-за подвижности фрагментов в области повреждения инфекция часто распространяется по кости, что затрудняет стабилизацию перелома и препятствует консолидации отломков.
Вероятность полного выздоровления уменьшается при застарелых формах посттравматического остеомиелита, что обусловлено нарушениями трофики, дистрофией кости и дефицитом полноценных мягких тканей в области гнойного очага. Профилактика заключается в предупреждении травм, ранней адекватной обработке ран и открытых переломов, обоснованном проведении хирургических вмешательств, соблюдении техники операций.
Источник
В клинической практике врачей любой специальности травма мягких тканей и опорно-двигательного аппарата занимает важное место. Наибольший уровень этого вида травм отмечается у мужчин в возрасте 20–50 лет, а у женщин – 30–59 лет, причем во всех возрастных группах данный показатель значительно выше у мужчин. По характеру повреждений около 50% травм – это вывихи, растяжения капсульно-связочного аппарата, травмы мышц и сухожилий, переломы костей верхних и нижних конечностей. Известно, что на любую травму организм отвечает неспецифической воспалительной реакцией – реактивным воспалением, которая является адаптационной и защитной реакцией и клинически проявляется болью, отеком и нарушением функции поврежденной области.
В лечении пациентов с повреждениями опорно-двигательной системы важной задачей является достижение быстрого и стойкого анальгетического эффекта, особенно в раннем посттравматическом или постоперационном периодах. Для решения этой задачи применяются нестероидные противовоспалительные препараты (НПВП), которые обладают как противовоспалительным, так и анальгетическим действием.
Как известно, действие НПВП основано, прежде всего, на ингибиции циклооксигеназ – ЦОГ-1 и ЦОГ-2. В современной фармакологии принято выделять селективные ингибиторы ЦОГ-1 и неселективные ингибиторы ЦОГ-1 и ЦОГ-2, преимущественно селективные ингибиторы ЦОГ-2 и высокоселективные ингибиторы ЦОГ-2 [1].
Позитивный лечебный эффект НПВП связан с подавлением активности ЦОГ-2 (циклооксигеназа 2-го типа). Этот фермент, участвующий в каскаде распада поврежденных при травме и других поражениях клеточных мембран, отвечает за выделение провоспалительных простагландинов и других медиаторов воспаления не только в суставах, но и в других органах и тканях, в первую очередь в стенках сосудов.
Выбор конкретного препарата определяется двумя основными параметрами: эффективностью и безопасностью [2, 3]. Длительное применение НПВП создает опасность целого ряда нежелательных реакций, основной из которых является их ульцерогенное действие. Чем более селективен препарат в отношении ЦОГ-2, тем менее выражен этот эффект, однако в то же время уменьшается анальгетическое действие препарата. У неселективных ингибиторов ЦОГ-1 и ЦОГ-2, наоборот, повышается риск нежелательных реакций со стороны желудочно-кишечного тракта (ЖКТ), но усиливается противовоспалительное и обезболивающее действие [1]. При необходимости проведения длительного курса лечения предпочтение обычно отдают селективным ингибиторам ЦОГ-2 [4].
Принципиальным моментом, который следует учитывать при выборе НПВП, считается скорость достижения клинического эффекта. Особое значение этот параметр имеет при купировании острых болевых синдромов, например травматического генеза. Известно, что НПВП с хорошей биодоступностью, максимально быстро создающие высокую пиковую концентрацию в крови, являются наиболее эффективными средствами для ургентного обезболивания. Быстрое развитие обезболивающего эффекта определяет необходимость их применения у пациентов с травмой и воспалением мягких тканей и опорно-двигательного аппарата. Однако большинство НПВП являются неселективными, что вызывает большое количество побочных эффектов и значительно снижает возможность использования лекарственных препаратов.
Преимущества селективных ингибиторов ЦОГ-2 в терапии болевых синдромов, в т.ч. при травме и в послеоперационном периоде, хорошо известны [5]:
1. Достоверное уменьшение частоты развития нежелательных явлений со стороны ЖКТ, почек, печени.
2. Отсутствие негативного влияния на синтез основных компонентов матрикса суставного хряща в отличие от неселективных НПВП.
3. Возможность длительного применения при заболеваниях и травмах суставов и пролонгация противовоспалительной терапии при необходимости (упорный синовит и др.).
Препаратом, обладающим указанными выше свойствами, является нимесулид. Ключевое значение имеет его высокая биодоступность – уже через 30 мин. после перорального приема достигается значимая концентрация препарата в крови, составляющая не менее 25% от максимальной. Полный обезболивающий и противовоспалительный эффект нимесулида отмечается через 1–3 ч после приема [6–8].
После перорального применения у здоровых добровольцев нимесулид (таблетка 100 мг) быстро всасывается и распределяется. Максимальная концентрация (Cmax) составляет от 2,86 до 6,50 мг/л, время до достижения максимальной концентрации (tmax) – 1,22–2,75 ч после применения. Средний период полувыведения – от 1,80 до 4,73 ч. Стабильный уровень концентрации достигается в течение 24–48 ч при ежедневном пероральном или ректальном приеме 2 р./сут. [9]. При клиническом использовании НПВП в течение длительного времени у пожилых пациентов, которые обладают повышенной чувствительностью к этим препаратам, довольно часто наблюдаются побочные эффекты [10]. Безопасной альтернативой в таких ситуациях является применение местных НПВП, что приводит к уменьшению системных побочных явлений.
Проведенное группой авторов исследование эффективности местного применения нимесулида показало, что данное лекарственное средство проникает трансдермально и достигает биофазы (синовиальной жидкости) в достаточной для производства его главной фармакологической активности (ингибирование ЦОГ) концентрации и, следовательно, оказывает положительное клиническое воздействие на болевой синдром, тугоподвижность суставов и адекватное функционирование пораженного органа [11]. Следует отметить, что степень проникновения препарата и скорость достижения биофазы зависят от его липофильности и увлажнения рогового слоя эпидермиса, а также от состояния барьерной функции кожи [12]. Клинический эффект данных средств определяется концентрацией действующего вещества, оптимальной терапевтической дозой, обеспечивающей анальгетический и противовоспалительный эффекты. Гели по сравнению с мазями являются более перспективной лекарственной формой, т.к. имеют рН, близкий к рН кожи, не закупоривают ее поры, быстро и равномерно распределяются. При их использовании создается высокая концентрация действующего вещества в периартикулярных тканях, а в кровоток препарат поступает в минимальной концентрации, не вызывающей каких-либо системных нежелательных реакций [13].
Клиническая эффективность топических средств при различных заболеваниях опорно-двигательного аппарата, включая травмы мягких тканей, суставов и связочного аппарата, была изучена в ряде исследований. Согласно полученным данным, в случае острой фазы артрита (первые 18 ч), как и в случае хронической фазы артрита (14 дней), гель нимесулид оказался эффективнее, чем гели диклофенак и пироксикам [14]. Применение нимесулида показало быстрое наступление лечебного эффекта. Авторами был сделан вывод, что хороший анальгетический эффект геля, содержащего нимесулид, позволяет применять препарат локально, что может быть более безопасным и эффективным методом лечения, чем назначение внутрь или ректально [15].
Основанием для проведения открытого сравнительного исследования геля диклофенак и геля нимесулид при РА послужил дискутируемый в литературе вопрос о выраженности анальгетического эффекта неселективных и селективных по отношению к ЦОГ-2 НПВП [16]. В результате оказалось, что анальгезирующий эффект обоих препаратов сопоставим. Выраженность боли в исследуемом коленном суставе достоверно уменьшалась как при ходьбе по ровной местности, так и при подъеме/спуске по лестнице в обеих группах. Скорость наступления эффекта была различной, в среднем составляла 30 мин., длительность аналгезии сохранялась от 4 до 6 ч, что свидетельствует о необходимости трехразового нанесения геля на пораженный сустав в течение суток. Эффект локальной терапии оценили как хороший 37,9% больных, применявших гель нимесулид, и 33,3% лечившихся гелем диклофенак, как удовлетворительный – 48,3 и 50% соответственно. Не отметили эффекта трое больных, получавших нимесулид, и пятеро – диклофенак. Переносимость гелевых форм была хорошей, побочных реакций (местных и системных) авторами не отмечено.
Согласно результатам метаанализа 86 рандомизированных клинических испытаний, в которых НПВП для местного применения сравнивались с плацебо, другими НПВП для местного использования или НПВП для перорального приема, локальные НПВП значимо превосходят плацебо по эффективности [13]. В этот обзор были включены исследования, в которых боль являлась клиническим исходом при острых (травма мягких тканей, растяжения и вывихи) или хронических заболеваниях (остеоартрит и ревматизм). Было показано, что при острых болях местное лечение эффективнее плацебо уже на 1-й нед., при хронических – через 2 нед. терапии. Нежелательные явления – как местные (3,6%), так и системные (0,5%) – встречались редко и были сопоставимы с плацебо. Согласно полученным данным, местное применение НПВП достоверно эффективнее плацебо, а число локальных (6%) и системных (3%) нежелательных явлений и количество больных, прервавших лечение из-за побочных реакций, было сопоставимым с числом больных, получавших наружно НПВП, и на фоне лечения плацебо [17].
В результате проведения оценки качества лечения больных остеоартрозом методом анкетирования исследователи выявили, что больные выполняют рекомендации врача главным образом в части проведения симптоматической терапии и широко используют местное лечение НПВП [18].
В некоторых ситуациях использование местных топических средств либо невозможно, либо не дает достаточного анальгезирующего эффекта, например при травме позвоночника и значительно выраженном болевом синдроме. В таких случаях необходимо и вполне оправданно использование пероральных анальгетиков, содержащих нимесулид. Так, исследование итальянских авторов показало высокую эффективность нимесулида у больных с переломом позвоночника на фоне остеопороза [19].
Применение пероральных форм нимесулида показало высокую клиническую эффективность и при острой патологии плечевого сустава [20]. Так, авторами в ходе двойного слепого плацебо-контролируемого исследования при сравнительной оценке эффективности обезболивания во время острого воспаления плечевого сустава установлено, что анальгезирующая способность нимесулида в дозе 100 мг значительно превосходит таковую диклофенака в дозе 75 мг при сравнимой безопасности применения. Аналогичные результаты были получены и в другом исследовании [21], в ходе которого проведена сравнительная оценка эффективности диклофенака и нимесулида при острой патологии плечевого пояса.
Хорошую эффективность и переносимость нимесулида у больных травматологического профиля зафиксировало исследование, проведенное группой итальянских исследователей среди детей с острой травмой в возрасте от 7 до 14 лет. В результате исследования обезболивающего потенциала нимесулида у этой категории больных установлено, что данный препарат обладает высокой анальгезирующей активностью, сравнимой с эффективностью наркотических анальгетиков, но при этом его использование не приводит к росту числа побочных эффектов от проводимой терапии [22].
Одной из самых частых причин обращения за медицинской помощью является спортивная травма, которая не сопровождается нарушением целостности костных структур, не требует оперативного лечения и длительной иммобилизации, но при этом ее наличие ухудшает качество жизни человека и требует обезболивания и эффективного купирования симптомов, таких как боль, отек и ограничение движений в конечности. При проведении мультицентрового исследования эффективности и безопасности лечения так называемых малых спортивных повреждений установлены эффективность и преимущества применения нимесулида у данных больных. Так, применение пероральной формы нимесулида в дозе 300 мг/сут. позволило полностью купировать симптомы повреждения и вернуться к привычной спортивной активности всем больным, получавшим лечение, при этом не зафиксировано побочных эффектов исследуемого препарата [23].
Заключение
Обзор современной литературы показал, что проведение лечебных мероприятий с включением в состав комплексной терапии НПВП, содержащих нимесулид, оказывается эффективным для различной патологии, в т.ч. и при травме мягких тканей и опорно-двигательного аппарата. В совокупности представленные данные свидетельствуют о хорошей переносимости и отсутствии системных нежелательных реакций, свойственных НПВП, при сравнительно высокой эффективности лечения.
Литература
1. Клиническая фармакология нестероидных противовоспалительных средств / под ред. Ю.Д. Игнатова, В.Г. Кукеса, В.И. Мазурова. М.: ГЭОТАР-Медиа, 2010. 576 с.
2. Насонов Е.Л. Нестероидные противовоспалительные препараты (Перспективы применения в медицине). М.: Анко, 2000.
3. Steinmeyer J. Pharmacological basis for the therapy of pain and inflammation with nonsteroidal anti-inflammatory drugs // Arthritis Res. 2000. Vol. 2 (5). Р. 379–385.
4. Moore R., Barden A., Barden J. Systematic review of dexketoprofen in acute and chronic pain BMC // Clin Pharmacol. 2008.
5. Боль (практическое руководство для врачей) / под ред. Н.Н. Яхно, М.Л. Кукушкина. М., 2012. 512 с.
6. Насонов Е.Л. Эффективность и переносимость нестероидного противовоспалительного препарата. Нимесулид: новые данные // РМЖ. 2001. № 15. С. 6–8.
7. Rainsford K. Current status of the therapeutic uses and actions of the preferential cyclo-oxygenase-2 NSAID, nimesulide // Inflammopharmacology. 2006. Vol. 14 (3–4). Р. 120–137.
8. Bennett A. Nimesulide a well established cyclooxygenase-2 inhibitor with many other pharmacological properties relevant to inflammatory diseases. In: Therapeutic Roles of Selective COX-2 Inhibitors. Editors Vein J.R., Botting R.M. William Harvey Press, 2001. Р. 524–540.
9. Bernareggi A. Clinical pharmacokinetics of nimesulide // Clin Pharamacokinetic. 1998. Vol. 35. Р. 247–274.
10. Ruoff G.E. Challenges of managing chronic pain in the elderly // Semin Arthritis Rheum. 2001. Vol. 32 (Suppl 1). Р. 43–50.
11. Erdogan F., Ergun H., Gokay N.S. et al. The diffusion of nimesulide gel into synovial fluid: a comparison between administration routes // International Journal of Clinical Pharmacology and Therapeutics. 2006. Vol. 44. № 6. Р. 270–275.
12. Хитров Н.А., Цурко В.В., Семочкина Е.Н. Локальная терапия остеоартроза // Лечащий врач. 2002. Vol. 3. Р. 48–55.
13. Moore R.A., Tramer M.R., Carall D. et al. Quantative systemic review of topically applied NSAID–s // Brit. Med. J. 1998. Vol. 316. Р. 333–338.
14. Gupta S.K., Prakash J., Awor L. et al. Anti-inflammatory activity of topical nimesulide gel in various experimental models // Inflamm Res. 1996. Vol. 45 (12). Р. 590–592.
15. Sengupta S., Velpandian T., Kabir S.R. et al. Analgesic efficacy and pharmacokinetics of topical nimesulide gel in healthy human volunteers: double-blind comparison with piroxicam, diclofenac and placebo // Eur J Clin Pharmacol. 1998. Vol. 54 (7). Р. 541–547.
16. Балабанова Р.М., Федина Т.П., Запрягаева М.Е. и соавт. Эффективность геля Найз (нимесулид) в качестве аддитивной терапии у больных ревматоидным артритом // РМЖ. 2008. № 16 (10). С. 684–687.
17. Mason L., Moore R.A., Derry S., Edwards J.E., McQuay H.J. Systematic review of topical for the treatment of chronic pain // BMJ. 2004. Vol. 328. Р. 991–994.
18. Замятина Е.А., Багирова Г.Г. Как лечатся больные остеоартрозом? Тезисы II Всероссийского конгресса ревматологов России. 2011. 27. № 98.
19. Rossini M., Bertoldo F., Lovato R., Bortolotti R., Gatti D., Adami S. Use of nonsteroidal anti-inflammatory drugs in patients with vertebral osteoporotic fractures // Reumatismo. 2002 Oct-Dec. Vol. 54 (4). Р. 340–343.
20. Wober W. Comparative efficacy and safety of nimesulide and diclofenac in patients with acute shoulder, and a meta-analysis of controlled studies with nimesulide // Rheumatology (Oxford). 1999 May. Vol. 38 (Suppl 1). Р. 33–38.
21. Wober W., Rahlfs V.W., Buchl N., Grassle A., Macciocchi A. Comparative efficacy and safety of the non-steroidal anti-inflammatory drugs nimesulide and diclofenac in patients with acute subdeltoid bursitis and bicipital tendinitis // Int J Clin Pract. 1998 Apr-May. Vol. 52 (3). Р. 169–175.
22. Facchini R., Selva G., Peretti G. Tolerability of nimesulide and ketoprofen in paediatric patients with traumatic or surgical fractures // Drugs. 1993. Vol. 46 (Suppl 1). Р. 238–241.
23. Calligaris A., Scaricabarozzi I., Vecchiet L. A multicentre double-blind investigation comparing nimesulide and naproxen in the treatment of minor sport injuries // Drugs. 1993. Vol. 46 (Suppl 1). Р. 187–190.
Источник
