Воспаление в децидуальной ткани
Прегравидарная (в дальнейшем – гравидарная) перестройка эндометрия – процесс, обеспечивающий успешную имплантацию эмбриона. В настоящее время в качестве его основных морфологических признаков рассматриваются своеобразные изменения поверхностного эпителия эндометрия (появление пиноподий) и «децидуализация» стромы эндометрия. Однако и исследователей, и врачей всегда «ставят в тупик» случаи внематочных беременностей: трубных, шеечных, яичниковых и даже брюшных. Ведь в этих органах нет эндометрия. Как в таких случаях происходит имплантация бластоцисты? Каким образом плацентация, прежде всего – при брюшной беременности, не сопровождается врастанием хориона в прилежащие к месту имплантации органы с их разрушением и неизбежным кровотечением? Разрыв маточной трубы при трубной беременности происходит, по-видимому, чаще из-за того, что в этом случае просто не хватает пространства для растущего плодово-плацентарного комплекса. Из всего этого возникает неизбежный вопрос: действительно ли эндометрий является уникальной структурой, обеспечивающей успешную имплантацию зародыша. Недавно это уже было в статье В.С. Корсака [1], описавшего случай доношенной брюшной беременности.
Фактами, от которых следует отталкиваться при поиске ответа на этот вопрос, являются описания в ряде работ, начиная с позапрошлого (!) века [2], обнаружения при патогистологическом исследовании «материала» внематочных беременностей участков «децидуальной ткани»1, называемых обычно эктопиями. Важно отметить, что децидуальная ткань обнаруживалась вне матки и при маточных беременностях, чему был свидетелем и автор этой статьи в период работы в лаборатории нормальной и патологической морфологии института акушерства и гинекологии АМН СССР [3]. Поскольку эктопии децидуа не сопровождаются обычно какими-либо клиническими симптомами, они обнаруживались, как правило, «случайно»: когда хирурги при операциях, например, при кесаревом сечении, удалении аппендикса у беременной и т. п., забирали для исследования необычного вида участки сальника, лимфоузлы или обнаруживали другие изменения в брюшной полости. Наконец, – «эктопии децидуальной ткани» обнаруживались при аутопсиях в случае смерти женщины во время беременности.
Для выяснения генеза «эктопий» децидуа следует напомнить процесс формирования в матке decidua basalis материнской части плаценты, в которую и имплантируется бластоциста в естественных условиях наступления беременности. Изменения эндометрия, направленные на его подготовку к восприятию зародыша, начинаются с так называемой его прегравидарной перестройки. Она развивается во второй (лютеиновой, секреторной) фазе менструального цикла и не зависит от наступления беременности. Ее начало совпадает с началом функционирования желтого тела, что говорит о безусловной роли в этом процессе прогестерона. Прегравидарные изменения эндометрия наиболее выражены в его компактном (поверхностном) и спонгиозном (промежуточном) слоях и в меньшей степени затрагивают базальный слой, остающийся источником регенерации эндометрия после менструаций и родов. В процессе прегравидарной перестройки компактного слоя отмечаются своеобразные изменения поверхностного эпителия (появление пиноподий), а также клеточных элементов и сосудов стромы. Они включают прежде всего такой процесс, как трансформация фибробластов межуточной ткани в клетки, напоминающие децидуальные. Они округляются, увеличиваются в размерах, накапливают гликоген и липиды, но пока не формируют крупные группы, характерные для истинной децидуальной реакции. Поэтому этот процесс называют децидуоподобной реакцией. Одновременно отмечается рост так называемых спиральных артерий, которые удлиняются и достигают поверхности эндометрия. Их стенки утолщаются, они становятся более извитыми и спирально закручиваются в «клубки». Изменение скорости кровотока и увеличение проницаемости стенок сосудов приводит к росту гидрофильности стромы компактного слоя, ее отеку и разрыхлению. Железы эндометрия, преимущественно губчатого слоя, становятся извитыми, увеличивается их просвет и возрастает секреторная активность. В них накапливается слизистый секрет, содержащий мукоиды, гликоген, глюкопротеиды и другие химические элементы [4].
Все эти изменения приводят к тому, что определяемая при ультразвуковом исследовании «толщина» эндометрия увеличивается с 1-3 мм (в фолликулярную фазу цикла) до 8-10 мм. Это именно та величина, на которую как оптимальную, обеспечивающую имплантацию бластоцисты, ориентируются специалисты, работающие по программам ВРТ.
Если оплодотворение не происходит и бластоциста не формируется, описанная децидуоподобная перестройка эндометрия претерпевает обратное развитие, а функциональный слой его после падения уровня прогестерона отторгается (менструация). Если же наступает беременность и формируется бластоциста, децидуоподобная реакция переходит в процесс «децидуализации эндометрия». Фибробласты стромы эндометрия при этом округляются и увеличиваются в размере в несколько раз (до 50 мкм), превращаясь в децидуальные клетки. В них появляются крупные гранулы гликогена и капли липидов. Они обогащаются белковыми веществами, в них обнаруживаются протеолитические ферменты, фосфатаза, гистаминаза, кальций, железо и другие химические элементы. С помощью микроворсинок на их поверхности децидуальные клетки объединяются в группы, что приводит к началу формирования decidua basalis. В ее состав, кроме децидуальных, входят также лимфомиелоидные клетки, главным образом – макрофаги и эндометриальные гранулоциты. Одновременно продолжает увеличиваться гидрофильность стромы эндометрия, происходит дальнейшее развитие сети спиральных артерий. Капилляры, проходящие в компактном слое под поверхностным эпителием, расширяются и принимают форму синусоиды. В железах спонгиозного слоя появляются сосочковые выросты, содержащие капилляры [4]. Ряд авторов [5] обозначают процесс децидуализации стромы эндометрия как генетически запрограммированное «ремоделирование ткани» (tissue remodelling), контролируемое гормонами (прогестерон, эстрадиол), простагландинами, гормонами роста, цитокинами и другими факторами.
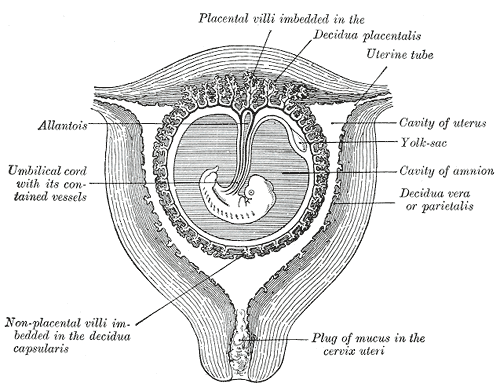
Достигшей полости матки бластоцисте необходимо «выбрать» место для имплантации. Как установлено [5-8], это происходит в результате сложных реципрокных взаимодействий бластоцисты и структур эндометрия. Главную роль в этом процессе играют так называемые молекулы клеточной адгезии. В настоящее время наибольшее значение придается интегринам, поверхностным гетеродимерным гликопротеинам, обеспечивающим адгезию клеток друг к другу, а также к компонентам внеклеточного матрикса. Экспрессия интегринов находится под контролем прогестерона, факторов роста и «информационных пептидных молекул» – цитокинов. Важно отметить, что механизмы рецепции, контролирующие взаимодействие бластоцисты и эндометрия, формируются в процессе децидуализации последнего. При этом продуцентами интегринов являются и эпителий, и «стромальные клетки» эндометрия [5]. В свою очередь и бластоциста (трофобласт) продуцирует сигнальные пептидные молекулы, в основном – цитокины: факторы роста, интерлейкины и др. Таким образом, в обмене химическими сигналами с бластоцистой «задействован» не только эпителий эндометрия, но и децидуальные клетки. При этом формирование именно decidua basalis является наиболее важной составляющей процессов, связанных с имплантацией бластоцисты, так как эта структура станет «маточной частью плаценты» и обеспечит маточно-плацентарный кровоток, а decidua capsularis и parietalis сформируют остальную часть децидуальной оболочки, в которой на протяжении всей беременности будут заключены эмбрион/плод, околоплодные воды и плацента. С началом секреции трофобластом хорионического гонадотропина (с 7-го дня после оплодотворения) этот гормон также становится одним из «сигнальных факторов» в «диалоге» между эмбрионом и организмом матери.
Таким образом, процесс децидуализации происходит в результате реакции фибробластов соединительной ткани на воздействие прогестерона. Поскольку фибробласты являются необходимым компонентом стромы любого органа, можно допустить, что децидуальная реакция при состоявшемся оплодотворении и сформировавшейся бластоцисте может иметь место не только в матке, но и в других органах и ее в этих случаях можно считать по сути не «эктопией», а результатом местной трансформации фибробластов стромы органа. При этом эмбрион, попавший, например, в брюшную полость (что происходит, вероятно, много чаще, чем мы думаем) или «застрявший» в трубе начинает получать биохимические «сигналы» от участков децидуальной ткани («я тут») и сам начинает направлять ей свои «сигналы». Так, обменявшись «приветствиями» с децидуальными клетками, зародыш начинает процесс имплантации. В результате «эктопическая децидуальная ткань» становится децидуальной оболочкой бластоцисты, и, как и при маточной беременности, выполняет те же функции, которые выполняет decidua basalis матки: и защитную, предохраняющую подлежащий орган от врастания в него ворсин хориона, и (до сформирования плаценты) функцию снабжения эмбриона питательными веществами (гистиотрофное питание), и функцию, обеспечивающую иммунологическую толерантность организма матери к «чужому» для нее плоду, и функцию защиты зародыша от патогенных микроорганизмов и т. д. Все сказанное позволяет признать реальным вывод о том, что эндометрий не является уникальной структурой, с только ей присущей способностью претерпевать прегравидарную и гравидарную трансформацию, а последняя носит закономерный общий для организма характер, который можно рассматривать как системную физиологическую реакцию клеток стромы органов на рост в организме женщины прогестерона.
Сделанный вывод, как было сказано выше, подтверждается рядом исследований. В России уже в начале прошлого века, в работах К.П. Улезко-Строгановой [9], первого руководителя лаборатории нормальной и патологической морфологии «Императорского клинического повивального института» в Санкт-Петербурге и в работах других авторов [10-14] было показано, что «децидуальному превращению» могут подвергаться клетки стромы брюшины, сальника, лимфоузлов, маточных труб, яичников, влагалища, аппендикса, мочевого пузыря, почек, диафрагмы, серозных оболочек плевральной полости, эндотелий кровеносных сосудов, даже – слизистая гортани.
Следует особо отметить, что до сих пор дискутирующийся в литературе взгляд на возможность трансформации клеток стромы в децидуальные в других, кроме матки, органах, как это ни удивительно («хорошо забытое старое») был с полной определенностью, подтвержденной собственными наблюдениями, высказан еще в 1887 г. в упомянутой выше работе А. Walker [2], описавшего 2 случая брюшной беременности.
Таким образом, можно допустить, что бластоциста, попавшая в брюшную полость, имплантируется не в ткань органа (сальника, маточной трубы, яичника и др. органов), а в сформировавшуюся в этих органах «родную» децидуальную ткань, в которой, как и в decidua матки после имплантации зародыша образуются «кровяные лакуны», в которые погружаются ворсины хориона и т. д. В результате формируется, как и в матке, децидуальная оболочка, а затем плацента и развивается, нередко – доношенная, беременность. Это позволяет также сделать вывод о том, что эмбриону для имплантации достаточно, вероятно, присутствия только децидуальной ткани.
Ярким свидетельством роли прогестерона в процессе «эктопической децидуализации» может служить сообщение L. Tang и соавт. [15], описавших случай обнаружения масс децидуальной ткани с кровоизлиянием в дугласово пространство у женщины с симптомами внутрибрюшного кровотечения. Как выяснилось, пациентка длительно применяла с целью контрацепции препараты прогестерона.
Вопросы, касающиеся распространенности и частоты «эктопической децидуализации», как и шансов эмбриона на успешную имплантацию, в этих случаях остаются открытыми, так как сообщения на эту тему появляются редко и, преимущественно, в виде описания отдельных случаев.
В связи с вышесказанным следует затронуть еще один важный аспект разбираемой проблемы. Он касается возникновения серьезных диагностических ошибок при обнаружении «эктопий» децидуальной ткани. Хотя опытный патогистолог без труда распознает децидуальную ткань, описаны случаи, когда эту ткань принимали за опухоль, чаще всего – мезотелиому, метастазы опухоли, особенно – при обнаружении участков децидуализации в лимфатических узлах, туберкулез и другие патологические процессы [16-18]. Это может иметь далеко идущие неблагоприятные, особенно – при беременности, последствия. Описаны и «обратные» ситуации, когда мезотелиома, в том числе и злокачественная, принималась за децидуальную ткань и необходимые лечебные мероприятия не проводились или проводились с опозданием [17, 19]. В этих случаях для дифференциальной диагностики в гистологической практике рекомендуют использовать специальный набор (панель) гистохимических реакций [20]. Описаны случаи внутрибрюшных кровотечений из мест эктопий децидуальной ткани [21], появление симптомов раздраженного кишечника при «децидуализации сальника» [22].
Отдельно cледует рассмотреть возникновение случаев пневмоторакса, в том числе – повторных, у молодых женщин в «перименструальном периоде», а также случаев судорожных приступов у молодых женщин, страдающих эпилепсией, также закономерно возникающих в перименструальном периоде [23, 24]. Поскольку прослежена четкая связь развития и пневмоторакса, и приступов эпилепсии с менструльным периодом, их еще называют «менструальным пневмотораксом» (catamenial pneumotorax – от греч. саtamenia – менструация), и «менструальной эпилепсией» (catamenial epilepcy). Что касается пневмоторакса, то здесь почти всегда есть морфологический материал для исследования, так как в большинстве случаев требуется оперативное вмешательство. Следует отметить, что нередко гистологически при менструальном пневмотораксе в плевре и диафрагме обнаруживаются наряду с типичной децидуальной тканью очаги эндометриоза. Поэтому последний рассматривают как основную причину пневмоторакса. Хотя в любом случае появление децидуальной ткани, в которой заложен механизм отслоения («отпадающая оболочка»), указывает на ее, возможно, ведущую роль в механизме возникновения этой патологии.
Понятно, что морфологический материал в случаях менструальной эпилепсии недоступен для изучения. Большинство авторов, описывающих случаи менструальной эпилепсии, связывают их, естественно, с гормональными изменениями в период менструации. Это логично. Однако поскольку они же одновременно считают, что многое в патогенезе приступов остается неясным, можно допустить предположение и о возможности трансформации каких-либо клеток ткани мозга мезодермального происхождения в децидуальные и их «задействование» в патогенезе приступов.
Поэтому возникающие при беременности (и вне ее у молодых женщин) патологические процессы неясного происхождения следует рассматривать и в аспектах возможной роли в этом «эктопий» децидуальной ткани.
Авторы заявляют об отсутствии конфликта интересов.
Источник
Decidualization is a process that results in ificant changes to cells of the endometrium in preparation for, and during, pregnancy. This includes morphological and al changes (the decidual reaction) to endometrial stromal cells (ESCs), the presence of decidual white blood cells (leukocytes), and vascular changes to maternal arteries. The sum of these changes results in the endometrium changing into a structure called the decidua. In humans, the decidua is shed during the third phase of birth.[1]
Decidualization plays an important role in ting placenta formation between a mother and her fetus by ting the invasiveness of trophoblast cells. It also triggers the production of cellular and molecular factors that result in structural changes, or remodeling, of maternal spiral arteries. Decidualization is required in some mammalian species where embryo implantation and trophoblast cell invasion of the endometrium occurs, also known as hemochorial placentation. This allows maternal blood to come into direct with the fetal chorion, a membrane between the fetal and maternal tissues, and allows for nutrient and gas exchange. However, decidualization-like reactions have also been observed in some species that don’t display hemochorial placentation.[2]
In humans, decidualization occurs after ovulation during the menstrual cycle. After implantation of the embryo, the decidua further develops to te the process of placentation. In the event no embryo is implanted, the decidualized endometrial lining is shed or, as is the case with species that follow the estrous cycle, absorbed.[1] In menstruating species, decidualization is spontaneous and occurs as a result of maternal hormones. In non-menstruating species, decidualization is non-spontaneous, meaning it only happens after there external als from an implanted embryo.[3]
Overview[edit]
After ovulation, the high levels of progesterone initiate the molecular changes leading to decidualization. The process triggers an influx of decidual leukocytes along with morphological and al changes of ESCs. The changes in the ESCs result in the endometrium developing a secretory lining that produces a variety of proteins, cytokines, and growth factors. These secreted factors will regulate the invasiveness of trophoblast cells that eventually form the placental connection if an embryo implants into the decidua.[4]
Decidual leukocytes[edit]
One of the identifying features of the decidua is the presence of large numbers of leukocytes that are mostly made up of specialized uterine natural killer (uNK) cells[5] and some dendritic cells. As the fetus consists of both maternal and paternal DNA, the decidual leukocytes play a role in suppressing the immune response of the mother to prevent treating the fetus as genetically foreign. Outside of their immune s, the uNK cells and dendritic cells also act as regulators of maternal spiral artery remodeling and ESC differentiation.[6]
Endometrial stromal cells (ESCs)[edit]
ESCs are the connective tissue cells of the endometrium that are fibroblastic in appearance. However, decidualization causes them to swell up and adopt an epithelial cell-like appearance due to the accumulation of glycogen and lipid droplets. Furthermore, they begin secreting cytokines, growth factors, and proteins like IGFBP1 and prolactin, along with cellular matrix (ECM) proteins such as fibronectin and laminin. The increased production of these ECM proteins turns the endometrium into the dense structure known as the decidua, which produces factors that te trophoblast attachment and inhibit overly aggressive invasion.[7]
During pregnancy[edit]
The decidual reaction is seen in very early pregnancy in the generalized area where the blastocyst s the endometrial decidua. It consists of an increase in secretory s of the endometrium at the area of implantation, as well as a surrounding stroma that becomes edematous.[8]
The decidual reaction occurs only in a few species such as humans. The decidual reaction and decidua are not required for implantation. Evidence can be taken from the fact that in ectopic pregnancy, implantation can occur anywhere in the abdominal cavity. Even after hysterectomy some women have become pregnant.[9]
Role in diseases and disorders[edit]
Abnormalities in decidualization have been implicated in diseases such as endometriosis, in which impaired decidualization leads to ectopic uterine tissue growth. Lack of decidualization has also been ed to higher rates of miscarriage.[10]
Chronic deciduitis, a chronic inflammation of the decidua, has been ed with premature birth.[11]
In re[edit]
The decidualization process is initiated by progesterone, but this requires cyclic adenosine monophosphate (cAMP) to act as the initial alling molecule to sensitize endometrial cells to progesterone. Consequently, human ESCs have been decidualized in culture with chemical analogs of cAMP and progesterone together. In vitro decidualization results in similar morphological changes to the human ESCs as well as upregulated production of decidualization markers such as IGFBP1 and prolactin.[7]
Mouse models have been extensively used for the identification of the molecular factors required for and involved in decidualization.[12]
See also[edit]
- Decidua
- Decidual cells
- Decidual reaction
References[edit]
- ^ a b Pansky, Ben (1982-08-01). Review of Medical Embryology. McGraw-Hill. ISBN 9780071053037 .
- ^ Kurjak, Asim; Chervenak, Frank A. (2006-09-25). Textbook of Perinatal Medicine, Second Edition. CRC Press. ISBN 9781439814697 .
- ^ Emera, Deena; Romero, Roberto; Wagner, Günter (2011-11-07). “The evolution of menstruation: A new model for genetic assimilation”. BioEssays. 34 (1): 26-35. doi:10.1002/bies.201100099. ISSN 0265-9247. PMC 3528014. PMID 22057551.
- ^ Brosens, Jan J.; Pijnenborg, Robert; Brosens, Ivo A. (November 2002). “The myometrial junctional zone spiral arteries in normal and abnormal pregnancies”. American Journal of Obstetrics and Gynecology. 187 (5): 1416-1423. doi:10.1067/mob.2002.127305. PMID 12439541.
- ^ Lash, G.E.; Robson, S.C.; Bulmer, J.N. (March 2010). “Review: al role of uterine natural killer (uNK) cells in human early pregnancy decidua”. Placenta. 31: S87-S92. doi:10.1016/j.placenta.2009.12.022. PMID 20061017.
- ^ Blois, Sandra M.; Klapp, Burghard F.; Barrientos, Gabriela (2011). “Decidualization and angiogenesis in early pregnancy: unravelling the s of DC and NK cells”. Journal of Reproductive Immunology. 88 (2): 86-92. doi:10.1016/j.jri.2010.11.002. PMID 21227511.
- ^ a b Gellersen, Birgit; Brosens, Ivo; Brosens, Jan (2007-11-01). “Decidualization of the Human Endometrium: Mechanisms, s, and Clinical Perspectives”. Seminars in Reproductive Medicine. 25 (6): 445-453. doi:10.1055/s-2007-991042. ISSN 1526-8004. PMID 17960529.
- ^ T. F. Kruger, M. H. Botha. Clinical Gynaecology; page 67. Juta Academic; 3rd edition (September 5, 2008). ISBN 0702173053
- ^ Nordqvist, Christian (29 May 2011). “Baby Who Developed Outside The Womb Is Born”. Medical News Today. Retrieved 2014-10-20. CS1 maint: discouraged parameter ()
- ^ Gellersen, Birgit; Brosens, Jan J. (2014-08-20). “Cyclic Decidualization of the Human Endometrium in Reproductive Health and Failure”. Endocrine Reviews. 35 (6): 851-905. doi:10.1210/er.2014-1045. ISSN 0163-769X. PMID 25141152.
- ^ Edmondson, Nadeen; Bocking, Alan; Machin, Geoffrey; Rizek, Rose; Watson, Carole; Keating, Sarah (2008-01-02). “The Prevalence of Chronic Deciduitis in Cases of Preterm Labor without Clinical Chorioamnionitis”. Pediatric and Developmental Pathology. 12 (1): 16-21. doi:10.2350/07-04-0270.1. ISSN 1093-5266. PMID 18171100. S2CID 25693917.
- ^ Ramathal, Cyril; Bagchi, Indrani; Taylor, Robert; Bagchi, Milan (2010-01-01). “Endometrial Decidualization: Of Mice and Men”. Seminars in Reproductive Medicine. 28 (1): 017-026. doi:10.1055/s-0029-1242989. ISSN 1526-8004. PMC 3095443. PMID 20104425.
External s[edit]
- Implantation stages Human embryology; developed by the universities of Fribourg, Lausanne and Bern (Switzerland).
- Histopathology Uterus – Decidual reaction Microscopic review of decidualization
Источник
